- +1
STTT:黄河/钱鹏旭团队揭示提高CAR-T疗效新方法
撰文丨王聪
编辑丨王多鱼
排版丨水成文
致癌突变的靶向治疗在携带突变癌基因的肿瘤中显示出疗效。然而,靶向治疗通常不能治愈疾病,因为继发突变和转录改变常导致对治疗产生耐药。CAR-T细胞疗法在复发或难治性B细胞恶性肿瘤中显示出强大疗效,即使是对靶向治疗耐药的B细胞恶性肿瘤。然而,由于T细胞耗竭和终末分化导致的CAR-T细胞的有限持久性限制了B细胞恶性肿瘤和实体瘤患者的CAR-T治疗后生存。
鉴于许多靶向药物的靶点也是CAR-T细胞的关键信号分子,将CAR-T细胞疗法与靶向治疗相结合,可能是延长CAR-T细胞持久性和克服各自单药治疗缺点的有效途径。遗憾的是,抑制这些信号分子也可能损害CAR-T细胞的效应功能。因此,需要研究评估每种靶向药物对CAR-T细胞的作用,以寻求治疗特定突变肿瘤的最佳联合方案。
2024年10月22日,浙江大学黄河/钱鹏旭团队在 Signal Transduction and Targeted Therapy 期刊发表了题为:MEK inhibition prevents CAR-T cell exhaustion and differentiation via downregulation of c-Fos and JunB 的研究论文。
该研究表明,MEK1/2抑制剂(MEKi)减弱了由基底信号(Tonic signaling)和抗原刺激引起的CAR-T细胞耗竭和终末分化,从而提高了CAR-T细胞对血液系统肿瘤和实体瘤的疗效。MEK抑制的效果与减少合成代谢和下调c-Fos和JunB的表达有关,而在CAR-T细胞中过表达c-Fos或JunB则会抵消MEK抑制的作用。
这项研究揭示了MAPK-c-Fos-JunB信号轴在驱动CAR-T细胞耗竭和终末分化中的关键作用。这些见解显著拓宽了MEKi在增强CAR-T细胞疗法有效性方面的潜在应用。

丝裂原活化蛋白激酶(MAPK)信号通路的基因突变是人类肿瘤中最常见的基因突变之一,可导致MAPK信号通路的异常激活。MAPK信号通路的典型级联是RAS-RAF-MEK1/2-ERK1/2级联。
MEK1/2抑制剂(MEKi)已被用于治疗携带RAF或RAS突变的肿瘤。越来越多的研究表明,MEKi的抗肿瘤作用不仅依赖于直接抑制肿瘤MAPK信号转导,还依赖于调节免疫。MEKi的这些作用部分是通过调节T细胞分化和肿瘤微环境,防止T细胞死亡来实现的。这些机制方面的认识推动了一项评估PD-1、BRAF和MEK抑制联合治疗实体瘤的临床试验并获得了良好结果。然而,MEKi对T细胞耗竭的影响以及MEKi调节T细胞的分子机制尚不完全清楚。
关于MEKi对T细胞作用的研究大多集中在小鼠T细胞上,MEKi对人类T细胞,尤其是CAR-T细胞的影响尚不清楚,且存在争议。一方面,有两个研究团队发现在体外实验中MEKi会削弱CAR-T细胞的效应功能。另一方面,另一个研究团队报道MEKi可以增强基于piggyBac转座子的方案制备的GD2 CAR-T细胞在小鼠模型中的疗效。
MEKi是否有益于基于慢病毒的主流方案制备的CAR-T细胞仍不清楚。因此,评估MEKi对CAR-T细胞的影响及其机制的研究迫在眉睫。
鉴于CAR信号通路与TCR信号通路相似,均涉及MAPK信号通路的激活,研究团队推测,MEKi可能通过减少冗余的CAR信号转导来减轻CAR-T细胞耗竭和终末分化。
目前,美国FDA已批准了多种MEKi,包括曲美替尼(trametinib)、考比替尼(cobimetinib)和比美替尼(binimetinib)。其中曲美替尼效力最强,IC50和给药剂量最低,体内半衰期最长,其对MEK1/2的特异性抑制作用也已被证实。
在这项最新研究中,研究团队证实,MEKi(尤其是曲美替尼)可以减少CAR-T细胞在基底信号(Tonic signaling)和抗原刺激下的活化、耗竭、凋亡和终末分化。将MEKi纳入CAR-T细胞制造过程中,可产生具有更多中央记忆、减少耗竭和增强体内疗效的细胞。此外,体内应用MEKi联合CAR-T细胞,比各自单独治疗产生更好的抗肿瘤效果。
从机制上来说,MEKi对CAR-T细胞的作用与转录重编程相关,其特征是记忆相关基因的上调,以及激活、耗竭、合成代谢相关和促凋亡基因的下调。此外,AP-1转录因子c-Fos和JunB的下调在驱动MEKi启动的转录重编程中发挥核心作用。在CAR-T细胞中过表达c-Fos或JunB可消除MEKi的作用。
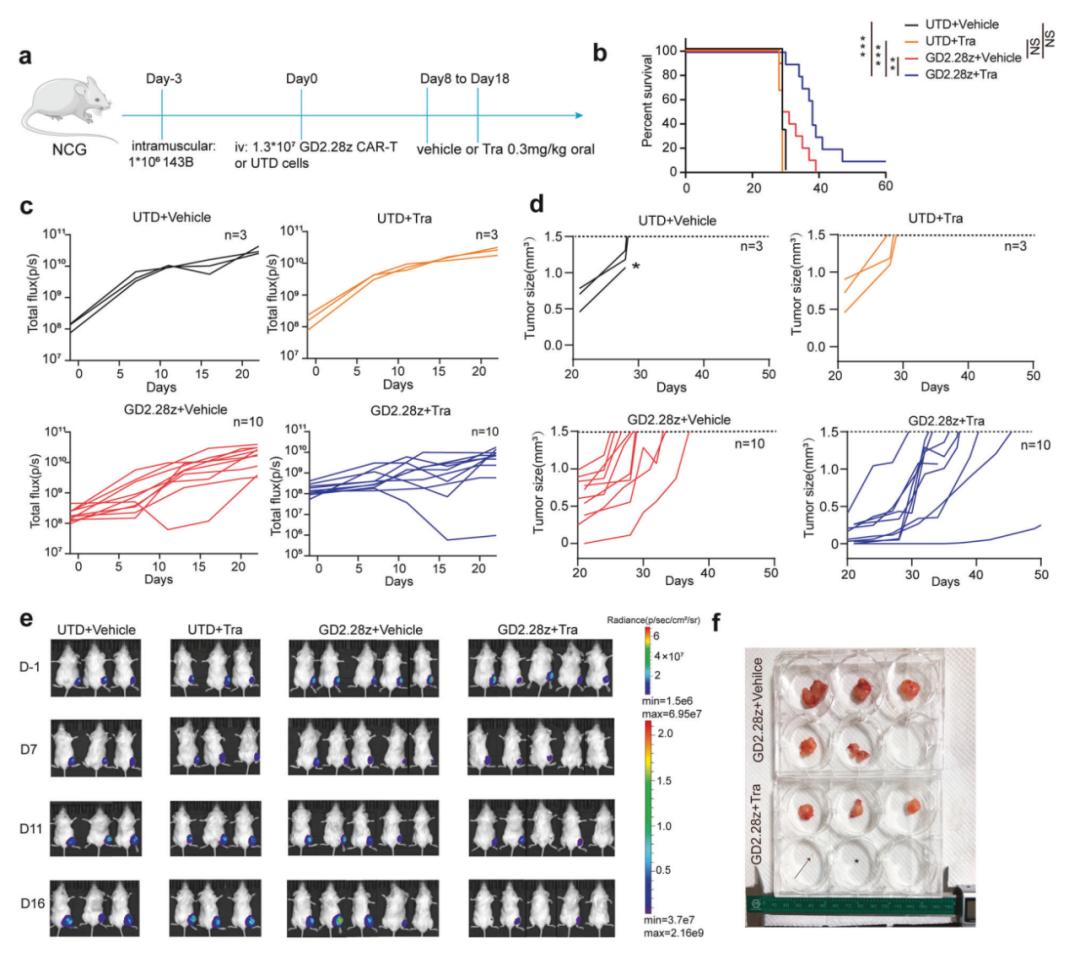
综上所述,该研究提出了一种新策略来增强CAR-T细胞疗法和MEK抑制剂(MEKi)的抗肿瘤疗效,并强调了c-Fos和JunB在驱动CAR-T细胞耗竭和终末分化中的作用。
论文链接:
https://www.nature.com/articles/s41392-024-01986-y
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




