- +1
Nat Commun | 急性应激时如何快速升高血糖?刘际团队发现HSL轴调节
快速的葡萄糖供应对动物在应激反应中的生存至关重要。下丘脑促肾上腺皮质激素释放激素(CRH)神经元如何精确控制应激诱导的葡萄糖释放的时间尺度尚不清楚。
2024年10月5日,中国科学技术大学信息科学与技术学院刘际团队在Nature Communications 上发表题为《Hypothalamus-sympathetic-liver axis mediates the early phase of stress-induced hyperglycemia in the male mice 》的论文,在该研究中,作者发现应激性高血糖在雄性小鼠中至少可以分为两个阶段:第一个快速阶段是由下丘脑(室旁到腹内侧下丘脑)-交感神经(白斑中缝核到中外侧核)-肝(HSL)轴活动介导的;第二个延迟阶段是由肾上腺活动介导的。阻断HSL轴的活性可削弱捕食诱发的逃跑反应,表明HSL通路的活性是应对应激所必需的。作者进一步揭示了下丘脑CRH信号的胞内级联,该级联是由GABAA受体β3亚基在S408/409位点磷酸化介导的,从而阻止GABAA受体膜募集。因此,作者揭示了应激时葡萄糖供应的精确时间尺度,分别由肾上腺非依赖性HSL和肾上腺依赖性途径介导。

急性应激时,CRH调节快速和延迟的葡萄糖释放
当面对压力源时,PVN中的CRH神经元被激活,导致肾上腺释放皮质酮。作者首先询问PVN中的CRH神经元是否调节葡萄糖水平。为避免摄食引起的血糖变化,实验前禁食小鼠12小时。通过化学遗传学方法作者发现,给药DREADD配体CNO显著增加CRH神经元的放电率和CRH神经元中c-fos的表达。
与对照组相比,腹腔注射CNO导致实验组血糖水平升高。为了进一步证实结果,作者采用光遗传学方法探究PVNCRH神经元的活性。正如预期的那样,脑切片的体外电生理记录显示,当暴露于蓝光时,PVNCRH神经元的活性增加。与化学遗传学数据一致,光刺激CRH神经元导致血糖水平和皮质酮水平显著升高,这表明PVNCRH神经元的激活确实能够调节葡萄糖水平。
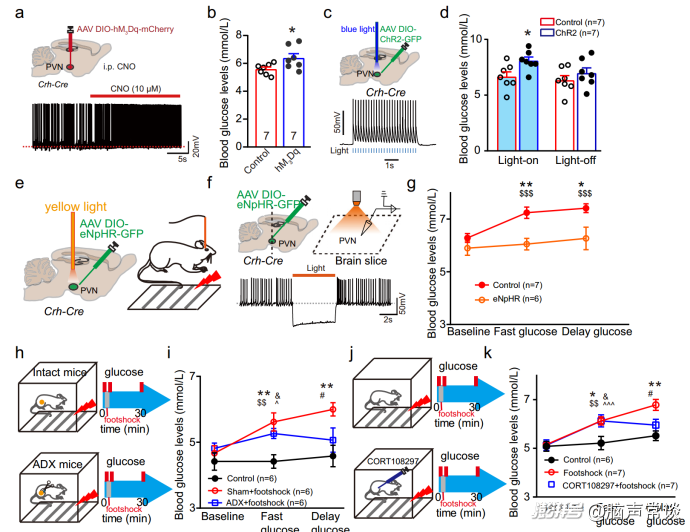
PVNCRH-VMH投射是应激时葡萄糖快速释放所必需的
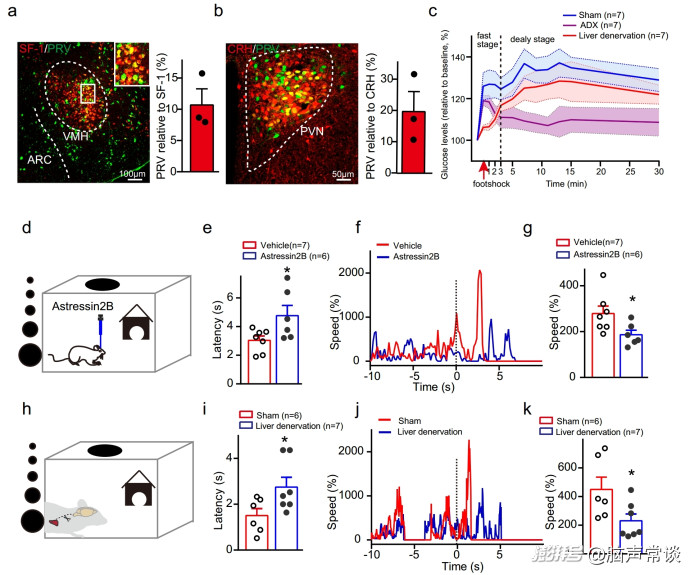
为了探索CRH神经元可能的下游靶点,作者化学激活了PVNCRH神经元,并对神经元活性标记物c-Fos进行了免疫染色。刺激PVNCRH神经元显著增加PVNCRH神经元中c-fos阳性细胞数量。有趣的是,作者还发现VMH中c- fos表达增加。SF-1在VMH中特异性表达。为了进一步测试VMH神经元是否参与应激反应,作者通过光纤记录钙信号发现在对急性身体应激(包括足部冲击、水喷雾和尾夹)的反应中,总体Ca2+信号变化20%(用ΔF/F表示)。这表明VMHSF-1神经元确实参与了应激反应。
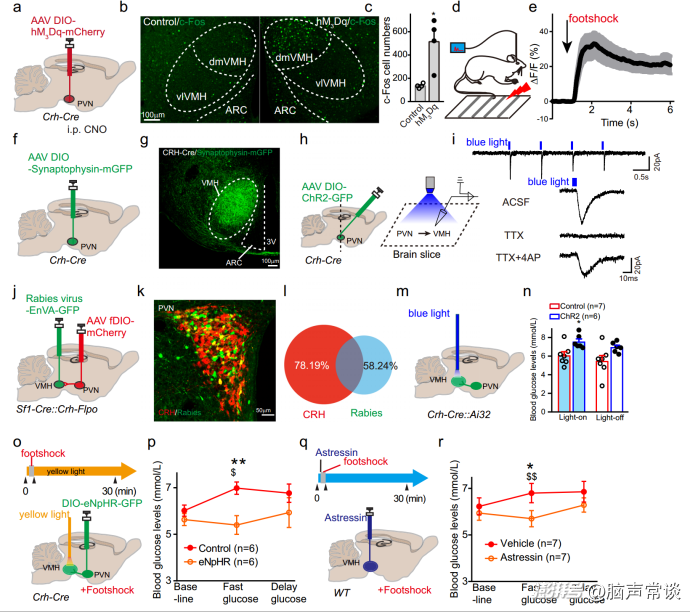
应激时由VMHCRHR2介导CRH启动的葡萄糖快速释放
CRHR1和CRHR2均广泛分布于大脑中,而VMH中CRH受体亚型以CRHR2为主。为了研究CRHR2是否在应激反应中负责葡萄糖调节,作者将不同的CRH受体拮抗剂注入VMH并测量血糖变化。应用CRHR1拮抗剂R121919显示血糖水平适度变化,而CRHR2拮抗剂Astressin2B与溶剂组相比,在足部休克应激期间阻断了葡萄糖的快速增加。同样,Astressin2B在面对水喷、尾夹等其他应激源时,阻断了葡萄糖的快速升高,但不阻断延迟期,证实了应激反应中CRH信号介导的高血糖主要是通过VMH中CRHR2的激活介导的。当作者将AAV-DIO-GFP注射到Sf-1-Cre小鼠中标记VMH神经元并使用特异性反义寡核苷酸检测CRHR2 mRNA时,作者发现大量的CRHR2 mRNA在VMH背内侧表达。
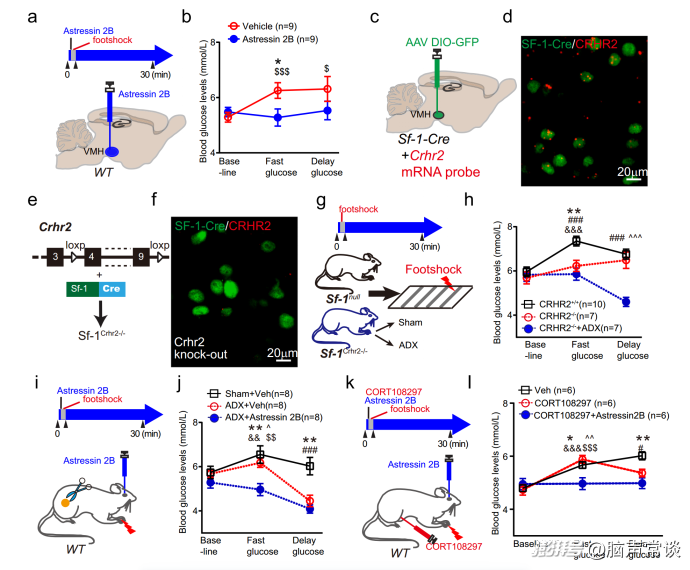
CRH通过VMH中β3 GABAA受体亚基调节抑制性突触传递
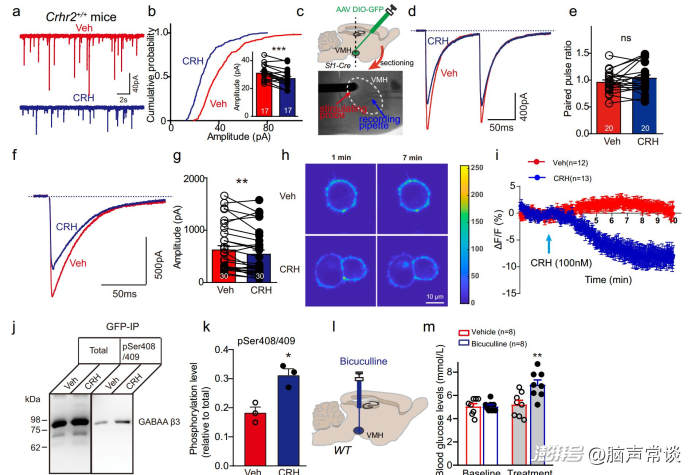
作者发现CRH刺激VMH神经元的活动。然而,这种兴奋作用是否由突触传递介导尚不清楚。为了回答这个问题,作者采用电压钳法记录VMHSF-1神经元的突触后电流。CRH的应用不影响自发兴奋性突触后电流(sEPSCs)。而灌注GABAA受体拮抗剂PTX阻断了CRH对动作电位放电的作用,表明抑制电流可能介导了CRH对VMH神经元活性的影响。事实上,CRH显著降低了自发抑制性突触后电流(sIPSCs)的振幅和频率。同样,敲除VMHSF-1神经元中CRHr2表达完全降低了CRH诱导的sIPSC幅度和频率抑制,提示CRHR2激活可抑制SF-1神经元的抑制性张力。

为了可视化GABAARs的细胞表面动力学,作者在N2a细胞系中表达pHluorin(一种ph敏感的GFP变体)标记的GABAAR亚基(β3和γ2)和CRHR2,以实时测量受体的迁移率。作者发现,响应CRH, β3 GABAAR亚基减少,而γ2亚基表达细胞没有发现显著变化。这一结果表明,含有β3亚基的GABAAR亚单位是CRH细胞内信号通路的特异性靶点。先前的研究表明,GABAAR亚基的膜转运很可能通过其胞内域的磷酸化来调节,特别是β3亚基的Ser408/409磷酸化位点。作者发现CRH给药后,Ser408/409的磷酸化程度显著增加。这些数据强烈表明,β3 GABAAR亚单位的Ser408/409磷酸化位点是VMH中CRH信号通路的特异性靶点。
下丘脑CRH信号通过HSL轴活性调控葡萄糖的快速释放
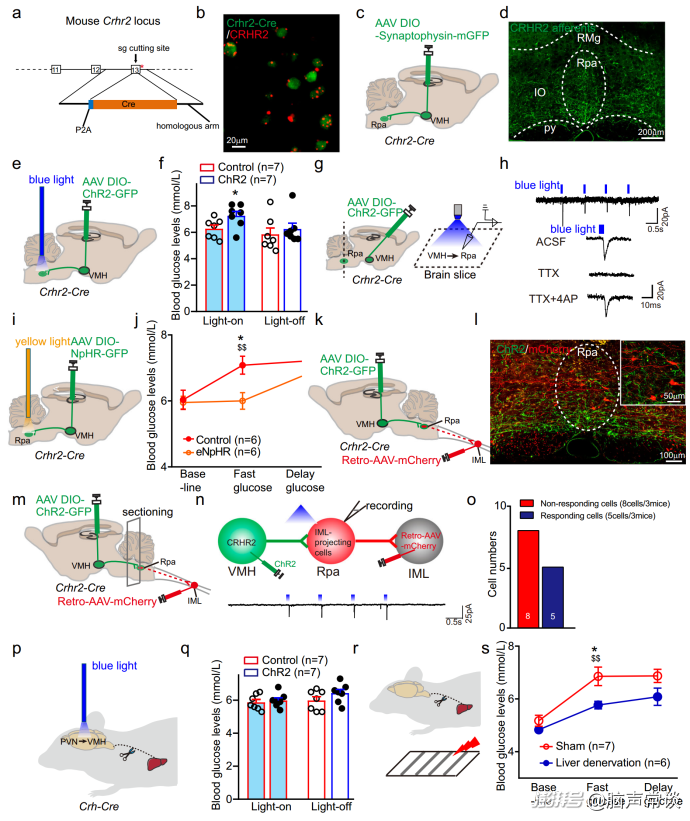
作者之前的研究表明VMH可以通过交感神经通路控制葡萄糖代谢。作者假设VMHCRHR2调节应激诱导的葡萄糖释放可以通过交感神经传入肝脏介导。为了验证这一假设,作者使用CRISPR-Cas9系统构建了CRHr2-Cre小鼠。首先,作者通过在CRHr2-Cre小鼠的VMH中注射顺行失踪病毒发现,在脑干区域,包括迷走神经背运动核(DMV)和苍白中缝核(Rpa),发现密集的标记终末,在孤束核(NTS)中发现少量纤维。光刺激VMHCRHR2 - Rpa通路可显著提高血糖。
为了测试VMHCRHR2是否与Rpa神经元形成单突触连接,作者在CRHR2神经元中表达AAV-DIO-ChR2。在蓝光照射下,Rpa神经元中发现了时间锁定的突触后兴奋电流,该电流可被突触前阻断剂TTX阻断,并被TTX + 4-AP恢复,表明VMHCRHR2与Rpa神经元之间存在单突触连接。
HSL轴介导的快速葡萄糖释放对于捕食诱导的飞行反应是必需的
为了进一步证实下丘脑CRH信号与肝脏之间的直接联系,作者在Sf-1-Cre小鼠的VMH中注射了AAV-DIO-mCherry,并在肝脏中注射了跨突触逆行示迹剂伪狂犬病毒(PRV)。作者在VMH中发现了大量的GFP+神经元,它们与mCherry标记的SF-1共定位,表明VMH-肝脏存在连接。在PVN中,作者还发现了gfplar标记的肝脏PRV的共定位和CRH的免疫染色,表明PVNCRH -肝脏存在投射。接下来,作者发现HSL轴活性在应激反应的早期(0-3分钟)是必需的,而肾上腺活性在应激反应的后期(3分钟)葡萄糖释放是必需的。
当面临潜在威胁时,快速能量供应对于动物的生存至关重要。接下来,作者想知道VMH中的CRH信号是否对于捕食性线索诱导的飞行反应是必需的。为了验证这一假设,作者在VMH中注射了CRHR2拮抗剂Astressin2B。在模拟接近的捕食者时,动物会开始逃逸并躲进巢穴。当通过局部注射Astressin2B阻断VMH中的CRH信号时,作者发现逃离巢穴的潜伏期延长,飞行速度降低。这表明VMH中的CRHR2对于捕食性线索诱导的飞行反应是必要的。
总结
在本研究中,作者定义了一个下丘脑-交感-肝脏轴,它在应激反应期间独立于肾上腺活动而介导快速葡萄糖释放。应激信号通过CRHR2介导的β3 GABAA受体膜招募来调节抑制性张力,从而整合到VMH中,作为血糖水平的中枢控制。
总之,作者发现应激肽CRH启动了由快速和延迟两个阶段组成的葡萄糖释放过程,分别由HSL和肾上腺激素调节。早期阶段由PVN-VMH-Rpa-交感神经系统介导,在急性应激期间维持快速的葡萄糖供应,这对动物在面对应激源时的生存至关重要。
找实验方法,上脑声常谈。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




