- +1
Science丨吗啡为什么能镇痛?从RVM到脊髓的调控网络
吗啡是一种广泛使用的有效镇痛药,可以缓解严重的急性和慢性疼痛。然而,由于成瘾性滥用的泛滥,吗啡已受到了严格的审查。尽管吗啡作用于多个中枢和外周的疼痛通路,但其镇痛机制的神经解剖基础并未完全阐明。
现有研究发现,脑干的腹内侧延髓(rostral ventromedial medulla, RVM)是影响疼痛体验的复杂大脑网络的最终共同输出节点。RVM损伤可以消除吗啡镇痛作用,而电刺激RVM则可以产生强大的镇痛效果。这些镇痛效果依赖于从RVM投射到脊髓的轴突束,激活从RVM投射到脊髓背角(dorsal horn)的神经元进而引起机械性镇痛,影响疼痛信息的加工,从而调节了逃避反射的增强或抑制。这些脊髓投射神经元还控制上行传递的加工,从而影响疼痛的情感和感知维度。
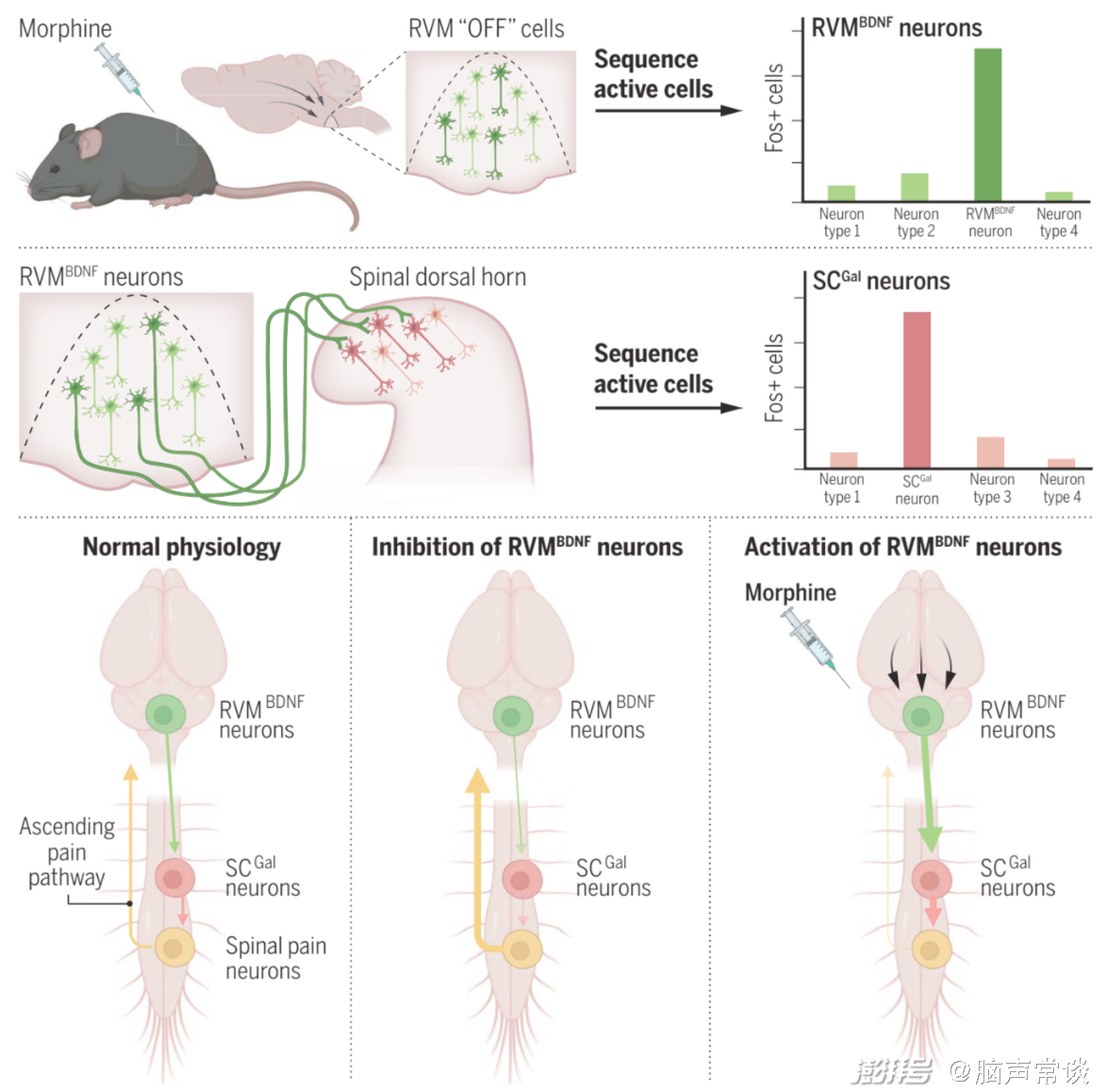
摘要图 鉴定调节吗啡抗伤害感受的神经元
根据RVM电刺激的强度,疼痛感受可以被增强或抑制。RVM中的5-羟色胺能神经元、GABA能神经元,甚至可能还有谷氨酸能神经元都参与了疼痛的调节。疼痛刺激与某些RVM神经元活动的增强或降低相关。吗啡镇痛所依赖的μ型阿片受体广泛存在于参与疼痛体验的所有神经底物中,实验证据也支持脊髓和多个脑区在镇痛中的参与。因此,RVM下行抑制对上行传递的相对贡献以及其中涉及的机制,一直是理解阿片类药物镇痛作用的一个重要问题。
8月30日,卡罗林斯卡医学院的Patrik Ernfors团队在Science杂志上发表论文Morphine-responsive neurons that regulate mechanical antinociception,探究吗啡诱导的机械性止痛在小鼠中的神经机制,发现了一组特定的神经元集群在RVM中对吗啡有反应,并在调节机械性疼痛敏感性中起关键作用。

图源:Science
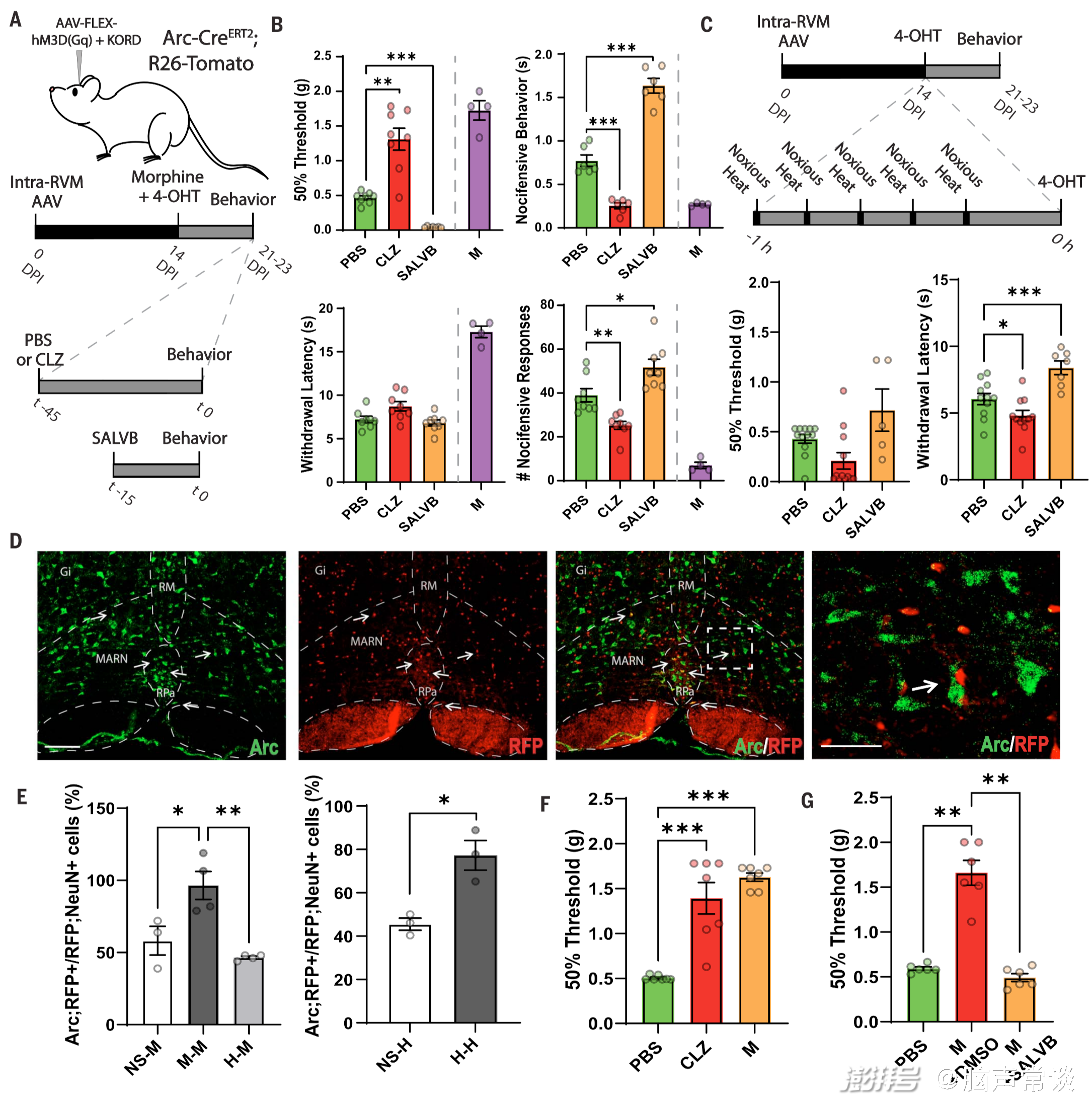
图1 RVM中的吗啡抗疼痛集合体
研究团队通过转基因小鼠实验发现了一组位于RVM中的神经元RVMBDNF,它们在调节机械性疼痛方面起着关键作用,并且对吗啡刺激具有反应。这些神经元属于一个特定的神经回路(RVM-脊髓回路),该回路可以调节机械性疼痛的感知,并赋予吗啡其镇痛特性。通过强制激活或抑制这些RVMBDNF神经元,研究人员可以模拟吗啡诱导的机械性镇痛效果,而抑制它们则可以完全逆转吗啡诱导的机械性镇痛,这一过程依赖于BDNF/TrkB信号通路,并且是通过激活脊髓上的抑制性神经元(galanin-positive neurons)来实现。研究人员通过,发现激活RVM中的吗啡反应性神经元可以增加脊髓背角浅层的神经元活性,而抑制这些脊髓神经元则可以完全消除RVM神经元激活或吗啡导致的机械性镇痛效果。
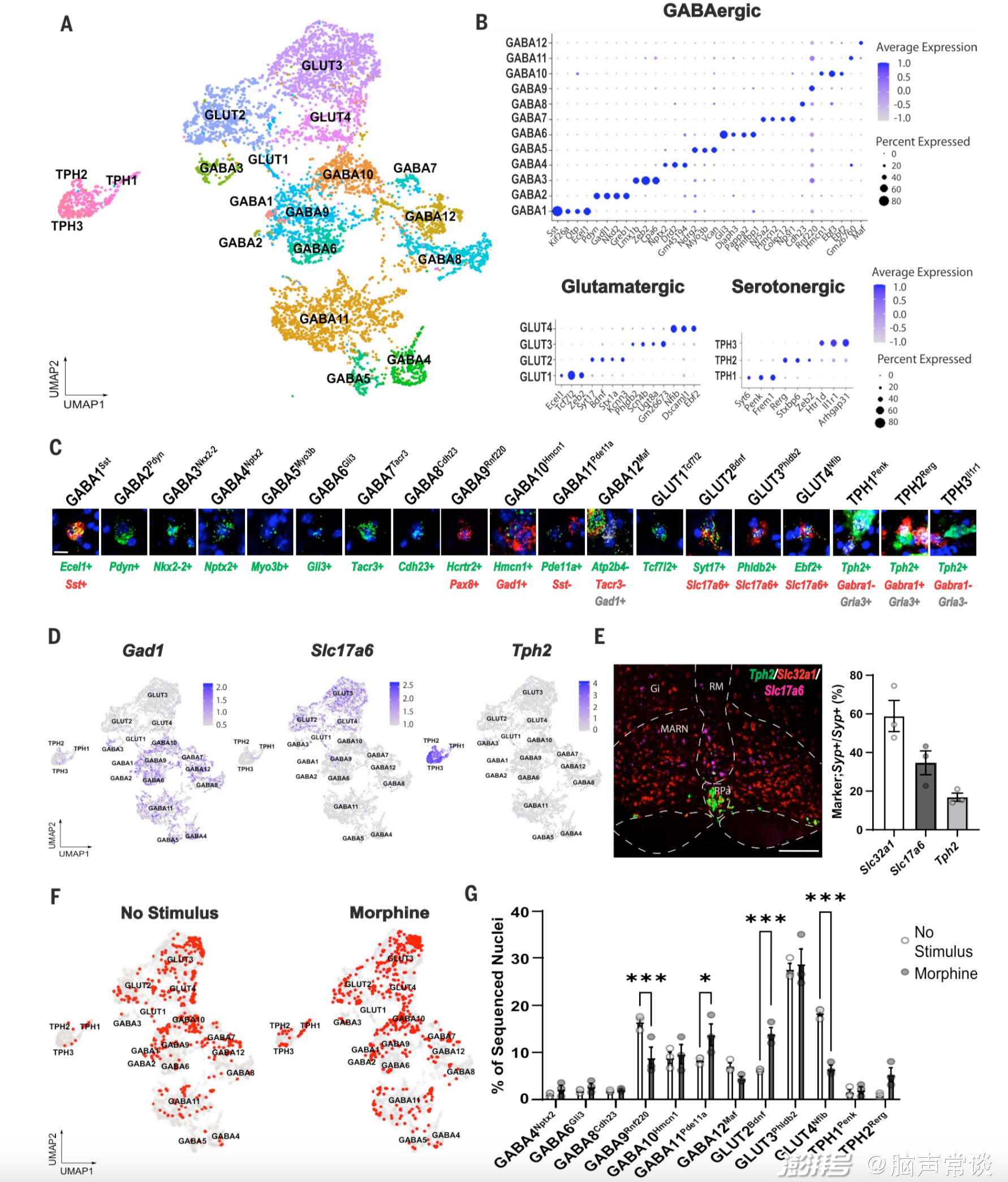
图2 吗啡抗疼痛效应相关的RVM神经元群体的分子特征
在进一步的验证中,研究人员结合TRAP和CANE(capturing activated neuronal ensembles)技术,发现通过激活RVM中的谷氨酸能神经元可以增加脊髓背角浅层神经元的活性,而这些脊髓神经元在介导镇痛效果中起关键作用;而抑制这些脊髓神经元可以完全消除RVM神经元激活或吗啡导致的镇痛效果,表明RVM中的谷氨酸能神经元在介导吗啡镇痛中起关键作用。单细胞转录组分析也进一步揭示这个结论,这些从RVM投射到脊髓的神经元包括抑制性神经元(GABAergic和serotonergic)以及少量的兴奋性神经元(glutamatergic),主要包含三种投射到脊髓的神经元类型:抑制性神经元、谷氨酸能神经元和少量的5-羟色胺能神经元。其中,谷氨酸能GLUT2神经元是RVM中对吗啡最敏感的神经元类型,在介导镇痛效果中起关键作用。而RVMBDNF神经元便是主要属于谷氨酸能神经元类型,RVMBDNF神经元中的一部分会投射到脊髓,通过脊髓向大脑传递感觉信息通路,从而影响机械性疼痛的感知。当使用化学遗传学方法激活这些BDNF神经元时,可以观察到脊髓中Excitatory 20(Ex20)和Inhibitory 8(In8)神经元的活性增加,表现为即时早基因(immediately early gene, IEG)表达的上调。这表明,RVMBDNF神经元可以通过激活脊髓中特定的兴奋性和抑制性神经元来产生镇痛作用。
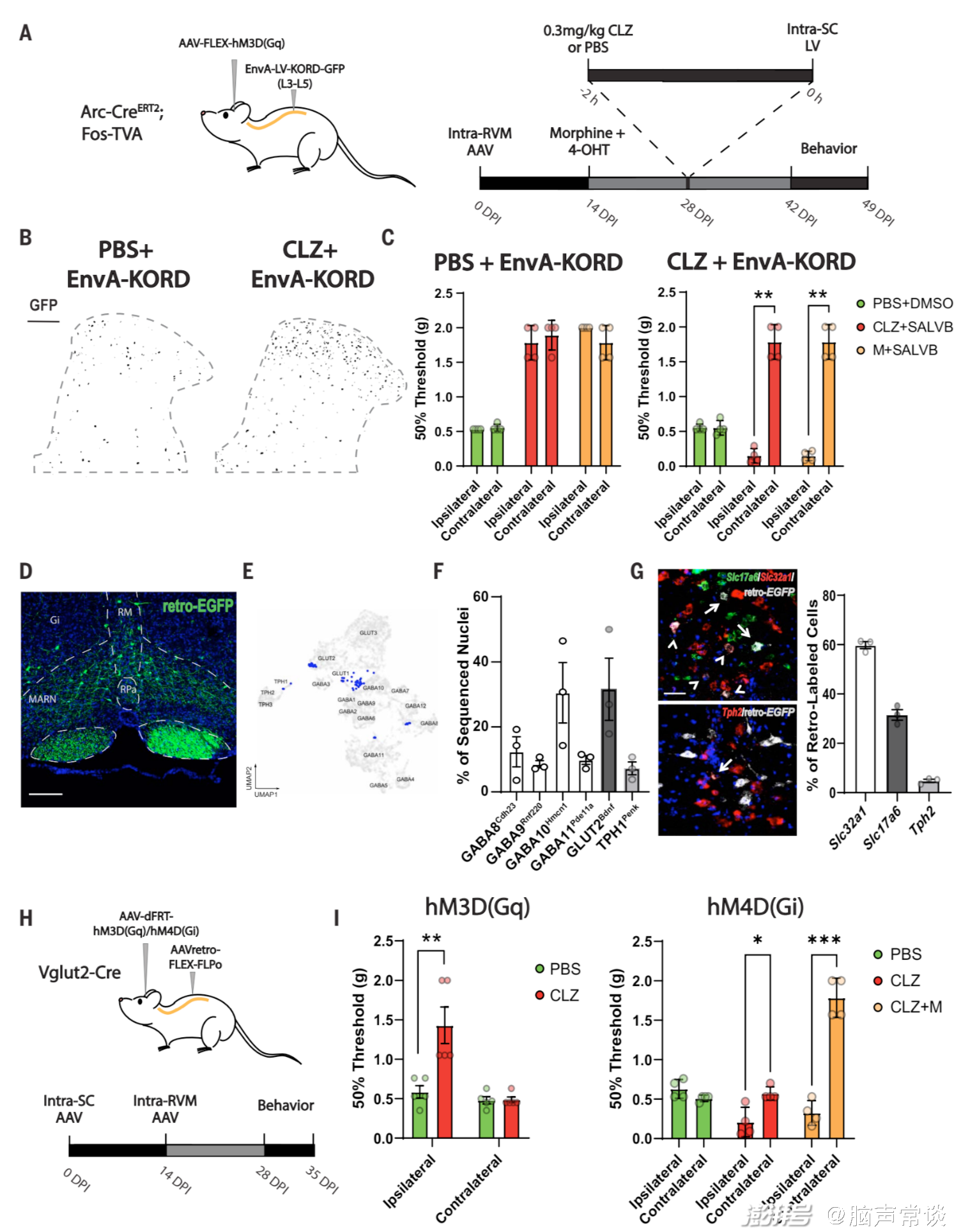
图3 吗啡引发的止痛作用是通过激活脊髓的兴奋性RVM神经细胞来实现的
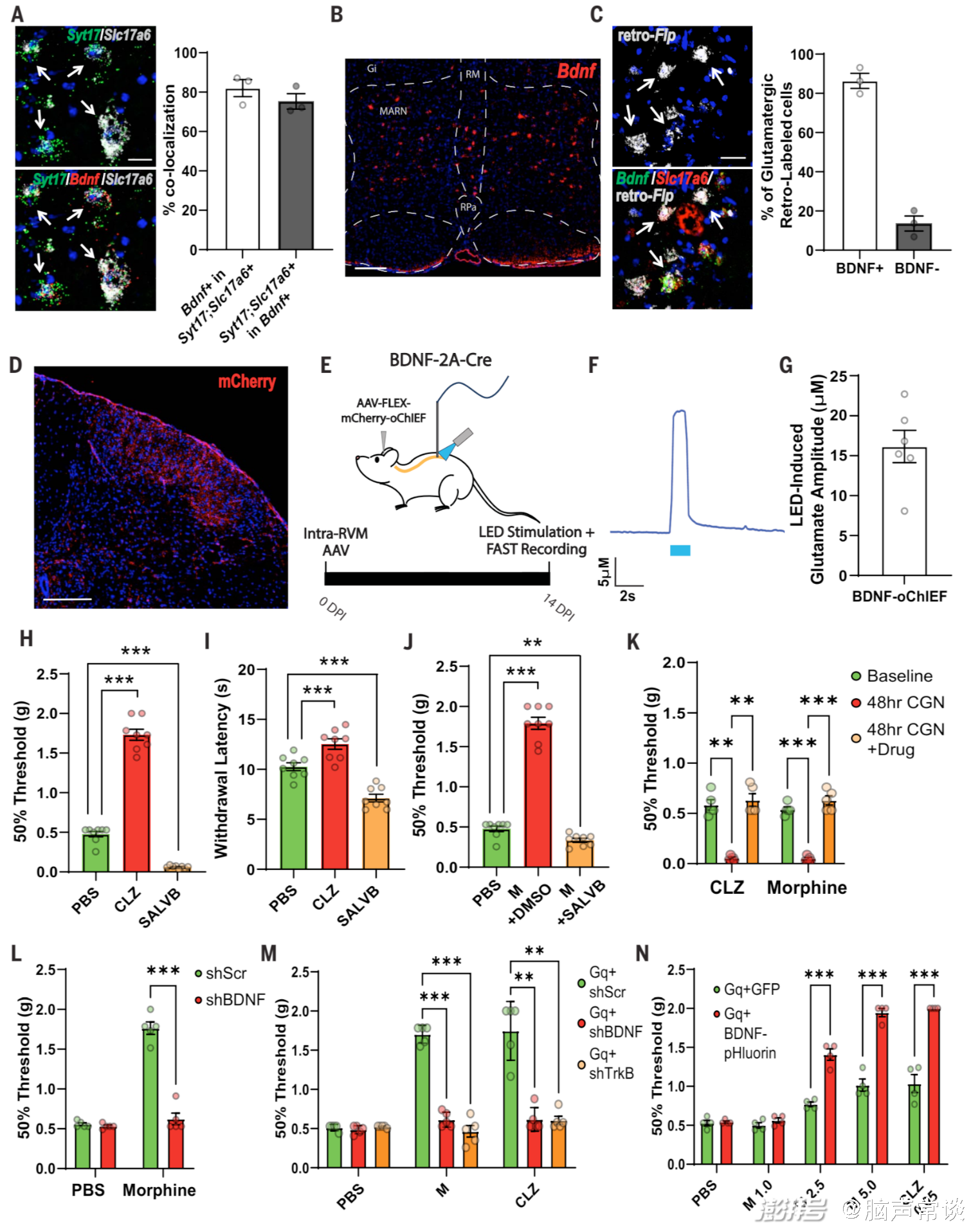
图4 RVMBDNF神经元介导的吗啡抗疼痛作用依赖于BDNF/TrkB
最后研究人员利用FAST(fast analytical sensing technology)技术结合光遗传学等方法,对神经元谷氨酸释放的动力学特征进行了检测。将光敏感离子通道蛋白oChIEF(Cre-dependent ChR2 variant)表达在目标神经元上,并用用蓝光刺激oChIEF表达的神经元轴突末梢,诱发谷氨酸的释放。然后在脊髓L4-L5区域植入微电极阵列,通过施加固定电位,可以检测到谷氨酸被氧化产生的电流变化,从而测量谷氨酸的浓度变化。研究人员通过分析谷氨酸浓度的最大振幅和80%的衰减时间,用以评估神经元活动的动力学特征。他们还通过数据分析,评估了不同神经元亚群在基线和给药条件下的活动变化,从而探究了神经元活动与疼痛感知的关系。这种结合光遗传学、电生理和生物信息学的多模态方法,为深入理解疼痛调控机制提供了新的研究思路。
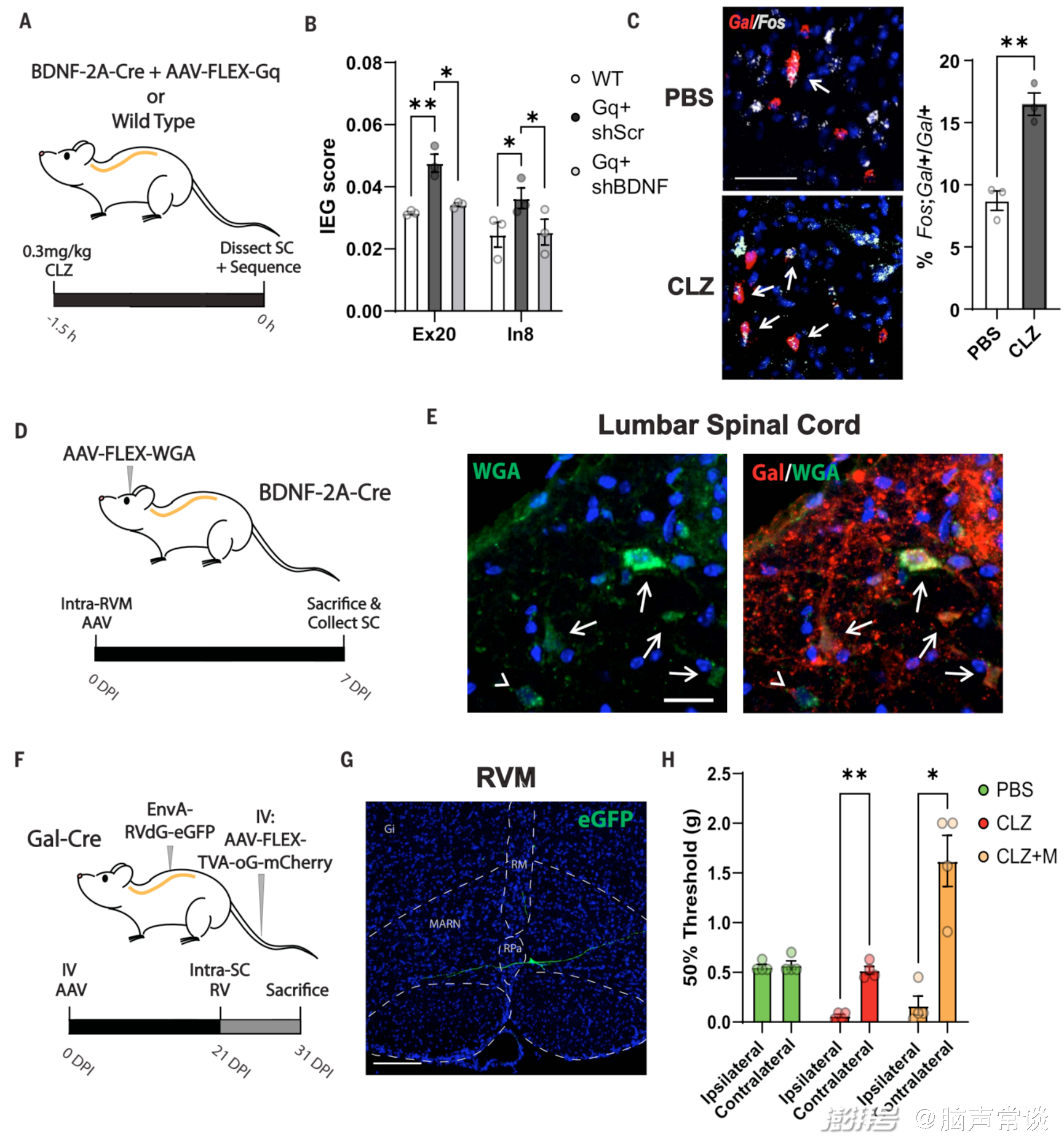
图5 吗啡在脊髓中的止痛机理
在该项研究中,该团队采用了多种实验手段,包括基因操控、行为学测试、病毒注射和组织学分析等,旨在从神经元活动的角度深入探究疼痛机制。首先,研究人员使用了多种转基因小鼠模型,包括Arc-CreERT2、Vglut2-Cre和BDNF-2A-Cre小鼠,通过基因操控标记和操控特定神经元群体,同时使用Gal-Cre转基因小鼠和C57BL/6J野生型小鼠作为对照。为了评估小鼠对热刺激和机械性刺激的反应,研究人员采用了Hargreaves热刺激实验、热板实验和胡椒素注射实验等行为学测试。此外,研究人员还进行了病毒注射实验,包括脑内注射、脊髓注射和静脉注射,利用不同病毒载体(AAV、EnvA-pseudotyped等)转染特定神经元群体,以操控和标记它们。为了检测和定量特定蛋白(如Arc、NeuN)在脑区和脊髓中的表达情况,研究人员采用了免疫荧光染色和定量分析实验,以评估神经元的活性和分布。最后,研究人员利用FAST技术测量神经元释放谷氨酸的动力学特征,以探究神经元活动与疼痛感知的关系;并采用免疫荧光染色和定量分析实验,以评估神经元的活性和分布。
热板实验是一种常用于评估小鼠对热刺激的反应的行为学实验方法。在这个实验中,小鼠被放置在一个正方形的透明塑料箱中,直接放在一个设定温度为48°C的热板上。实验人员会记录小鼠在2分钟内出现舔舐、咬咬、抖动等逃避反应的次数。这种热刺激可以引起小鼠的疼痛感知反应,从而评估其热觉敏感性。除了热板实验,研究人员还使用了Hargreaves热刺激实验来评估小鼠的热觉敏感性。研究团队利用Hargreaves热刺激实验用以评估小鼠的热觉敏感性。他们首先将小鼠放置在一个透明的塑料箱中,箱底为玻璃板,玻璃板下方放置一个辐射热源,用于照射小鼠的后爪。实验人员记录小鼠后爪出现逃避反应的时间,每只小鼠刺激3次,间隔2分钟。研究人员使用Arc-CreERT2小鼠用以捕获对吗啡和热刺激反应的神经元,他们首先给小鼠皮下注射10 mg/kg的吗啡,75分钟后注射50 mg/kg的4-羟基他莫昔芬(4-OHT),以此寻找吗啡激活的神经元。为了捕获热刺激反应的神经元,研究人员使用Hargreaves装置刺激小鼠的一只后爪,直到其出现逃避反应,重复5次,每次间隔10分钟,并在20分钟后,小鼠也被注射50 mg/kg的4-OHT。通过热板实验和Hargreaves实验,研究人员可以了解小鼠对热刺激的行为反应,为进一步探究疼痛感知的神经机制提供重要依据。这些行为学实验方法是神经科学研究中常用的工具,有助于揭示疼痛调控的神经生物学基础。
结论与展望
研究发现,RVM区域存在一群特定的神经元,它们对吗啡的刺激能作出镇痛反应。通过单细胞转录组学分析,研究者鉴定出这些神经元的分子特征,并发现其中部分兴奋性神经元表达BDNF。进一步的实验证明,强制激活这些RVMBDNF神经元可以模拟吗啡诱导的机械性镇痛效果,而抑制它们则可以完全逆转这一效果。这些结果表明,RVMBDNF神经元通过释放BDNF,激活脊髓抑制性神经元,从而调节机械性疼痛信号的传递,是吗啡镇痛的关键神经回路。此外,这项研究还采用了多种先进的技术手段,如单细胞转录组学、光遗传学、快速电化学检测等,为探索复杂神经系统功能提供了新的研究范式。例如,通过单细胞转录组学分析RVM区域的神经元亚群,得以成功鉴定出调控机械性镇痛的关键神经元群体。利用光遗传学技术可以精准地操控这些神经元的活性,从而揭示其在吗啡镇痛中的作用。此外,快速电化学检测技术还能实时监测脊髓内谷氨酸的动态变化,为理解神经递质调控机制提供了新的研究手段。这些创新性的技术手段为神经科学研究开辟了新的可能性。
这一发现不仅丰富了我们对吗啡镇痛机制的理解,也为开发新的镇痛药物提供了新的靶点。通过精准调控RVM-脊髓这一关键神经回路,有望设计出新一代更加有效且安全的镇痛药物,减少吗啡等传统阿片类药物的副作用。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




