- +1
【前沿进展】Nature Cell Biology丨俞立团队揭示中性粒细胞来源的迁移体是凝血系统的…
凝血的概念可以追溯到上世纪60年代,当时Davie,Ratnoff和Macfarlane分别在《自然》和《科学》上发表文章,描述了“瀑布”和“级联”理论,概述了原酶级联导致下游酶活化的基本原理【1, 2】。凝血系统是一个复杂的、相互关联的基本系统,在保持血液流动性的同时允许受伤的血管可以进行快速修复。通常认为凝血系统的组成部分包括血小板、凝血因子和血管壁等,当血管损伤时内皮细胞下方的细胞外基质会暴露出来,通过与血小板表面的多种受体结合,引发血小板粘附,随后触发血小板的激活和聚集,导致伤口处血小板栓的形成。同时,凝血级联反应的激活导致凝血酶的产生,凝血酶将纤维蛋白原降解为不溶性纤维蛋白。纤维蛋白形成交联网状物并大大加强血小板栓,从而产生止血栓完成止血过程。除了这些已确立的成分外,尚不清楚是否还有凝血系统的其他基本组成成分。
迁移体是2014年由清华大学俞立团队发现并命名的迁移细胞的细胞器。在细胞迁移过程中,细胞尾端产生收缩丝并被留在细胞的后缘,随后在收缩丝的末端或节点处会生长出来微米级的大囊泡状结构,即为迁移体【3】。2019年,俞立团队首次在活体动物中观察到迁移体的存在,并阐释了迁移体在胚胎早期发育过程中通过分泌信号分子形成区域信号中心调控胚胎器官形态发生的重要作用【4】;同时首次解析了迁移体生物发生的机制,揭示了四次跨膜家族蛋白(tetraspanin)通过在膜上组装聚集形成大结构域驱动迁移体产生的机制【5】。随后,研究团队于2021年发现在细胞应激条件下损伤线粒体会被选择性运输到迁移体中释放到细胞外维持线粒体质量和细胞稳态,该过程被命名为线粒体胞吐,对在体中性粒细胞的寿命维持具有重要作用【6】;同时与清华大学戴琼海院士团队合作,建立了高速、高分辨率、长时程的哺乳动物活体迁移体观测系统【7】。该团队后续的研究陆续揭示了鞘磷脂合成酶和磷脂酰肌醇磷酸激酶在迁移体生物发生过程中的调控机制【8, 9】、单核细胞迁移体在鸡胚血管新生过程中的重要角色【10】、以及迁移体在不同细胞间进行mRNA横向传输的关键作用【11】。
2024年7月12日,清华大学生命科学学院俞立教授团队在Nature Cell Biology上在线发表了题为Neutrophil-derived migrasomes are an essential part of the coagulation system的文章。该研究发现了人和小鼠血液中存在大量中性粒细胞来源的迁移体,这些迁移体特异性吸附凝血因子到其表面并可以迅速聚集到损伤部位激活血小板促进凝血反应。揭示了中性粒细胞来源的迁移体是凝血系统的基本组成成分。

为了在活体状态下观察和研究迁移体,研究人员开发并建立了可以用于迁移体观测的小鼠活体成像系统,发现中性粒细胞等免疫细胞会在血管内迁移并产生大量迁移体。为了对血液中迁移体的数量进行定量分析,研究人员建立了利用成像流式定量分析迁移体的方法,发现血液中中性粒细胞迁移体的数量大约为血小板数量的1/300(图1)。为了研究血液中大量存在的迁移体的生理功能,研究人员开发并建立了从血液中分离特定细胞来源迁移体的方法,通过结合差速离心和抗体偶联磁珠分选的方法,能够从小鼠和人的血液中分离纯化获得高纯度的中性粒细胞迁移体组分。随后为了验证该组分为迁移体,研究人员从形态结构、生化特征、标志蛋白等多方面对该组分进行了系统性鉴定,通过扫描电镜观察发现该组分为一微米左右大小的囊泡,同时连接着丝状结构,符合迁移体最典型的形态特征(图2);通过蛋白免疫印记检测发现该组分富集迁移体标志蛋白且基本不含外泌体等其它已知胞外囊泡或结构的标志蛋白;通过流式检测分析发现该组分为表面磷脂酰丝氨酸(PS)阴性,指示了该组分中基本不含微颗粒(microparticle)和凋亡小体。这些结果都指示着分离纯化获得的迁移体组分具有较高的纯度。
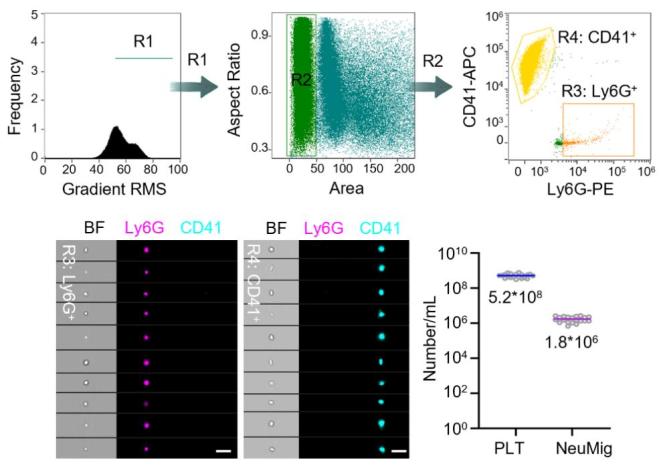
图1.
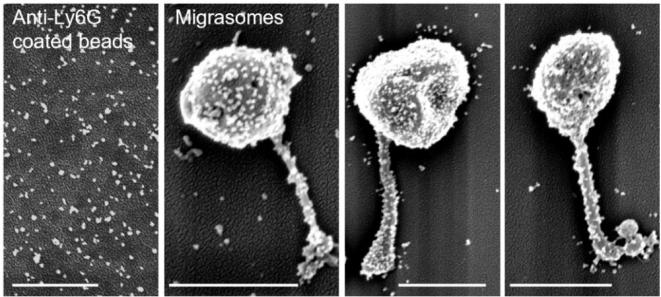
图2.
在成功获得高纯度迁移体组分之后,为了探索中性粒细胞迁移体的潜在生理功能,研究人员利用分离纯化的迁移体进行蛋白质组学分析,意外发现相对于血小板而言,大量凝血因子富集在迁移体组分中(图3),后续的蛋白免疫印记、免疫荧光染色和凝血酶活性检测进一步验证了这个现象。由于凝血因子是由肝脏分泌进入血液,研究人员怀疑迁移体上的凝血因子是从血浆中吸附而来。针对这个猜测,研究人员设计了蛋白酶K处理迁移体后再进行血浆孵育的实验,发现迁移体经蛋白酶处理后可以再次吸附凝血因子,验证了迁移体从血浆中吸附凝血因子的猜测,并基于此,研究人员猜测迁移体吸附凝血因子可能与迁移体膜的脂质组成有关。后续的脂质组学分析显示中性粒细胞迁移体具有特殊的脂质组成,使得迁移体可以有效吸附凝血因子,而中性粒细胞和血小板对凝血因子的吸附能力相比于迁移体明显较弱。从而解释了为什么中性粒细胞迁移体可以大量吸附凝血因子。
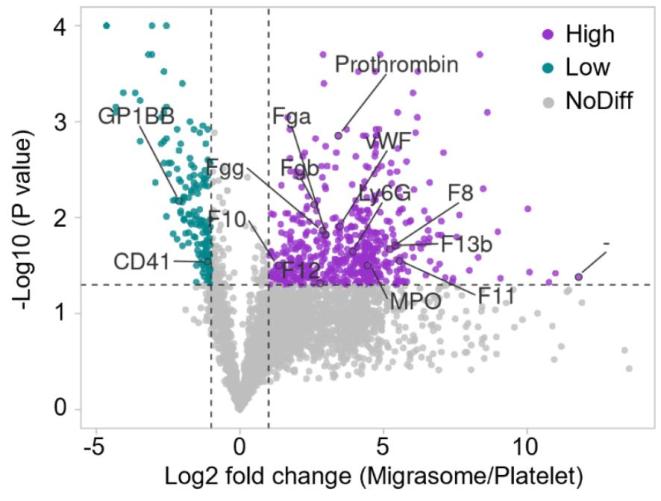
图3.
基于中性粒细胞迁移体富集凝血因子的发现,研究人员提出一个问题:中性粒细胞迁移体是否在凝血过程中发挥作用?为了探索这个可能性,研究人员首先建立了体外血小板激活的实验体系,发现将分离纯化获得的中性粒细胞迁移体与血小板在体外按高于1/20比例进行孵育后可以有效激活血小板,而当迁移体和血小板的比例低于1/50时激活现象不会发生,说明了当迁移体数量达到一定阈值后具备直接激活血小板的能力。为了直接在体内观察迁移体和血小板的作用,研究人员建立了在体观测系统,通过在小鼠组织器官上制造伤口进行迁移体和血小板在伤口处的在体观察。发现在远离伤口的位置,血小板和迁移体随血流在血管内高速流动,而在伤口位置,大量的中性粒细胞迁移体聚集并与血小板聚团形成团块(图4),暗示了中性粒细胞迁移体在伤口处大量聚集并激活血小板促进凝血。为了进一步验证该过程,研究人员同时建立了体外流道凝血系统,将全血以正常血液流速流经部分区域被胶原蛋白包被(模拟伤口区域)的流道,发现中性粒细胞迁移体会特异性聚集在胶原蛋白包被的区域,并与血小板发生聚团,而在没有胶原蛋白包被的区域几乎没有迁移体和血小板。这些结果进一步说明了迁移体会选择性快速聚集到伤口处达到特定数量后激活血小板促进凝血反应,而迁移体上大量富集的整合素等粘附分子决定了迁移体可以在暴露细胞外基质的伤口处大量聚集起来。
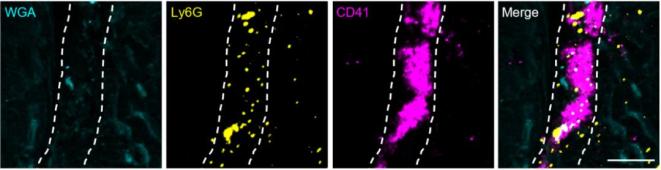
图4.
接下来,为了研究中性粒细胞迁移体对凝血的直接调控作用,研究人员首先在中性粒细胞清除的小鼠中利用小鼠尾尖流血的方法评估凝血系统的状态。发现体内清除中性粒细胞后,小鼠尾尖流血量明显增加,说明凝血系统出了问题。在此基础上,将从血液中分离纯化的中性粒细胞迁移体通过尾静脉注射回清除中性粒细胞的小鼠体内,发现出血量增加的表型明显得到缓解,说明中性粒细胞迁移体可以直接促进凝血反应阻止出血。同样的,在体外流道凝血系统中,发现清除中性粒细胞后血小板团块明显减少,支持中性粒细胞和迁移体在凝血中的重要作用。为了更进一步验证中性粒细胞迁移体在凝血过程中的功能,研究人员分别构建了迁移体调控基因Tspan9全身敲除和条件性敲除小鼠模型,并利用活体成像、成像流式和蛋白免疫印记等方法都验证了中性粒细胞迁移体产生减少。随后通过小鼠尾尖流血实验,发现在Tspan9全身敲除和条件性敲除小鼠里都出现了出血量增加的表型,重要的是这些表型都可以通过注射中性粒细胞迁移体得到有效缓解,进一步说明了中性粒细胞迁移体在凝血中的重要作用。
为了探索在人体中中性粒细胞迁移体是否具有同样的作用,研究人员从人外周血中分离原代中性粒细胞并在体外观察,发现这些细胞可以产生大量迁移体,指示了人体中性粒细胞具备产生迁移体的能力。同时利用类似于小鼠血液中分离纯化迁移体的方法,从人外周血中分离纯化获得了高纯度的中性粒细胞迁移体。定量蛋白质组学分析和蛋白免疫印记检测都发现人中性粒细胞迁移体中同样富集包括凝血酶在内的凝血因子,同时这些迁移体可以在体外有效激活人血小板。这些实验结果都与小鼠中观察到的现象一致,暗示着在人体中中性粒细胞迁移体同样是凝血系统的基本组成成分。
中性粒细胞作为先天免疫系统的重要组成部分,在感染和炎症过程中会最先响应并被大量动员起来。研究人员发现当利用细菌感染小鼠或利用脂多糖诱导小鼠炎症反应时,血液中中性粒细胞迁移体的数量会急剧增加数十倍,暗示着中性粒细胞迁移体的产生是免疫系统应对感染或炎症时免疫反应的一部分,同时也预示着由感染或炎症引起的凝血系统紊乱可能有迁移体的参与。
综上,研究人员发现了血液中中性粒细胞来源的迁移体是凝血系统的基本组成部分,揭示了凝血系统的新的元件,提供了更进一步理解和认识凝血系统的新视角(图5)。同时预示着中性粒细胞迁移体可能参与各种血栓性疾病或过度凝血性疾病,迁移体可能可以作为这些疾病的治疗靶点和早期诊断标志物。
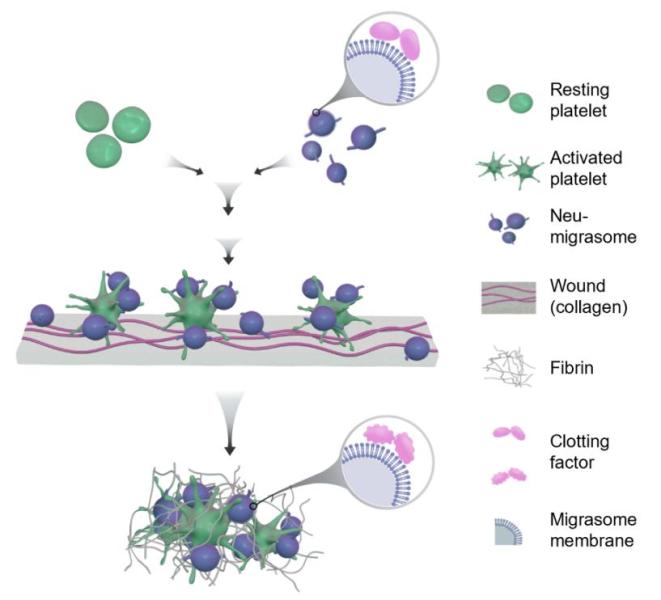
图5.
另外,值得一提的是,该研究首次开发并建立了一系列体内迁移体研究的方法和系统,包括利用成像流式、蛋白免疫印记、荧光成像等方法进行血液中迁移体的定量分析;利用差速离心和免疫磁珠法分离纯化血液中特定细胞来源的迁移体;利用扫描电镜、光镜成像、蛋白免疫印记等方法检测和鉴定迁移体;利用活体成像观测迁移体在生理状态和损伤部位的动态分布等。基于这些研究方法和研究系统,研究人员初步提出了血液中迁移体的鉴定标准和判断指征,为迁移体的生理病理功能研究、以及迁移体在疾病发生发展过程中的功能和潜在应用研究提供了重要依据。
该研究同时还发现了继信号分泌、物质传输、释放损伤细胞器之后的第四种迁移体功能模式,即作为生化反应平台参与到生命过程中。过去的研究显示迁移体的生理功能主要通过在正确的时间和空间释放迁移体内含货物来实现,该研究首次揭示了迁移体外挂货物的存在及其功能,开启了迁移体功能的新范式。这些研究方法的建立和新的发现为迁移体生物学研究提供了新的手段和新的研究方向,有助于促进迁移体生物学的进一步发展。
清华大学生命科学学院俞立教授为本文的通讯作者。清华大学生命科学学院博士后、北京生物结构前沿研究中心卓越学者姜东为本文第一作者,其也是第一次建立迁移体研究动物模型并首次解析迁移体生理功能的第一作者【4】、首次建立迁移体研究小鼠模型并解析线粒体胞吐生理功能的共同第一作者【6】、以及建立哺乳动物活体成像系统实现高速高分辨率长时程在体迁移体观测的共同第一作者【7】。清华大学博士生谢任翔、贾皓昊、陈怡宁、刘思远、博士后黄丹丹、李英等为本研究提供了重要帮助。四川大学华西医院应斌武、焦琳,中国科学院分子细胞科学卓越创新中心李劲松、陈剑锋、李庆、王诗慧,北京大学第三医院郑佳佳等为本研究提供了大力支持和帮助。
原文链接:
https://www.nature.com/articles/s41556-024-01440-9
参考文献
1. Macfarlane, R.G. (1964). An Enzyme Cascade in the Blood Clotting Mechanism, and its Function as a Biochemical Amplifier. Nature 202, 498-499. 10.1038/202498a0.
2. Davie, E.W., and Ratnoff, O.D. (1964). Waterfall Sequence for Intrinsic Blood Clotting. Science 145, 1310-1312. 10.1126/science.145.3638.1310.
3. Ma, L., Li, Y., Peng, J., Wu, D., Zhao, X., Cui, Y., Chen, L., Yan, X., Du, Y., and Yu, L. (2015). Discovery of the migrasome, an organelle mediating release of cytoplasmic contents during cell migration. Cell Res 25, 24-38. 10.1038/cr.2014.135.
4. Jiang, D., Jiang, Z., Lu, D., Wang, X., Liang, H., Zhang, J., Meng, Y., Li, Y., Wu, D., Huang, Y., et al. (2019). Migrasomes provide regional cues for organ morphogenesis during zebrafish gastrulation. Nat Cell Biol 21, 966-977. 10.1038/s41556-019-0358-6.
5. Huang, Y., Zucker, B., Zhang, S., Elias, S., Zhu, Y., Chen, H., Ding, T., Li, Y., Sun, Y., Lou, J., et al. (2019). Migrasome formation is mediated by assembly of micron-scale tetraspanin macrodomains. Nat Cell Biol 21, 991-1002. 10.1038/s41556-019-0367-5.
6. Jiao, H., Jiang, D., Hu, X., Du, W., Ji, L., Yang, Y., Li, X., Sho, T., Wang, X., Li, Y., et al. (2021). Mitocytosis, a migrasome-mediated mitochondrial quality-control process. Cell 184, 2896-2910 e2813. 10.1016/j.cell.2021.04.027.
7. Wu, J., Lu, Z., Jiang, D., Guo, Y., Qiao, H., Zhang, Y., Zhu, T., Cai, Y., Zhang, X., Zhanghao, K., et al. (2021). Iterative tomography with digital adaptive optics permits hour-long intravital observation of 3D subcellular dynamics at millisecond scale. Cell 184, 3318-3332 e3317. 10.1016/j.cell.2021.04.029.
8. Liang, H., Ma, X., Zhang, Y., Liu, Y., Liu, N., Zhang, W., Chen, J., Liu, B., Du, W., Liu, X., and Yu, L. (2023). The formation of migrasomes is initiated by the assembly of sphingomyelin synthase 2 foci at the leading edge of migrating cells. Nat Cell Biol 25, 1173-1184. 10.1038/s41556-023-01188-8.
9. Ding, T., Ji, J., Zhang, W., Liu, Y., Liu, B., Han, Y., Chen, C., and Yu, L. (2023). The phosphatidylinositol (4,5)-bisphosphate-Rab35 axis regulates migrasome formation. Cell Res 33, 617-627. 10.1038/s41422-023-00811-5.
10. Zhang, C., Li, T., Yin, S., Gao, M., He, H., Li, Y., Jiang, D., Shi, M., Wang, J., and Yu, L. (2022). Monocytes deposit migrasomes to promote embryonic angiogenesis. Nat Cell Biol 24, 1726-1738. 10.1038/s41556-022-01026-3.
11. Zhu, M., Zou, Q., Huang, R., Li, Y., Xing, X., Fang, J., Ma, L., Li, L., Yang, X., and Yu, L. (2021). Lateral transfer of mRNA and protein by migrasomes modifies the recipient cells. Cell Res 31, 237-240. 10.1038/s41422-020-00415-3.
(可上下滑动阅览)
原标题:《【前沿进展】Nature Cell Biology丨俞立团队揭示中性粒细胞来源的迁移体是凝血系统的基本组成成分》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




