- +1
复旦联合上海交大,开发新型LNP,同时递送siRNA和mRNA,治疗乙肝病毒感染
原创 生物世界

撰文丨王聪
编辑丨王多鱼
题图丨Pixabay
乙型肝炎病毒(Hepatitis B virus,HBV)感染可导致慢性乙型肝炎、肝纤维化、肝硬化,甚至肝细胞癌,然而,可选择的治疗方案有限。核苷(酸)类似物能有效抑制病毒复制但不能降低病毒抗原水平,聚乙二醇化干扰素具有直接抗病毒和免疫调节作用,但疗效中等,临床患者应答率低。
HBV基因组是一个紧凑的3.2 kb环状、部分双链的松弛环状DNA(rcDNA)。rcDNA一旦进入宿主细胞核,就会被内源性酶修复成共价闭合环状DNA(cccDNA), cccDNA编码核心抗原(HBcAg)、表面抗原(HBsAg)、e抗原(HBeAg)和X蛋白(HBx)4个重叠的开放阅读框。所有的HBV转录本都有一个共同的3'端,并共享相同的多聚腺苷酸化信号(PAS)。此外,不能复制的HBV线性片段可以整合到宿主基因组中(intHBV),是HBeAg阴性患者HBsAg的主要来源,高循环HBV抗原水平,尤其是HBsAg,有助于免疫耐受和病毒持久性。
由于无法实现完全治愈(清除cccDNA和intHBV),因此慢性乙型肝炎不断发展的治疗目标是通过有限持续时间的治疗实现HBsAg血清清除,即“功能性治愈”。
近日,复旦大学袁正宏教授、占昌友研究员、上海交通大学付炜副研究员等在 Signal Transduction and Targeted Therapy 期刊发表了题为:Optimized RNA interference therapeutics combined with interleukin-2 mRNA for treating hepatitis B virus infection 的研究论文。

RNA干扰(RNAi)技术在治疗遗传疾病和病毒感染疾病方面显示出巨大潜力。它也被认为是一种有吸引力的治疗手段,可以通过诱导抗原抑制、降低病毒血症和沉默cccDNA来实现乙型肝炎的功能性治愈。基于siRNA的疗法还可以缓解高病毒抗原诱导的免疫耐受,为后续的免疫刺激提供机会,从而获得对病毒的免疫控制。
然而,针对像HBV这样复杂的病毒设计功能性siRNA仍然具有挑战性,因为HBV的10个不同基因型之间具有极其高的遗传多样性。通过计算预测设计针对HBV各基因型间保守区域的siRNA是可行的,预计能够抵抗潜在的病毒突变逃逸。而靶向cccDNA来源的转录物中共同的3'-端序列的siRNA可能会失去靶向intHBV来源的转录物的目标。进一步研究有望使用靶向cccDNA和intHBV驱动合成的siRNA触发剂,在功效和功能性方面超越以往的药物。
RNAi疗法的临床应用受到肝脏靶向递送系统所带来的挑战的阻碍。随着新型GalNAc技术和脂质纳米颗粒(LNP)的开发,基于siRNA的药物如Partisiran和Inclisiran已获批临床使用。
脂质纳米颗粒(LNP)通常可电离的阳离子脂质、胆固醇、聚乙二醇化脂质(PEG lipids)和辅助脂质组成。聚乙二醇化脂质提供了中性的亲水性外层,稳定纳米颗粒,并防止在血液循环中快速清除,然而,也存在着“PEG困境”,PEG比例影响LNP在体内的性能,尽管PEG的免疫原性较弱,但某些人仍可能产生低水平的PEG特异性抗体,导致PEG化的纳米药物被加速清除,降低疗效。
最近有研究发现,羟基-PEG的抗原性更弱,可以避免与人体血液中存在的抗-PEG抗体结合,从而减少补体激活,使LNP能够逃逸抗体识别和快速清除。
虽然RNAi和抗体介导的HBsAg清除可以通过降低HBV病毒负荷来消除免疫功能障碍,但它们无法激活病毒特异性T细胞以实现长期病毒控制。临床上只有少数患者产生抗HBsAg抗体,并且在药物停用后病毒抗原会恢复。
最近有一些前临床和临床研究正在探索新的组合策略,以实现更好的治疗效果,例如将RNAi疗法与治疗性疫苗、干扰素和抗HBs抗体结合使用。
研究表明,IL-2是适当的病毒抗原呈递和激活以及病毒特异性CD4+和CD8+T细胞分化的关键调控因子。序贯低剂量IL-2与IFN-α联合使用,可增加患者中HBV特异性CD8+T细胞反应的频率并恢复其功能,这表明构建病毒特异性免疫控制以补充RNAi的潜力。
研究团队认为,通过RNAi疗法来抑制HBV病毒载量,同时使用IL-2来增强宿主免疫,可能足以打破免疫耐受,重建抗病毒免疫。
在这项最新研究中,研究团队筛选并化学修饰了一种泛基因型、多功能的siRNA组合(siHBV),其可靶向所有形式的cccDNA和intHBV来源的转录物,并在多种细胞培养和小鼠模型中验证了其有效性和安全性。
研究团队使用HO-PEG2000-DMG脂质和优化传统聚乙二醇化脂质在LNP配方中的摩尔比,开发了优化的LNP平台——tLNP,其具有低抗原性和高效性,以确定siHBV在控制HBV转录和复制中的作用,并评估其安全性特征。
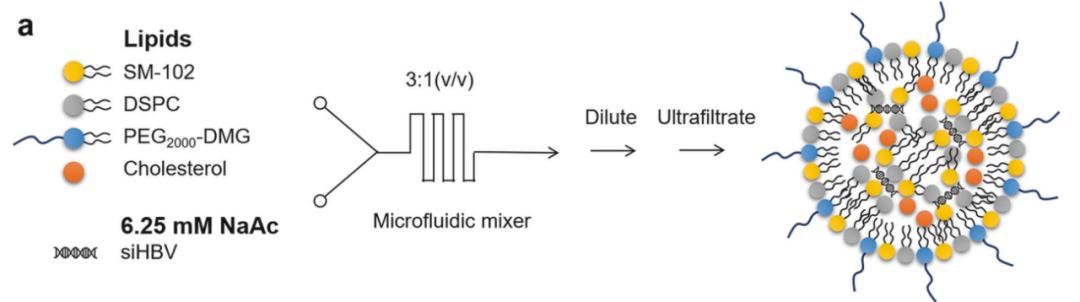
利用tLNP封装不同形式核酸的可行性,研究团队将siHBV和小鼠IL-2(mIL-2)mRNA共同封装在单一tLNP配方中——tLNP/siHBVIL2,以同时实现对病毒的抗原控制和免疫控制。预计基于tLNP的siHBV和mIL-2 mRNA联合递送,可能为治疗慢性乙型肝炎提供一种可行的方法。
实验结果表明,tLNP/siHBV显著降低了HBV病毒抗原和DNA的表达,在单次或多次给药频率下均呈剂量和时间依赖性,且安全性良好。而tLNP/siHBVIL2通过RNAi技术引入强大的HBsAg清除能力,并通过表达mIL-2蛋白触发强烈的HBV特异性CD4+和CD8+T细胞反应,从而实现了对HBV的加性抗原性和免疫控制。
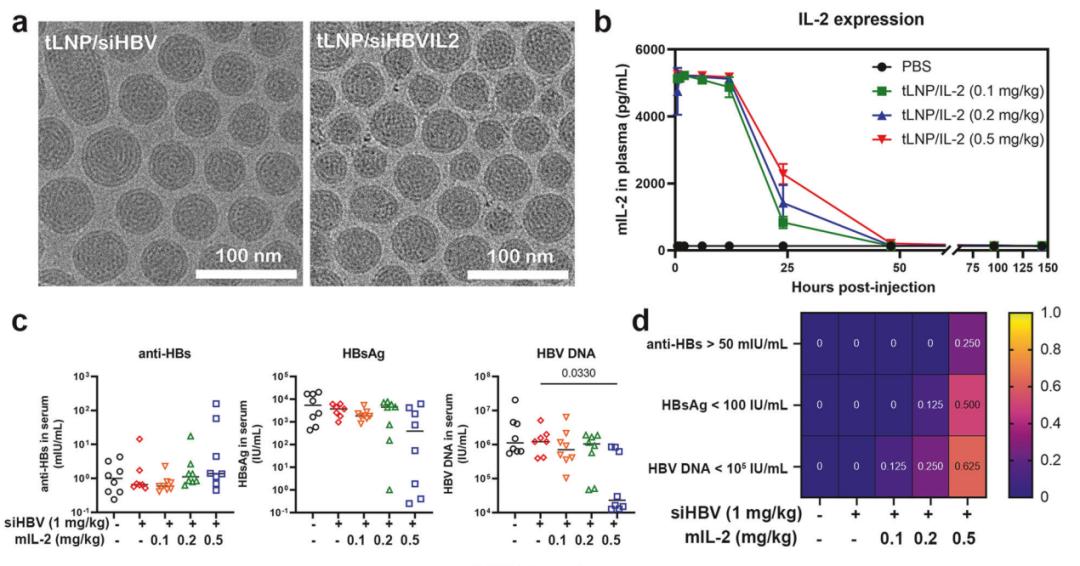
这些结果表明,使用tLNP作为核酸纳米载体进行siHBV和mIL-2 mRNA协同递送,可实现对HBV的抗原和免疫的协同控制,为治疗慢性乙型肝炎提供了有前景的转化治疗策略。
论文链接:
https://www.nature.com/articles/s41392-024-01871-8
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




