- +1
吃生姜可以治疗帕金森病?渥太华大学研究团队发现治疗新靶点
帕金森病又名震颤麻痹,是仅次于阿尔兹海默症的第二常见的神经退行性疾病。患者症状总体上可分为两类:运动迟缓、步履蹒跚和静息性震颤等的运动障碍症状;便秘、嗅觉缺失和睡眠障碍等的非运动症状。从神经病理学角度,帕金森病患者表现为大脑黑质致密部出现大量多巴胺能神经元死亡,同时幸存的神经元中出现大量主要由 α-突触核蛋白(α-synuclein,α-Syn)聚集形成的路易小体,并且异变的 α-Syn 会像朊病毒一样在神经元间扩散。
已有证据表明帕金森病患者神经元中 SNCA(编码 α-Syn 蛋白的基因) mRNA 含量增加,并且在动物模型中过量表达 α-Syn 能够模拟出部分帕金森病的症状,这说明 α-Syn 的含量与帕金森病的病理进程间存在着联系。然而 Snca 敲除小鼠表现出的中度认知障碍又提醒人们,大脑中的 α-Syn 应当维持在一个合适的含量才是最有益的。
近日,来自加拿大渥太华大学的 Maxime W. C. Rousseaux 研究团队在 Cell Death & Disease 期刊上发表了题为 Genetic and pharmacological reduction of CDK14 mitigates synucleinopathy 的研究论文[1],研究团队发现无论是通过基因编辑或是药理手段,抑制周期蛋白依赖性激酶 14(CDK14)后均能缓解帕金森病的病理进程,并能阻止 α-Syn 在神经元间的扩散,说明 CDK14 可能是治疗帕金森病的一个潜在靶点。

研究团队在 CDK14 全敲除(CDK14+/+)和半敲除(CDK14+/-)的小鼠脑中,注射病理性的 α-Syn 预形成纤维(pathogenic α-Syn preformed fibrils,mouse α-Syn PFF)诱导帕金森病症状的出现。他们发现 CDK14 敲除后能够有效挽救因 α-Syn PFF 引起的小鼠握力缺失现象,并且能够减少 α-Syn 在脑中的聚集,具体到不同脑区,CDK14 敲除对于注射位置的 α-Syn 聚集影响不大,但能有效减轻远离注射区域脑区中 α-Syn 的聚集(图1 A-D)。遗憾的是,CDK14 敲除并不能改善多巴胺能神经元死亡现象(图1 E,TH:酪氨酸羟化酶,一种催化酪氨酸转化为多巴胺的酶,是多巴胺合成途径中的关键酶)。同时,CDK14 敲除也没有改变小鼠大脑中整体内源性 α-Syn 的含量。此外,研究团队在人源神经元中敲除 CDK14 也同样能够抑制 α-Syn 的聚集现象。利用体外原代神经元,研究团队发现 CDK14 敲除其实是减缓了 α-Syn 在细胞间的扩散作用。除了基因编辑手段,研究团队也利用了 CDK14 抑制剂——FMF-04-159-2 对 CDK14 进行药理学手段的抑制,发现 CDK14 抑制剂在人源神经元和 PFF 诱导后的大鼠原代神经元中,均能有效减轻 α-Syn 聚集的不可溶性蛋白的产生,并且这一现象也在帕金森病小鼠模型中得到了同样的验证。
总而言之,研究团队发现 CDK14 可能是靶向 α-Syn 扩散的治疗帕金森病的潜在靶点。然而值得注意的是,研究团队尚未探明 CDK14 调解 α-Syn 的具体机制。相较于细胞外游离的 α-Syn 蛋白而言,神经元更倾向于吞噬外泌体中的 α-Syn[2],CDK14 可能参与了 α-Syn 外泌体的释放,但这仍需未来研究者进一步探索。
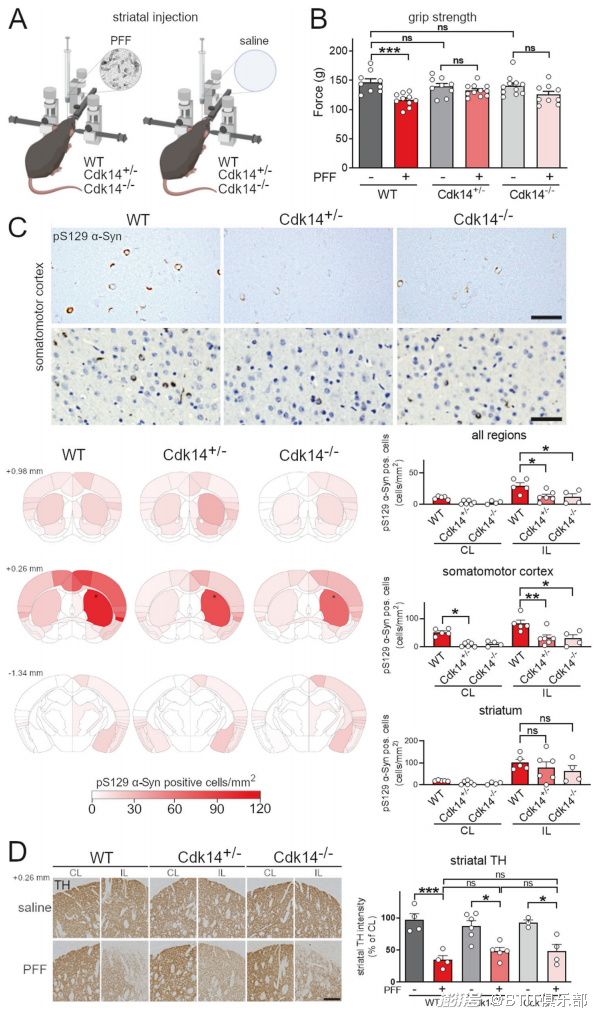
图1 CDK14 敲除改善帕金森病小鼠模型握力和 α-Syn 病理现象。
黑色星号代表注射位置。CL:注射位置对侧脑。IL:注射位置同侧脑。
目前为止,对于帕金森病仍缺少有效的治疗药物。有限的手段也主要局限于针对帕金森病的运动障碍症状,如利用多巴胺能药物(多巴胺前体和多巴胺激动剂,或者 MAO-B、COMT 和脱羧酶等一系列参与多巴胺代谢的酶抑制剂等)去缓解运动障碍的发生。对于帕金森病的非运动症状则更多是根据症状选择抗抑郁药、镇静剂或者胆碱酯酶抑制剂(起兴奋作用)等[3]。近些年来随着对帕金森病病理机制研究的深入,一些新型治疗药物或手段也被提出。
针对减少 α-Syn 生成或聚集的研究发现,从姜科植物中提取的天然产物姜黄素具有良好的神经保护作用,能显著抑制 α-Syn 的聚集[4]。α-Syn的小分子抑制剂——NPT200-11 和 NPT088 也能显著减轻大脑中 α-Syn 的聚集和神经炎症,并改善动物模型的运动障碍[3]。其中 NPT200-11 更是能够口服并穿透血脑屏障入脑。目前 NPT200-11 已经完成了临床 I 期实验,在多个剂量下都表现出了良好的安全耐受性(NCT02606682)。NPT088 则能针对 α-Syn、Aβ 和 Tau 的聚集,减轻蛋白酶 K 抗性蛋白的沉积。
除小分子抑制剂外,通过反义寡核苷酸(Antisense Oligonucleotides,ASOs)靶向分解 SCNA 的 mRNA 也能有效减少 α-Syn 的表达,如 Uehara 等人设计的 AmNA-ASO 能够有效抑制 α-Syn 的生成,改善帕金森病动物模型的病理进程[5]。
此外,靶向 α-Syn 单体且抑制其聚集的胞内抗体(Intrabodies)也可能是一种有效手段,如 Jeffrey H Kordower 等人设计的 VH14*PEST 纳米体(纳米体是能与抗体特异性结合的单结构域抗体片段,方便基因工程改造和递送)能有效减轻 α-Syn 的聚集和神经炎症的发生,并改善动物模型的运动功能障碍[6]。不过不同于传统给药手段,胞内抗体的给药难点在于需要通过合适的病毒载体将抗体递送到细胞内,并且如何长时间维持胞内抗体的含量也是未来临床需要解决的一个挑战。
最后则是利用结构性依赖结合的低聚物调节剂,能够广谱化的针对朊蛋白或 α-Syn 等的聚集。如 Jens Wagner 等人筛选出的 Anle138b,在体内体外均有良好的神经保护作用,能有效抑制 α-Syn 的聚集,并表现出良好的口服效果和跨血脑屏障特性[7]。Yong Tae Kwon等人基于自噬靶向嵌合体技术(autophagy-targeting chimera,AUTOTAC),利用 Anle138b 作为配体合成了靶向 α-Syn 聚合体的化合物——ATC161,有效地将 α-Syn 聚合体引导至溶酶体使其降解,并且没有观察到明显的脱靶效应。在动物模型上,ATC161 也表现出了良好的口服效果,改善了运动障碍[8]。
当然,在帕金森病的治疗药物中,除了针对 α-Syn 的,还有 β2AR 的激动剂、LAG3 受体拮抗剂、增强自噬信号或进行神经保护等的多种药物也在开发中[3]。相信在未来,人们一定能够攻克帕金森病这个难关。
参考文献:
[1] Parmasad JA, Ricke KM, Nguyen B, et al. Genetic and pharmacological reduction of CDK14 mitigates synucleinopathy. Cell Death Dis. 2024;15(4):246. Published 2024 Apr 4. doi:10.1038/s41419-024-06534-8
[2] Danzer KM, Kranich LR, Ruf WP, et al. Exosomal cell-to-cell transmission of alpha synuclein oligomers. Mol Neurodegener. 2012;7:42. Published 2012 Aug 24. doi:10.1186/1750-1326-7-42
[3] Gouda NA, Elkamhawy A, Cho J. Emerging Therapeutic Strategies for Parkinson's Disease and Future Prospects: A 2021 Update. Biomedicines. 2022;10(2):371. Published 2022 Feb 3. doi:10.3390/biomedicines10020371
[4] Sharma N, Nehru B. Curcumin affords neuroprotection and inhibits α-synuclein aggregation in lipopolysaccharide-induced Parkinson's disease model. Inflammopharmacology. 2018;26(2):349-360. doi:10.1007/s10787-017-0402-8
[5] Uehara T, Choong CJ, Nakamori M, et al. Amido-bridged nucleic acid (AmNA)-modified antisense oligonucleotides targeting α-synuclein as a novel therapy for Parkinson's disease. Sci Rep. 2019;9(1):7567. Published 2019 May 21. doi:10.1038/s41598-019-43772-9
[6] Chatterjee D, Bhatt M, Butler D, et al. Proteasome-targeted nanobodies alleviate pathology and functional decline in an α-synuclein-based Parkinson's disease model. NPJ Parkinsons Dis. 2018;4:25. Published 2018 Aug 22. doi:10.1038/s41531-018-0062-4
[7] Wagner J, Ryazanov S, Leonov A, et al. Anle138b: a novel oligomer modulator for disease-modifying therapy of neurodegenerative diseases such as prion and Parkinson's disease. Acta Neuropathol. 2013;125(6):795-813. doi:10.1007/s00401-013-1114-9
[8] Lee J, Yoon D, Sung KW, et al. Targeted degradation of SNCA/α-synuclein aggregates in neurodegeneration using the AUTOTAC chemical platform. Autophagy. 2024;20(2):463-465. doi:10.1080/15548627.2023.2274711
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




