- +1
“记忆,到底存在于何处?”
这是神经科学家一直思考的一个重要问题。近20年来,随着光遗传等工具的开发和成熟,其中一种理论关注到了“记忆印迹细胞(engram cells)”,在与学习记忆高度相关的脑区海马(hippocampus)利用即早基因(immediate early gene),如c-fos等,可以标记一群“储存记忆”的细胞1,2。利用光遗传激活或者抑制这群细胞能够“产生”或“擦除”记忆3,4。然而到底哪些神经元更容易被招募为engram cells呢?
加拿大多伦多大学等研究机构巧妙利用钙成像,光遗传等技术对这些问题进行了解答,该工作于2024年5月1日于Neuron杂志发表,题目为Excitability mediates allocation of pre-configured ensembles to a hippocampal engram supporting contextual conditioned threat in mice。他们发现,在海马的CA1脑区,在事件发生前的3小时内更加兴奋的神经元更容易被分配为恐惧记忆的engram cell。同时,在恐惧记忆发生前更加兴奋的细胞群体(ensemble)也倾向于分配为engram cell ensemble,在恐惧记忆形成时,这些细胞群体内细胞间的功能连接增强。
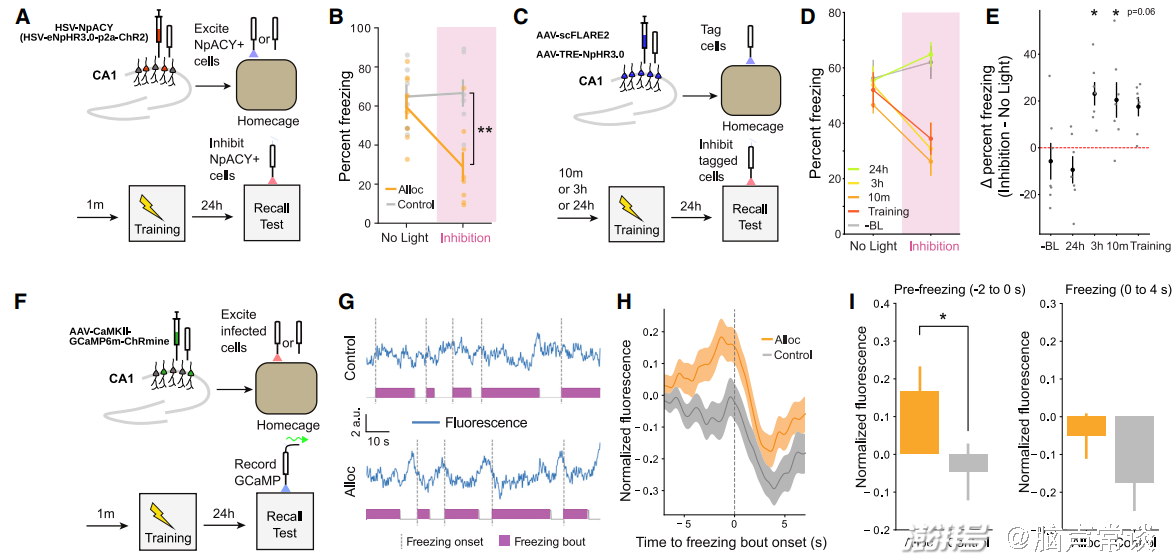
图1 利用光遗传兴奋一小部分CA1椎体神经元使其偏向于成为条件恐惧记忆的印迹细胞
首先作者利用条件恐惧记忆范式,在training前兴奋一群NpACY阳性神经元,并在recall中光遗传抑制他们,发现小鼠的freezing行为下降,即恐惧记忆回忆减少。那么,在生理状况下自发高兴奋性的细胞是否也更倾向于招募为engram cells呢?因此作者利用scFLARE技术,这项技术是由斯坦福大学Alice Ting实验室开发,这种细胞整合子可以标记兴奋性高(胞内钙离子浓度高)且受到光照的细胞,并表达相关的基因(此处为NpHR3.0,一种红光导致抑制的光遗传元件)5,6。当他们抑制在training前3h更加兴奋的这群神经元也可以发现freezing行为的减少。同时他们发现提前兴奋的细胞在freezing行为发生之前也有更高的放电。以上结果都说明了在恐惧记忆形成前一段时间内高兴奋性的细胞更倾向于成为engram cell。
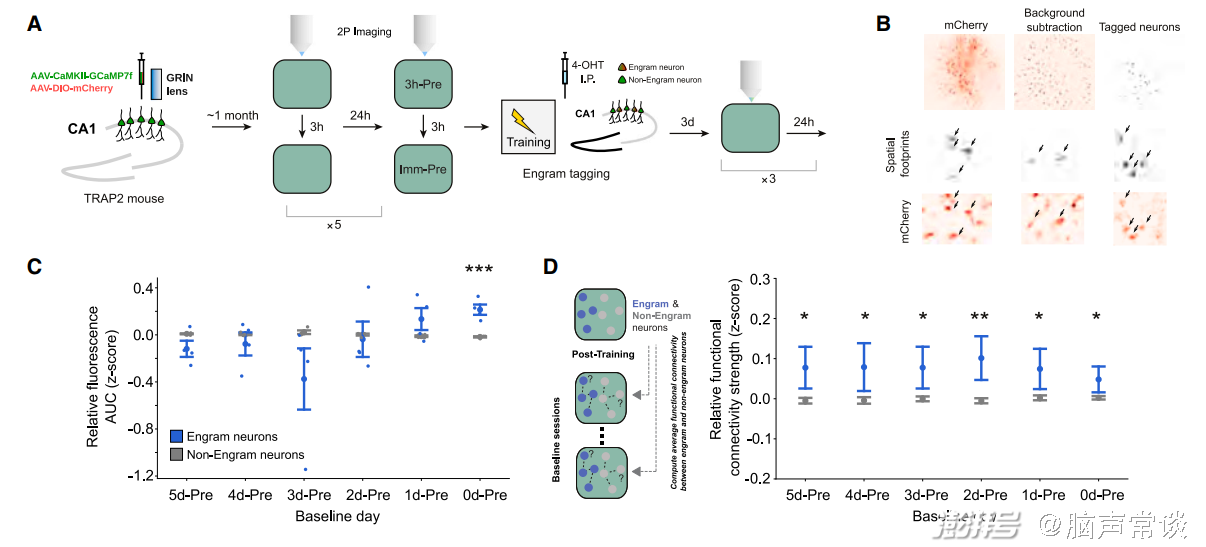
图2 稳定功能连接的细胞群兴奋性随着天数变化,但条件恐惧记忆当天最兴奋的一群细胞被招募为印迹细胞
之后作者利用TRAP2策略标记engram cell并利用双光子成像记录其在training前五天的细胞放电情况,结果发现这群细胞在前五天的兴奋性存在波动,而在training当天兴奋性远高于non-engram cells。同时,这群engram cell之间放电的功能连接性(functional connectivity)显著高于non-engram cells,证明他们更倾向于属于同一个细胞集群。这项结果说明恐惧记忆形成的当天最兴奋的细胞集群会被分配为印迹细胞。
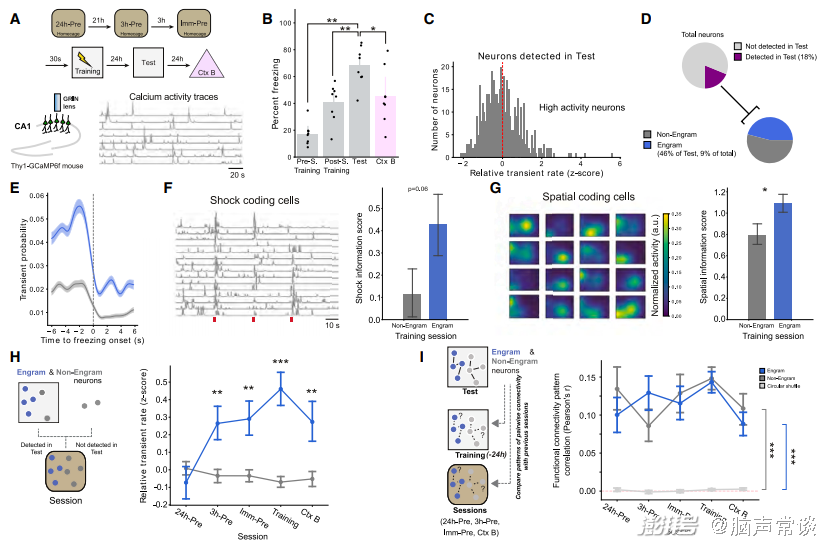
图3 印迹细胞集群在恐惧记忆形成之中和之前具有更高的兴奋性
那么这群细胞在学习过程中的放电模式是否有改变呢?作者利用自由移动的单光子成像,将在测试期间放电高于平均值的细胞视为印迹细胞,其中在test期间有18%的细胞被监测到,其中有46%的细胞为印迹细胞,结果发现这些细胞在freezing行为中放电更高,同时更能响应电击,具有更高的空间编码能力。同时作者发现这群细胞在恐惧记忆产生,即training时,以及其之前3小时内均有更高的放电活性,但是与non-engram ensemble相比,两类细胞之间的功能连接强度并无差异,但均高于随机。
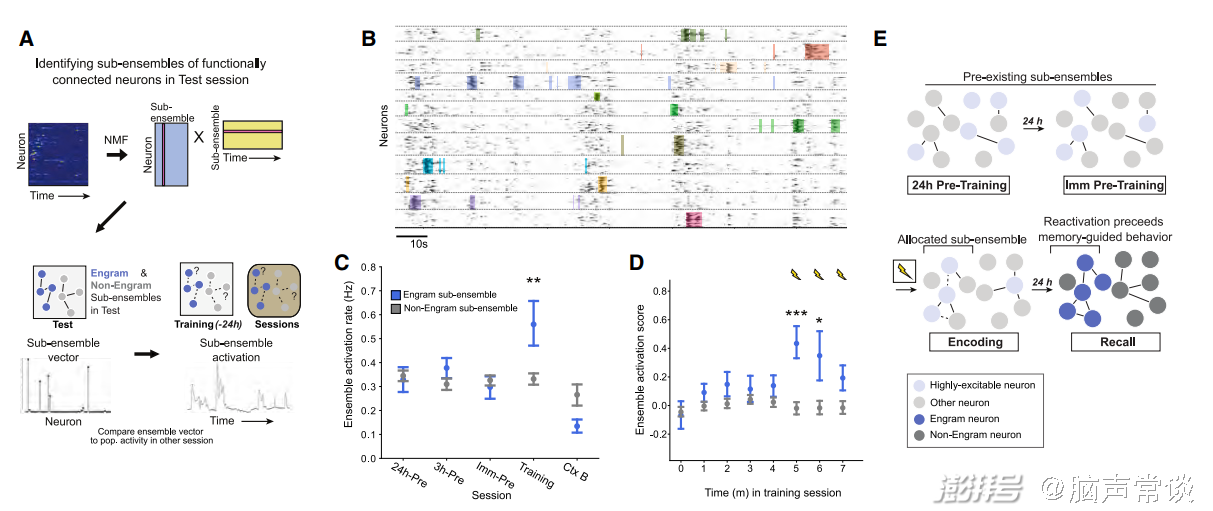
图4 训练阶段特异性稳定印迹细胞集群
之前的结果都是研究两两细胞之间的相关性,接下来作者利用非负矩阵分解得到更多细胞组成的集群,每个集群中有多于2个细胞。如Fig 4B所示,每个集群放电的相关性较高,颜色阴影画出了该集群中细胞共同放电的时刻。作者发现这些集群在training过程中的放电模式与test过程更为相似,集群中细胞放电的相关性也更高。因此作者提出一个模型:海马CA1中的神经元的兴奋性处于波动之中,在训练前短时间内兴奋性更高的神经元在训练过程中更倾向于编码恐惧记忆,同时这些神经元之间的功能连接增强。最终形成了engram cell ensemble(Fig 4E)。
总结
本文巧妙地利用光遗传,双光子/单光子钙成像等技术,发现了神经元的兴奋性影响其被分配为印迹细胞的偏向性。本文发现,高兴奋性的神经元更容易被分配为engram cell,同时在training过程中会增加这群神经元的兴奋性和之间的功能连接。同时,在training前功能连接更强的一群细胞,即pre-configured ensembles,更容易被分配成同一群engram ensemble。
本文揭示了一个重要的科学问题,即engram cell产生的机制。但本文中记录到的non-engram cell数目约是engram cell的几倍,可能会导致一些统计上的差异,并且例如Fig3中以z score超过0的方式定义engram cell标准较为宽松,可能导致一些non-engram cell被识别为engram cell,可能部分污染实验结果。同时,本文利用钙信号的皮尔森相关系数来计算细胞两两之间的功能连接,可以考虑利用膜片钳等电生理手段对细胞间连接进行更精细的测量。
参考文献
1 Tonegawa, S., Liu, X., Ramirez, S. & Redondo, R. Memory Engram Cells Have Come of Age. Neuron 87, 918-931, doi:10.1016/j.neuron.2015.08.002 (2015).
2 Tonegawa, S., Morrissey, M. D. & Kitamura, T. The role of engram cells in the systems consolidation of memory. Nat Rev Neurosci 19, 485-498, doi:10.1038/s41583-018-0031-2 (2018).
3 Liu, X. et al. Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature 484, 381-385, doi:10.1038/nature11028 (2012).
4 Han, J. H. et al. Selective erasure of a fear memory. Science 323, 1492-1496, doi:10.1126/science.1164139 (2009).
5 Sanchez, M. I., Nguyen, Q. A., Wang, W., Soltesz, I. & Ting, A. Y. Transcriptional readout of neuronal activity via an engineered Ca(2+)-activated protease. Proc Natl Acad Sci U S A 117, 33186-33196, doi:10.1073/pnas.2006521117 (2020).
6 Wang, W. et al. A light- and calcium-gated transcription factor for imaging and manipulating activated neurons. Nat Biotechnol 35, 864-871, doi:10.1038/nbt.3909 (2017).
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




