- +1
2023年国产PD-1销售成绩单:百济超5亿美元,复宏汉霖增超两倍
近日,跨国药企默沙东披露的2024年第一季度财报显示,明星PD-1肿瘤药Keytruda(简称“K药”)贡献69亿美元收入,同比增长20%。作为2023年新晋的全球“药王”,K药全年营收250.11亿美元,最新的一季度数据再次展示了PD-1这一经典肿瘤药的商业价值。
随着2023年财报进入末尾,国内各家PD-1肿瘤药的销售情况也相继公布。虽然销售额的数据上远不及全球PD-1“销冠”,但部分产品的增长速度也颇为亮眼。从各家企业的公开信息来看,国产PD-1在国内新增适应证和出海全球的步伐均在继续,未来销售增长可期。
百济PD-1超5亿美元,复宏汉霖H药增超230%
PD-1是肿瘤免疫治疗的代表性产品,可以通过激活患者自身T细胞的抗肿瘤免疫功能,发挥抗肿瘤的作用。目前,包括进口产品,国内已经有10多款PD-1/PD-L1肿瘤药获批。
君实生物、信达生物、恒瑞医药和百济神州被称为“国产PD-1四小龙”。“药茅”恒瑞医药(600276)在2023年财报中还是没有直接点出卡瑞利珠单抗这款明星品种的销售额,仅在“主要产品系列——抗肿瘤”部分提到,销售额395.87万瓶/支/盒,同比增长1.08%。
信达生物(1801.HK)也未在财报中直接披露信迪利单抗的销售额,不过提到,公司全年产品收入57.28亿元,同比增长38.4%。信迪利单抗的销售表现强劲,市场领先。不过,从信达生物的合作方礼来的2023年财报可以看到,信迪利单抗(Tyvyt)全年销售额为3.93亿美元,同比增长34%。
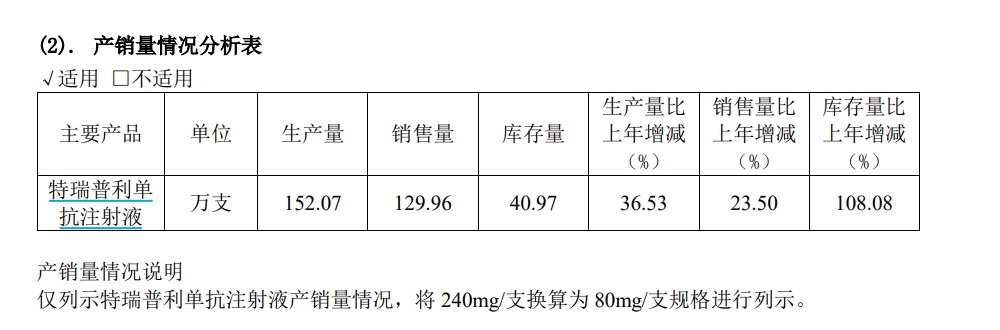
君实生物PD-1肿瘤药的产销量情况 来源:2023年财报
君实生物(1877.HK,688180.SH)拥有国内首个获批的PD-1单抗特瑞普利单抗,2023年,期销量上升23.5%达到129.96万支,销售收入约9亿元,同比增长约25%。百济神州(BGNE.NS;06160.HK;688235.SH)的替雷利珠单抗2023年销售额总计38.06亿元,同比增长33.1%,成为“四小龙”中的销冠。
除了上述四家药企,其他上市药企的PD-1市场表现也有可圈可点之处。如复宏汉霖(2696.HK)去年营业收入约53.949亿元,其中PD-1肿瘤药斯鲁利单抗全年收入11.198亿元,同比大增230.2%。
康方生物(9926.HK)拥有两款PD-1药物,该公司披露了其中PD-1/CTLA双抗肿瘤药卡度尼利单抗的销售额:去年市场销售额达13.58亿元,同比大增149%。乐普生物的普特利单抗在2023年完成了第一个完整销售的会计年度,全年销售收入1.01亿元。
国产PD-1出海正进行,新适应证瞄准差异化
由于国内获批数量较多,竞争激烈,价格不断下降,PD-1肿瘤药是行业公认的“内卷之王”。为了破解内卷局面,国产PD-1企业争相开拓国际市场。在国产PD-1四小龙中,君实生物和百济神州的PD-1已在美国获批,成为行业标志事件。当前,各家PD-1药企的国际化进展还在继续。
4月23日,百济神州宣布欧盟委员会(EC)已批准替雷利珠单抗用于三项非小细胞肺癌(NSCLC)适应证的一线及二线治疗。百济神州称,该药将于2024年晚些时候在首批欧盟国家上市。此外,该药已在美国和欧盟获批用于治疗既往接受化疗的晚期或转移性ESCC患者,该药品同时还在接受欧洲药品管理局(EMA)和FDA审评,用于不可切除、复发、局部晚期或转移性食管鳞状细胞癌(ESCC)患者的一线治疗,以及胃或胃食管结合部腺癌患者的一线治疗。

恒瑞医药卡瑞利珠单抗的注册进展 来源:2023年财报
恒瑞医药的PD-1还在等待美国药监部门的审批结果。2023年财报提到,恒瑞医药首个国际多中心Ⅲ期临床研究——卡瑞利珠单抗联合阿帕替尼治疗晚期肝癌国际多中心Ⅲ期研究已达到主要研究终点,美国 FDA 已正式受理卡瑞利珠单抗的 BLA,目标审评日期为2024年5月31日。
复宏汉霖H药的国际化步伐也在加速。2023年财报显示,截至目前H药对外授权已覆盖美国、欧洲、东南亚、中东和北非等70多个国家和地区。在欧美生物药市场,H药一线治疗ES-SCLC的欧盟上市许可申请(MAA)于2023年3月获得欧洲药品管理局(EMA)受理,同时,复宏汉霖稳步推进H药对比一线标准治疗阿替利珠单抗用于治疗ES-SCLC的头对头美国桥接试验,以进一步支持其在美国的上市申报。
K药在全球收入一骑绝尘的重要原因之一是其适应证已经近40个。作为一款具备巨大潜力的广谱抗癌药,国内药企也在不断推动并打开新适应证的大门,尤其是推动具有差异化需求的适应证。
4月7日,君实生物(1877.HK,688180.SH)宣布,特瑞普利单抗注射液联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗新适应证上市申请于近日在国内批准。这是特瑞普利单抗在中国获批的第八项适应证,也是我国首个获批的肾癌免疫疗法。
4月24日,康方生物对外宣布,国家药品监督管理局药品审评中心(CDE)官网显示,卡度尼利单抗加含铂化疗联合/不联合贝伐珠单抗对比安慰剂加含铂化疗联合/不联合贝伐珠单抗用于一线治疗持续、复发或转移性宫颈癌的新药上市申请(sNDA)已被受理。这是卡度尼利第三个适应证的上市申请,卡度尼利有望成为全球首个晚期宫颈癌全人群一线治疗的免疫检查点抑制剂。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




