- +1
【科技前沿】Mol Cell|李国红/于娟/陈萍合作揭示H2AK119ub1差异性调控基因表达的分…
多梳抑制复合物1(polycomb repressive complex1,PRC1)是细胞内重要的表观遗传调控因子,它可以通过压缩染色质结构和催化组蛋白H2A第119位赖氨酸单泛素化(H2AK119ub1)调控发育相关基因的表达。早期研究发现PRC1酶活中心Ring1b/sce突变会导致小鼠和果蝇胚胎晚期发育异常,说明H2AK119ub1在个体发育过程中具有重要生物学功能【1,2】。根据亚基不同,PRC1分为经典PRC1(Canonical PRC1,cPRC1)和非经典PRC1(Non-canonical PRC1,ncPRC1)。cPRC1由RING1B/A、PCGF2/4、CBX2/4/6/7/8和PHC1-3等亚基组成,它具有很强的染色质压缩能力,但是E3连接酶活性较低;而ncPRC1由RING1B/A、PCGF1-6和RYBP/YAF2等亚基构成,它的染色质压缩能力很弱,但是E3泛素连接酶活性却很强【3】。另外,人们发现亚基CBX2/4/6/7/8的chromodomain能够识别H3K27me3,说明H3K27me3可以起到招募cPRC1的作用【4】。在核小体上,晶体结构显示H2AK119ub1、H3K27me3和连接组蛋白H1的位置比邻【5】,提示H2AK119ub1可能通过影响cPRC1和H1的染色质压缩能力,进而调控基因转录活性。
2024年3月7日,中国科学院生物物理研究所生物大分子国家重点实验室的李国红团队在Molecular Cell杂志发表了一篇题为“H2AK119ub1 differentially fine-tunes gene expression by modulating canonical PRC1- and H1-dependent chromatin compaction”的文章,他们发现组蛋白修饰H2AK119ub1具有双向调控基因表达的能力。具体而言,他们发现H2AK119ub1通过抑制cPRC1与核小体的结合,拮抗了cPRC1介导的染色质压缩,从而导致cPRC1对其靶基因的沉默作用减弱(转录激活作用)。相反的,他们还发现H2AK119ub1可以促进H1介导的染色质压缩,进而抑制了小鼠胚胎干细胞内多达957个基因的表达(转录抑制作用)。
研究人员首先利用单核小体pull-down技术检测了cPRC1与常规核小体、H2BK120ub1和H2AK119ub1修饰核小体的结合能力。他们发现H2AK119ub1显著减弱了cPRC1与核小体的结合。同时,他们利用蔗糖梯度密度离心和电镜技术发现,H2AK119ub1通过拮抗cPRC1与核小体的结合,抑制了cPRC1介导的染色质压缩。此外,他们制备了Ring1BI53A酶活突变的细胞系,发现H2AK119ub1降低会导致381个基因下调和957个基因上调。进一步,研究人员发现H2K119ub1的降低会导致cPRC1核心亚基CBX7、PHC1和PCGF2在下调基因启动子区结合显著升高。另外,研究人员还通过敲除和诱导性降解ncPRC1酶活调控亚基RYBP和YAF2,进一步证实H2AK119ub1修饰水平的降低会导致cPRC1在染色质上过度沉积。这些结果均表明H2AK119ub1可以通过影响cPRC1的染色质结合正向调控基因表达。
此外,研究人员利用单核小体pull-down和ChIP-seq技术还发现H2K1119ub1并不会影响连接组蛋白H1与核小体的结合。有趣的是,他们利用分析超速离心和MNase酶切等技术发现H2K1119ub1对于H1介导的染色质压缩存在明显的促进作用。为此,他们制备了H1b/c/d/e四基因共敲除的细胞系(H1-QKO),并且发现H1-QKO和Ring1BI53A细胞内表达上调的基因存在明显的交集。同时,研究人员利用MNase-seq技术发现,与H2AK119ub1低富集区域相比,H1-QKO会导致H2K1119ub1富集区域内的染色质变得更为开放。因此,以上结果提示H2AK119ub1能够促进H1介导的染色质压缩。此外,该团队早期成果表明H1介导的染色质压缩能够通过核小体配对方式,加速ncPRC1在染色质上对H2AK119ub1的扩增/蔓延,进而增强了细胞周期间H2AK119ub1在兼性异染色质区域的表观遗传继承能力【3】;同时,他们还发现H2AK119ub1能够稳定核小体结构【6】,并且拮抗组蛋白分子伴侣FACT复合物(FAcilitates Chromatin Transcription complex)与核小体的结合【7】。这些结果表明:H1和H2AK119ub1之间存在一种正反馈,其可以高效的建立富含H2AK119ub1的巨大兼性异染色质区域并介导其表观遗传继承,同时,H2AK119ub1可以通过影响单核小体稳定性、30 nm染色质结构和染色质互作蛋白功能等多种途径导致基因沉默。
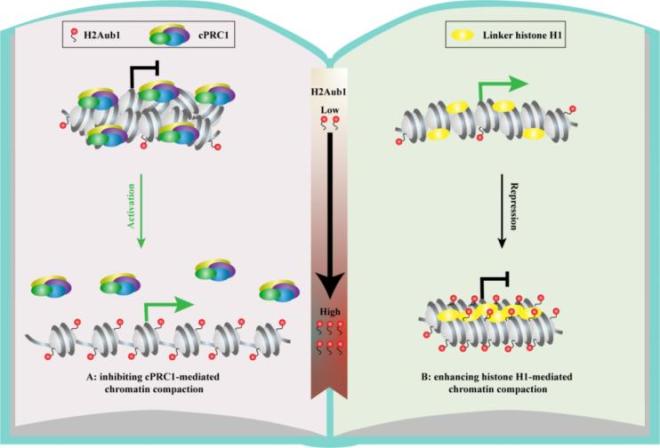
图1. H2AK119ub1通过影响cPRC1和H1介导的染色质压缩差异性调控基因表达。
该研究有助于我们进一步理解PRC1结构和酶活元件在调控基因表达中的互作关系,并对“理解个体生长发育过程和PRC1相关疾病的致病机理”具有指导意义。
中国科学院生物物理研究所的李国红研究员和于娟副研究员以及首都医科大学基础医学院的陈萍教授为本论文的共同通讯作者,中国科学院生物物理研究所赵吉成研究员、王敏博士和刘翠芳助理研究员,以及重庆医科大学基础医学院的兰洁博士为本论文的共同第一作者。
原文链接:https://doi.org/10.1016/j.molcel.2024.02.017
参考文献
1. Illingworth, R.S., et al., The E3 ubiquitin ligase activity of RING1B is not essential for early mouse development. Genes Dev, 2015. 29(18): p. 1897-902.
2. Pengelly, A.R., et al., Transcriptional repression by PRC1 in the absence of H2A monoubiquitylation. Genes Dev, 2015. 29(14): p. 1487-92.
3. Zhao, J., et al., RYBP/YAF2-PRC1 complexes and histone H1-dependent chromatin compaction mediate propagation of H2AK119ub1 during cell division. Nat Cell Biol, 2020. 22(4): p. 439-452.
4. Di Croce, L. and K. Helin, Transcriptional regulation by Polycomb group proteins. Nat Struct Mol Biol, 2013. 20(10): p. 1147-55.
5. Luger, K., et al., Crystal structure of the nucleosome core particle at 2.8 A resolution. Nature, 1997. 389(6648): p. 251-60.
6. Xiao, X., et al., Histone H2A Ubiquitination Reinforces Mechanical Stability and Asymmetry at the Single-Nucleosome Level. J Am Chem Soc, 2020. 142(7): p. 3340-3345.
7. Wang, Y.Z., et al., H2A mono-ubiquitination differentiates FACT's functions in nucleosome assembly and disassembly. Nucleic Acids Res, 2022. 50(2): p. 833-846.
本文转载自公众号“BioArt”

中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【科技前沿】Mol Cell|李国红/于娟/陈萍合作揭示H2AK119ub1差异性调控基因表达的分子机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




