- +1
颜宁最新论文,揭示钙离子通道亚型对药物不同反应的基础
原创 生物世界 生物世界
编译丨王聪
编辑丨王多鱼
排版丨水成文
电压门控钙离子(Cav)通道在介导膜去极化时钙离子(Ca2+)的内流中至关重要。Cav通道的激活触发基本的生理过程,包括肌肉收缩、神经递质释放、激素分泌和突触整合。
P/Q型Cav通道Cav2.1由CACNA1A基因编码,在神经元和神经内分泌细胞中普遍存在,在神经递质释放和突触可塑性及神经元兴奋性的调节中发挥重要作用。Cav2.1也是治疗癫痫、偏头痛等神经系统疾病的潜在治疗靶点。
2024年3月5日,深圳医学科学院颜宁院士团队在 Cell Research 期刊发表了题为:Structural basis for different ω-agatoxin IVA sensitivities of the P-type and Q-type Cav2.1 channels 的研究论文。
该研究揭示了MVIIC和Aga-IVA对Cav2.1的亚型特异性阻断的分子机制,为P型和Q型Cav2.1通道对Aga-IVA的不同反应提供了结构解释,为开发更有效和选择性的调节剂以治疗神经系统疾病提供了新见解。

P/Q型Cav通道的定义源于它们最初被分离的细胞类型,P型来自小脑浦肯野细胞,Q型来自小脑颗粒细胞。P/Q型Cav通道可以通过其不同的失活动力学和对ω-agatoxin IVA(Aga-IVA,一种Cav通道阻断剂)的不同敏感性来区分。P型Cav通道可以被Aga-IVA强有力地阻断,而Q型则表现出较弱的敏感性。
之前的研究指出,在连接第四电压感应域(VSD)的S3和S4片段loop(称为VSDIV的S3-4IV loop)中,CACNA1A的可变剪接插入了Asn-Pro(NP)基序,导致对Aga-IVA的敏感性显著降低。除了Aga-IVA外,P/Q型Cav通道还可以被ω-conotoxin MVIIC(MVIIC)选择性地有效抑制。
在这项研究中,研究团队解析了Cav2.1,以及其与MVIIC或Aga-IVA的复合物的冷冻电镜结构,整体分辨率为2.9-3.1 Å。这些结构揭示了MVIIC或Aga-IVA这两种选择性肽毒素能够选择性抑制Cav2.1的分子决定因素,并为开发针对Cav通道亚型的特异性药物或疗法奠定了基础。
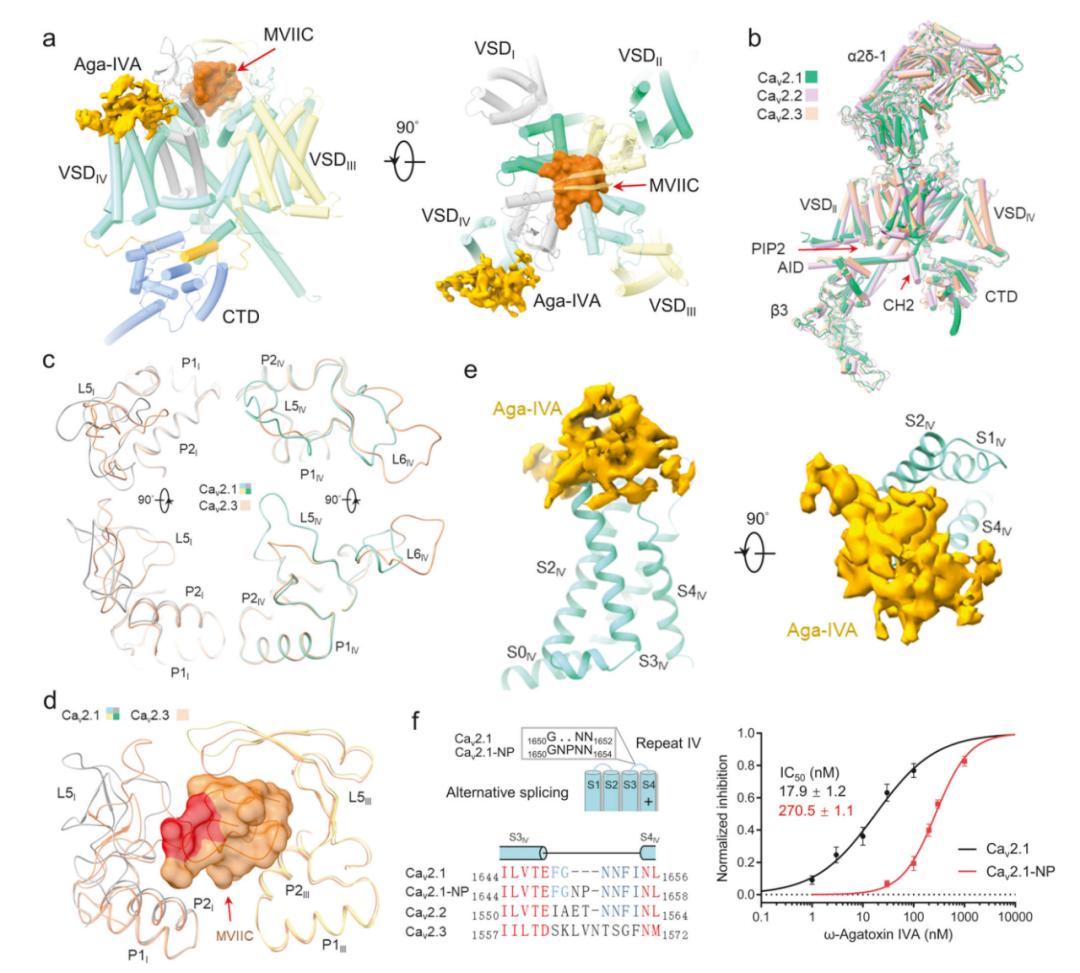
研究团队首先研究了在辅助亚基α2δ-1和β3存在的情况下,全长的人Cav2.1的通道活性。电压依赖性Ba2+(IBa)电流的稳态激活和失活特性,V1/2分别为-9.64±0.30 mV和-63.08±0.98 mV。在电生理学验证后,对Cav2.1三元复合物单独或与250 μM MVIIC或500 μM Aga-IVA复合物进行单颗粒冷冻电镜分析。结构分析显示,MVIIC明确地溶解在选择性过滤器(selectivity filter,SF)上方的外口,而Aga-IVA附着在VSDIV的胞外边缘(图1a)。与MVIIC和Aga-IVA复合的Cav2.1分别称为Cav2.1-M和Cav2.1-A。
鉴于Cav2通道之间的序列同源性>80%,Cav2.1的整体结构与Cav2.2和Cav2.3非常相似(图1b),尽管总体结构相似,但某些区域,特别是重复I和IV的胞外环(ECL),显示出明显的差异,与这些区域的序列变化一致(图1c)。ECL的差异是Cav2通道对各种肽毒素的独特敏感性的基础。
MVIIC是一种从僧袍芋螺(Conus magus)毒素中分离得到的神经毒素,含有26个氨基酸,其中6个Cys残基形成3个二硫键,分别为C1-C16、C8-C20和C15-C26。它与MVIIA具有高度的序列一致性,只有长度上有一个氨基酸的差异。
在Cav2.1-M的结构中,MVIIC直接位于SF上方,有效地阻断了Ca2+的入口通路(图1a)。这种作用机制类似于MVIIA对Cav2.2的作用。MVIIC和Cav2.1之间的相互作用主要是由P1和P2螺旋以及胞外环(ECL)上的极性和带电残基介导的。例如,MVIIC的Arg9和Lys10分别与Asp675和Asp668结合,而Arg22、Arg23和Lys25则与P2I螺旋和ECLI上的残基形成多次静电相互作用。值得注意的是,Asp675和Gln1463是Cav2.1特有的,因此为Cav2通道对MVIIC的不同敏感性提供了潜在解释。
Cav2.1-M和Cav2.1-apo的结构比较表明,ECLI和ECLIV都略微向外移动以容纳MVIIC。在Cav2.2与MVIIA结合时也观察到类似的移动。然而,局部结构的移动可能并不总是足以创造空间兼容性。事实上,Cav2.1和Cav2.3之间ECLI和ECLIV的序列和结构都存在显著差异。Cav2.3的ECLIV更接近中央轴,可能导致与MVIIC不可避免的冲突(图1d)。因此,Cav2.3对MVIIC的不敏感性得到了解释。
Aga-IVA来自漏斗网蛛(Agelenopsis aperta)的毒液。在Cav2.1-A的三维重建中,属于Aga-IVA的部分只能达到约6 Å的分辨率,从而无法建立可靠的模型(图1e)。但毒素的结合位点为Cav2.1剪接变体对Aga-IVA的不同敏感性提供了结构解释。
电生理学实验表明,Q型Cav通道在S3-4IV loop中包含NP基序插入。毒素密度直接附着在S3-4IV loop,包括Asn-Pro(NP)基序所在的片段(图1e,f)。这两个氨基酸残基的插入可能改变了Aga-IVA的受体位点,从而导致抑制作用下降。支持这一观点的是,Aga-IVA对Cav2.1的IC50为17.9 ± 1.2 nM,与之前报道的值相似,这可能是用于结构分析的P型变体。对于Cav2.1-NP,即具有1651NP1652的亚型,IC50为270.5 ± 1.1 nM(图1f)。
值得注意的是,Cav2.2和Cav2.3中的S3-4IV loop存在显著差异,这解释了它们对Aga-IVA的不敏感性(图1f)。因此,Aga-IVA粘附于含有NP的S3-4IV loop的结构观察解释了不同Cav2亚型以及Cav2.1剪接变异体的不同敏感性的物理基础。
Aga-IVA和MVIIC对Cav2.1亚型选择性抑制的结构基础
有研究指出,Aga-IVA可以将激活和失活电压都转移到更正的电位,反映出Cav2.1静息态的增加倾向。结构比较显示,在Aga-IVA结合时,S3IV略微向外移动,S4IV向胞内侧半螺旋转动。由于Cav通道中的VSD在静息状态下应采用“down”构象,这些结构观察表明,Aga-IVA可能通过抑制VSDIV的激活来阻断Cav通道。
总的来说,这项研究揭示了MVIIC和Aga-IVA对Cav2.1的亚型特异性阻断的分子机制,为P型和Q型Cav2.1通道对Aga-IVA的不同反应提供了结构解释,并为开发更有效和选择性的调节剂以治疗神经系统疾病提供了新见解。
论文链接:
https://www.nature.com/articles/s41422-024-00940-5
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




