- +1
研究揭示中国人群肝癌全基因组变异及演化特征
原发性肝癌的致死率在全球所有癌症中高居第三,肝细胞癌(HCC)为其主要亚型,约占其所有病例的80%以上。全球每年肝癌新发病例超过一半发生在中国,且患者预后普遍较差,我国肝细胞癌患者五年总体生存率仅约为10%。肝细胞癌病因复杂,其中丙型肝炎病毒(HCV)感染在日本人群最为常见,酒精、非酒精性脂肪性肝炎(NASH)及代谢紊乱在西方人群中占比较大,而乙型肝炎病毒(HBV)慢性感染和黄曲霉毒素(aflatoxin)等致癌物暴露是中国肝癌人群的主要致病因素。
既往的国际泛癌全基因组研究计划(PCAWG)和美国癌症基因组研究计划(TCGA)虽然包含了对肝癌全基因组特征的研究,但其样本主要为日本和西方人群,其结果不能全面反映中国人群肝癌的基因组特征。另一方面,这些研究采用了相对较浅的测序深度(~30-40X),限制了其对全基因组层面亚克隆结构的深度解析。鉴于不同区域、不同人群肝癌致病因素的巨大差异,迫切需要开展一项大规模、高深度的中国肝癌人群全基因特征分析,为开发适用于中国肝癌人群的诊断和治疗方案提供依据。
2024年2月14日,海军军医大学王红阳院士/陈磊研究员课题组、北京大学生物医学前沿创新中心/北京未来基因诊断高精尖创新中心白凡教授课题组、杜克-新加坡国立大学医学院Steven G. Rozen教授课题组及福建和瑞基因吴琳博士团队合作,在 Nature 期刊发表了题为:Deep whole-genome analysis of 494 hepatocellular carcinomas 的研究论文。
该研究完成了中国人群肝细胞癌全基因组深度特征分析(Chinese Liver Cancer Atlas,CLCA)。该研究对494例来自中国不同地区的肝细胞癌患者肿瘤组织进行了高深度的全基因组测序(平均120x),深入分析了编码区和非编码区的驱动基因、突变印记、拷贝数变异、聚集式变异事件(clustered alteration:chromothripsis, chromoplexy和kataegis)、染色体外环状DNA(ecDNA)以及突变演进规律等特征,揭示了以HBV相关肝细胞癌为主的全基因组变异景观,为深入理解中国人群肝细胞癌的演进机理提供了重要的线索。

与PCAWG-HCC队列相比,该研究的CLCA-HCC队列具有更高的HBV感染率(94.5%)、Edmondson-Steiner III-IV级分期(85.6%)和更低的HCV感染率(2.6%)、吸烟史(36.8%)及饮酒史(26.7%)占比,提示CLCA-HCC队列具有明显不同的流行病学和临床病理特征。
该研究首先综合多种算法,鉴定出大量新的肝癌潜在驱动事件,包括6个新编码驱动事件(FGA、HNF1A、PRDM11、CDKN1B、BMP5和ECHS1)和28个新非编码驱动事件(完整列表见原文)。值得注意的是,本研究所发现的31个非编码驱动事件中仅有三个被报道过,同时多个基因都与肝脏代谢通路密切相关,该结果提示现有研究对肝癌非编码区的探究仍十分有限。通过亚克隆富集分析,研究者揭示62.5%的非编码驱动事件富集在亚克隆区域,说明非编码驱动事件并非只发生在肝癌发生早期,而是广泛参与了肝癌的亚克隆演化。
其次,在PCAWG已报道的81种突变印记的基础上,该研究首次鉴定了5种新的突变印记,包括2种双碱基替换(doublet-base substitution:DBS_H1, DBS_H2)、2种插入缺失(insertion-and-deletion:ID_H3, ID_H8)和1种单碱基替换(single-base substitution signature:SBS_H8)。
值得注意的是,ID_H8与黄曲霉毒素暴露相关,而DBS_H2和ID_H3则与马兜铃酸(aristolochic acid,AA)暴露相关,这些新突变印记是单碱基替换印记的重要补充。更重要的是,研究团队通过数据分析及细胞系实验共同证实SBS_H8是一种不同于马兜铃酸突变印记(SBS_22)的新型单碱基替换印记,提示其相关致病因素并非马兜铃酸。与PCAWG-HCC队列相比(0.31%),CLCA-HCC队列中SBS_H8高度富集(57.1%),并与Wnt/β-catenin信号通路的突变和预后不良密切相关。同时亚克隆富集分析揭示SBS_H8显著富集于主克隆突变中,提示该突变特征在中国人群肝细胞癌的早期演进过程中可能发挥重要作用。
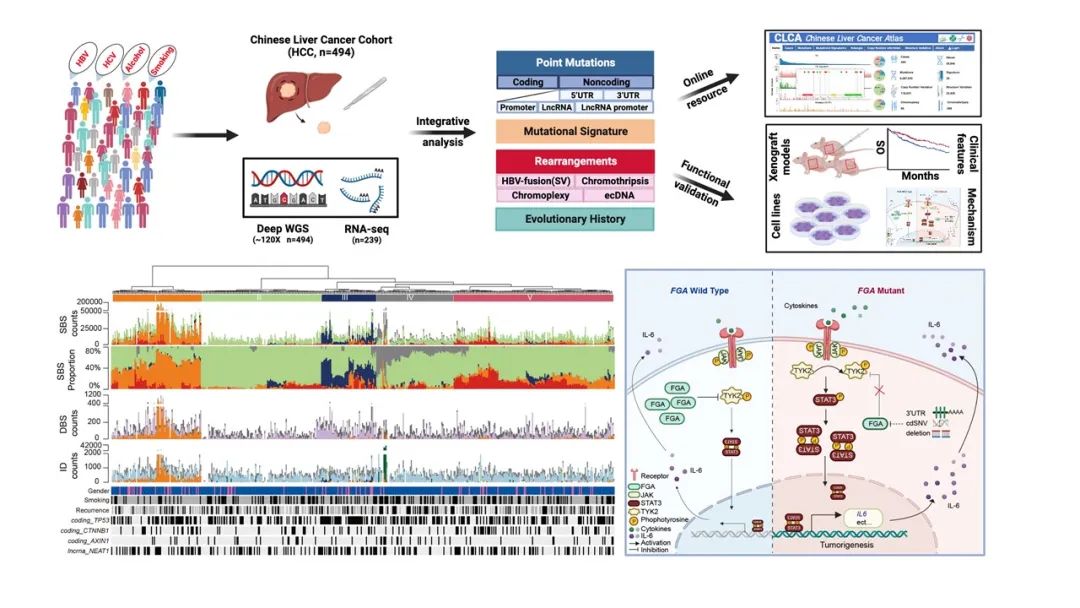
CLCA研究内容概览
随后,该研究还详细描绘了CLCA队列中不同类型的基因组变异事件,包括拷贝数变异、结构变异、HBV整合、ecDNA和三种类型的聚集式变异事件(Chromothripsis、 chromoplexy和kataegis)。有趣的是,CLCA-HCC队列中ecDNA比例(27.3%)显著高于PCAWG-HCC队列(13.1%),同时ecDNA中整合的癌基因谱也具有独特性。虽然肝癌中HBV整合事件早有报道,但其如何整合到基因组中仍不十分清楚。本研究发现HBV可以与宿主基因组形成ecDNA,与线性DNA相比,这种HBV-oncogene-ecDNA的整合形式显著提高了临近驱动基因的拷贝数和表达水平,提示ecDNA的扩增可能在HBV相关肝癌中扮演着重要角色。Chromothripsis、chromoplexy 和kataegis等聚集式变异事件通常被认为发生在早期,也是肿瘤截断式演化(punctuated evolution)的重要证据,
该研究发现这些聚集式变异事件同样存在于亚克隆事件中,提示这些基因组灾难性事件也有可能发生在肿瘤进展后期,其结果更支持肿瘤的截断-渐进双相演化模型。这一结果打破了既往对肿瘤演化规律的刻板认知,丰富了对肝癌演化模式的理解。
最后,研究团队还选取了三个新鉴定的潜在驱动事件(PPP1R12B、KCNJ12、FGA)进行详细功能验证,综合CRISPR定点突变及多个细胞系敲降/敲除实验,发现上述基因的突变足以导致基因表达水平的显著变化,并参与调控肝细胞癌的多种恶性表型,这些结果证实基于数据分析发现的新驱动事件的有效性。深入功能机制探究进一步揭示,潜在驱动基因FGA(编码纤维蛋白原α链,被同时鉴定为编码驱动事件和非编码驱动事件)通过负向调控TYK2-STAT3-IL6信号通路影响多种肝癌细胞的恶性表型,提示FGA及其相关信号通路有望成为肝细胞癌潜在的干预和治疗靶点。
综上,该研究所建立的中国肝癌人群基因组变异特征全景图谱,为深入理解不同病因肝癌的发生和演进分子机制、开发全新的个体化靶向药物提供了宝贵资源,有助于提升中国肝癌的临床精准诊疗水平,造福广大肝癌患者。
海军军医大学王红阳院士、陈磊研究员,北京大学生物医学前沿创新中心/北京未来基因诊断高精尖创新中心白凡教授,杜克-新加坡国立大学医学院Steven G. Rozen教授与福建和瑞基因吴琳博士为论文的共同通讯作者。海军军医大学陈磊研究员,北京大学生物医学前沿创新中心博士后张冲,北京大学-云南白药国际医学研究中心/北京大学第一医院肿瘤转化研究中心薛瑞栋研究员,杜克-新加坡国立大学医学院刘陌博士,南京大学医学院模式动物研究所博士研究生包金霞,福建和瑞基因白健博士、王寅博士为论文共同第一作者。
论文链接:
https://www.nature.com/articles/s41586-024-07054-3
原标题:《Nature:王红阳/白凡/陈磊团队揭示中国人群肝癌全基因组变异及演化特征》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




