- +1
同济大学王平团队研究成果登上Nature
原创 转网 转化医学网


本文为转化医学网原创,转载请注明出处
作者:Sophia
导读:铁死亡是一种由铁依赖性磷脂过氧化驱动的调节性细胞死亡形式,与多种疾病有关,包括癌症退行性疾病4和器官缺血再灌注损伤(IRI)。
2024年1月31日,同济大学医学院/附属第十人民医院王平教授团队(李亚旭、冉巧、段秋慧、金佳丽为共同第一作者)在 《Nature 》期刊发表了题为“7-Dehydrocholesterol dictates ferroptosis sensitivity”的研究论文。研究发现并揭示了远端胆固醇合成通路关键酶通过调控7-脱氢胆固醇(7-DHC)的水平来调控铁死亡敏感性的机制,表明了通过药物调控7-DHC水平,是一种有前途的治疗癌症和缺血再灌注损伤的新策略。

https://www.nature.com/articles/s41586-023-06983-9
研究背景
01
铁死亡是一种独特的调节细胞死亡方式,由于其在各种病理生理状况(包括癌症、神经退行性疾病4和器官 IRI)中的关键作用而引起了广泛关注。铁死亡的一个关键标志是铁依赖性磷脂过氧化,这会导致膜损伤。细胞具有内在的防御系统,可以保护自己免受磷脂过氧化。半胱氨酸/胱氨酸-GSH-谷胱甘肽过氧化物酶 4 (GPX4) 轴是通过将磷脂氢过氧化物解毒为磷脂醇来抑制铁死亡的主要途径。
7-脱氢胆固醇(7- Dehydrocholesterol,7-DHC),是胆固醇生物合成途径的代谢中间体,其由C5-甾醇去饱和酶(SC5D)合成,并被7-DHC还原酶(DHCR7)代谢用于胆固醇合成。作为一种不饱和甾醇,7-DHC在其B环中含有一个5,7-二烯,可作为脂肪酸过氧化物自由基的强效氢原子供体。到目前为止,除了7-DHC衍生的氧化胆固醇对神经元和视网膜细胞具有细胞毒性外,7-DHC的生物学作用我们还不清楚。
研究结果
02
在这项研究中,研究团队使用全基因组CRISPR-Cas9筛选,发现了参与远端胆固醇生物合成的酶在调控铁死亡方面具有关键而又截然相反的作用。具体来说,细胞通过控制7-DHC的水平来调控铁死亡,MSMO1、CYP51A1、EBP和SC5D是铁死亡的潜在抑制因子,而DHCR7则是一种铁死亡的促进因子。从机制上讲,7-DHC通过使用共轭二烯发挥其抗磷脂自氧化功能来控制铁死亡的监测,并保护血浆和线粒体膜免受磷脂自氧化的影响。重要的是,通过药物靶向EBP阻断内源性7-DHC的生物合成,可以诱导铁死亡并抑制肿瘤生长,而通过抑制DHCR7来增加7-DHC水平,则有效促进了癌症转移和减缓了肾脏缺血再灌注损伤的进展,支持了远端胆固醇合成通路在体内的关键功能。
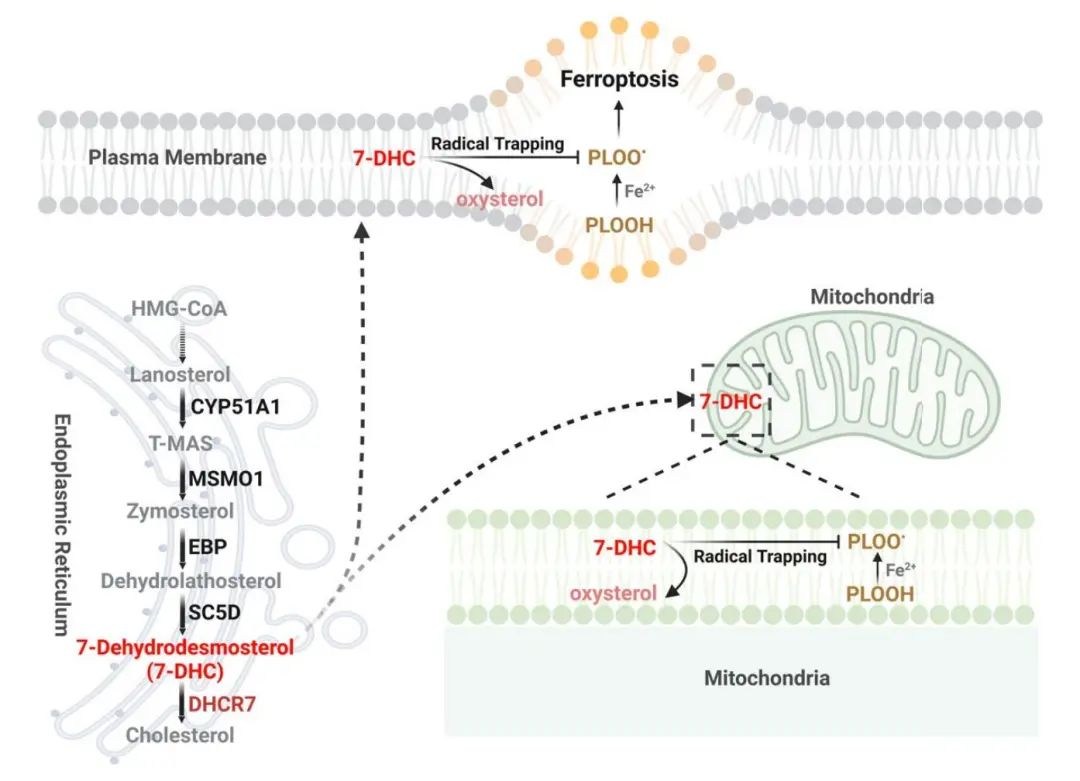
总之,我们的研究揭示了 7-DHC 作为天然抗铁性代谢物的作用,并表明 7-DHC 水平的药理学操作是一种很有前途的癌症和 IRI 治疗策略。
研究意义
03
本研究,我们提供了明确的证据,证明7-DHC是一种有效的抗铁沉降代谢物。7-DHC通过转移磷脂的过氧化途径,保护细胞免受质膜和线粒体上的磷脂过氧化,从而减轻铁死亡。我们发现麦角甾醇是酿酒酵母中发现的 7-DHC 的类似物,也可以抑制铁死亡。据推测,这些不饱和甾醇共有的共同化学性质,特别是它们对共轭二烯的占有,使自由基捕获能够抑制铁死亡。我们的研究还表明,不同脂质(如磷脂和甾醇)的过氧化在铁死亡过程中可能具有不同的功能。此外,有必要进一步研究通过氧化和其他化学衍生的 7-DHC 的各种代谢物是否参与铁死亡调节。
重要的是,我们的研究具有很强的治疗意义。我们提供了令人信服的证据表明,抑制 7-DHC 生物合成是治疗癌症的潜在策略,尤其是那些具有高水平 7-DHC 或 DHCR7 突变的癌症,例如伯基特淋巴瘤。我们的研究还表明,通过药理学抑制 DHCR7 来提高 7-DHC 水平可能会改善 IRI 患者的临床结果。由于一组 FDA 批准的药物已被证明可以抑制 DHCR7,因此这种可能性很容易在临床环境中测试,用于治疗慢性 IRI 患者。
参考资料:
https://www.nature.com/articles/s41586-023-06983-9
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




