- +1
急性脑卒中CT灌注成像的理论基础
原创 赵喜同学 XI区
CT灌注(CTP)是一种功能性成像技术,它提供了有关脑实质毛细血管水平血流动力学的重要信息,是对CT平扫和CT血管造影在评估急性卒中、血管痉挛和其他神经血管疾病方面优势的补充。CTP对于确定不可逆梗死的脑组织(梗死 "核心")和严重缺血但有可能挽救的组织("半影")的范围至关重要。这是通过生成脑血流量、脑血容量和Tmax等参数图来实现的。
今天我们分享一篇经典文献,讨论CT灌注(CTP)的临床背景。以及通过使用最大斜率法和两种主要的去卷积模型,即傅里叶变换(Fourier transformation,FT)和奇异值分解(singular value decomposition,是CTP中最常用的数字方法)来构建CTP伪彩图。
CTP的临床背景
急性缺血性卒中的管理仍然具有挑战性,因为必须在有限的时间窗口内做出诊断和实施治疗。根据1995年美国国家神经疾病和脑卒中研究所的试验,在脑卒中发病3小时内使用静脉注射组织凝血酶原激活剂(tPA),以及在脑卒中发病9小时内使用脑缺血机械取栓装置,是目前唯一被美国食品和药物管理局批准用于急性脑卒中的治疗方法。(随着技术的进步,溶栓时间窗已经扩展到24小时。)目前静脉注射TPA前唯一需要的影像学技术是头部CT平扫,用于排除颅内出血(绝对禁忌症)和梗死面积大于大脑中动脉(MCA)区域的三分之一(相对禁忌症和预测TPA注射后出血风险增加)。然而,从症状出现到治疗的严格的3小时窗口期,运输和分流的延误,以及TPA给药的多种禁忌症,都限制了静脉注射TPA的使用,通常只占缺血性卒中患者的3%-5%。
对先进的CT和MR成像技术的兴趣越来越大,以扩大成像的传统解剖学应用,对急性卒中的病理生理学提供更多的了解。越来越多的证据表明,一些患者的核心/半影不匹配可能会持续到缺血损伤后的12小时甚至24小时。
急性卒中影像学解决了4个关键问题:
是否有出血?
是否有血管内血栓可作为溶栓治疗的目标?
是否有严重缺血的不可逆梗死核心?
是否有严重缺血但有可能挽救的半影组织?
CTP解决了后两个问题,而CT平扫和CT血管成像(CTA)分别解决了第一和第二个问题。CTP的应用早在1980年由Axel首次提出;然而,当时的CT采集和后处理系统太慢,无法使CTP成为现实。
大脑灌注指的是组织(毛细血管)层面的血流。脑组织血流可由几个参数描述,包括CBF、CBV和平均通过时间(MTT)(图1)。CBV被定义为大脑中一定体积内流动的血液总量,单位为每100克脑组织的血液毫升数。CBF被定义为单位时间内通过一定体积的大脑的血液量,单位为每100克脑组织每分钟的血液毫升数。MTT被定义为血液通过特定脑区的平均运输时间,单位为秒。"核心区 "通常在操作上定义为CBV病变体积,而 "半影区 "则是MTT或CBF病变体积。
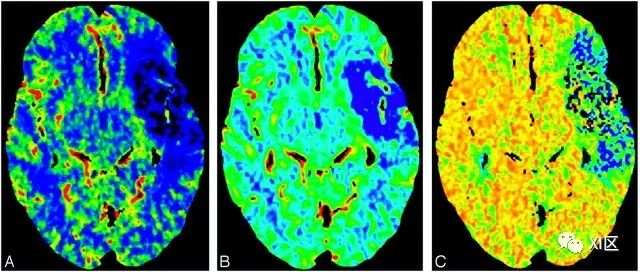
图1. 急性缺血性卒中患者的CT灌注图像显示左侧MCA分布有较大的灌注缺损,CBV/MTT或CBF错配最小。A,CBF。B,CBV。C, MTT。
将核心区/半影区不匹配作为治疗的选择标准,已经完成和正在进行的试验清单很长,说明高级影像学在急性卒中管理中的作用越来越重要。这些试验使用预定义的核心区和半影区的阈值来选择有可能从血管再通中获益的患者。CT灌注也可与非再灌注的神经保护疗法一起应用于急性卒中。
在目前的临床实践中,CTP可用于识别MCA闭塞和核心/半影不匹配的患者,用苯肾上腺素(新肾上腺素)诱导高血压治疗,甚至超过溶栓窗口期。高流量氧治疗(高压氧或常压氧)是另一种有前途的神经保护策略,用不匹配成像选择患者可能会起到作用。在重症监护室接受心脏手术的患者也可能从CTP中受益;最近的一项研究报告称,这些患者在检测和绘制急性缺血性卒中方面具有更高的敏感性,而传统的影像学检查结果与临床状况的严重程度不一致。
经颅多普勒超声检查、CTA和脑血管造影都能检测到血管痉挛,即视觉上明显的血管口径缩小,是动脉瘤破裂后死亡和发病的最主要原因。然而,它们不能检测到临床痉挛(因脑血流减少而引起的意识模糊和意识水平下降的综合症)。CTP在检测临床相关的痉挛方面比用于血管造影痉挛的方法更敏感,其测量方法是CBF的减少和MTT的延迟。一些研究表明,CTP是SAH相关临床痉挛患者和动物模型中继发性脑梗塞的敏感和早期预测因素。
CTP理论和建模
与MR灌注加权成像的比较
与基于MR成像的方法相比,CTP成像技术相对较新。由于计算CBF、CBV和MTT等灌注参数的一般原则在MR成像和CT中都是相同的,因此使用这些技术中的任何一种进行灌注成像的总体临床适用性是相似的。然而,技术上的差异产生了几个重要的区别,总结在表1中。CTP最重要的优势是CT中对比剂浓度和衰减之间的线性关系,这有利于CBF和CBV的定量(而不是相对)测量。MR灌注成像(MRP)依赖于钆在组织中诱导的间接T2*效应;T2*效应本身与钆浓度没有线性关系,使得CBF和CBV的绝对测量变得困难。CTP的一个缺点是覆盖范围相对有限,而MRP能够在一次注射中覆盖整个大脑(目前已经实现全脑的CTP)。为了做出与卒中有关的治疗决定,CTP的覆盖范围必须足以扫描整个有梗死风险的缺血区。与梯度回波序列相比,使用CT而不是MR成像进行卒中评估的第二个缺点是检测脑微出血的敏感性降低。然而,T2*加权MR成像检测到的微出血已被证明不是溶栓治疗的禁忌症。
表1 CTP与MRP的比较

CBV的计算
动态首过CTP测量方法包括静脉注射血管内造影剂,在其第一次循环通过脑组织毛细血管床时进行连续成像追踪。动态首过造影剂增强CTP模型的主要假设是,灌注示踪剂是不可扩散的,既不会被其穿过的组织代谢也不会被吸收。这当然是健康人脑的情况;然而,在感染、炎症或肿瘤中血脑屏障(blood-brain barrier,BBB)的破坏增加了一个额外的复杂性。当存在广泛的BBB破坏时,造影剂渗入血管外空间会导致CT CBV的高估。
使用CTP来确定脑灌注是基于对动脉、组织和静脉增强之间关系的研究。更具体地说,示踪剂动力学理论指出,如果知道示踪剂的输入和输出,就可以确定分布体积(即血管体积分数)和清除率(即每单位组织体积的流量),血管体积分数(fractional vascular volume)f由以下公式定义。
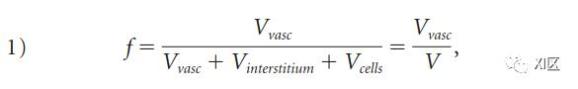
其中Vvasc、Vinterstitium和Vcells分别为血管、间质和细胞所占的体积。如果选择的感兴趣区域没有主要的血管,那么测得的CT值变化将反映组织血池。由CT扫描仪测量的组织中的对比剂浓度Ctissue比血管内浓度Cvasc小,小的部分为f。
通过动脉输送到组织的造影剂总量是CBF与动脉浓度积分的乘积,Cartery(t)。根据质量守恒原理,这个总量必须等于离开组织的量,即CBF与Cvasc(t)积分的乘积,因此

从方程2和3,可以看出
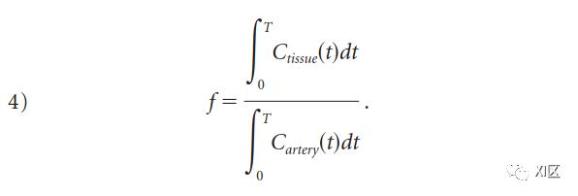
如果考虑到脑组织的衰减ρ和校正因子CH,以调整动脉和毛细血管红细胞压积的差异,CBV可以从方程4中计算出来。20世纪70年代的体内实验表明,与动脉血细胞压积相比,毛细血管的红细胞压积明显较低;因此,CBV的定量需要引入CH,如下。
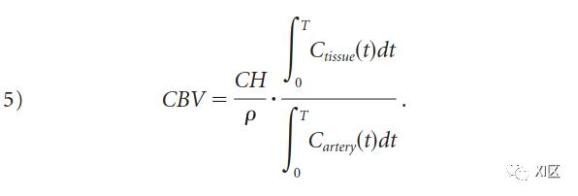
理论建模表明,CTA采集的源图像(CTA-SI)主要是血容量加权,而不是血流加权,假设在扫描采集时动脉和组织对比度达到稳定状态。这在临床实践中是很有吸引力的,因为CTA-SI减影图,与首过CTP图不同,可以提供全脑覆盖。由于碘引起的衰减变化与碘浓度成正比,因此,在实践中,根据公式5(图2)的关系,可以用脑组织(ΔHUtissue)和动脉血(ΔHUartery)亨氏单位(HU)的变化比率来估计CBV。具体来说,CBV可以用每100克组织的毫升数表示,具体如下。
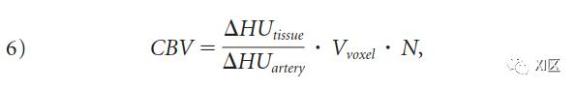
其中Vvoxel是体素体积,N是100克组织中计算出的体素数。
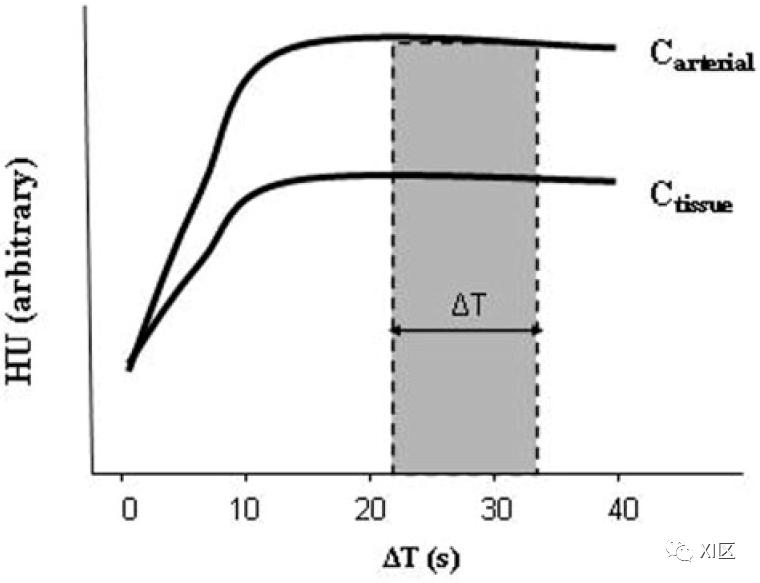
图2 在造影剂浓度稳定状态下获得的CTA源图像,其动脉和组织-时间-衰减曲线(ΔT)主要是血容量而不是血流量加权。由于碘而引起的衰减变化与碘的浓度成正比。CBV等于两条曲线下的面积之比,分别为Ctissue和Carterial。当两条曲线接近稳定状态时,这可以近似为HUtissue/HUarterial的比率。
尽管在20世纪90年代和21世纪初使用的多排CT(MDCT)注射方案中可以假设组织动脉造影剂处于相对稳定的状态,例如,低造影剂注射率和相对较长的准备延迟时间(通常为3 ml/s,且>25秒)。这种稳态假设在新的更快的MDCT CTA方案时代不再成立,例如那些用于64排CT扫描仪的方案,其中注射率≤7 ml/s和15-20秒的短准备延迟时间改变了时间衰减输注曲线的时间形状,消除了CTA-SI采集时间中的近稳态。因此,随着目前在更快的最先进的MDCT扫描仪上实施CTA协议,CTA-SI图已经变得更多的流量加权而不是容积加权。
CBF和MTT计算的数学模型
计算CBF和MTT的两种主要数学方法是基于去卷积和非去卷积的方法。去卷积技术在技术上要求更高,涉及更复杂和耗时的处理,而非去卷积技术则更直接,但取决于对基础血管结构的简化假设。因此,在某些情况下,基于非去卷积方法的研究解释可能不太可靠,尽管这还没有得到充分的临床验证。
基于非去卷积的模型
与去卷积方法一样,非去卷积方法也是基于质量守恒的Fick原理在脑实质内特定区域的应用(图3)。在注射造影剂的过程中,在对应于造影剂完全洗入和洗出的时间段内,脑组织体素的累积质量Q(T)等于CBF和造影剂浓度的动静脉差的时间积分的乘积。
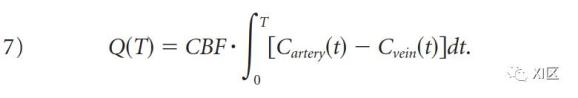

图3 Fick原理
有一个直接的简化可以使解决这个方程的计算量减少,那就是假设在上述时间段内,静脉浓度为零(即没有对比剂到达循环的静脉侧,"没有静脉流出 "的假设)。这个假设只有在T<4-6秒时才有效,T是血液通过大脑的最短运输时间。在这个假设下,方程7可以简化为如下。
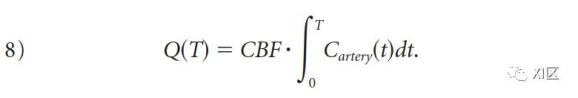
这被称为Mullani-Gould公式或单室公式。
当把方程8改写成其导数形式,以方便计算CBF。
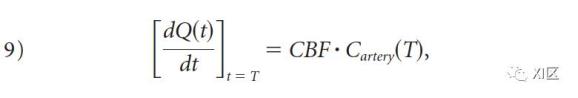
由此可见,当动脉浓度达到最大时,造影剂的积累速度将达到峰值。
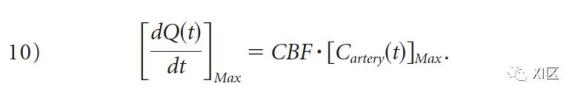
因此,CBF是Q(t)的最大斜率与最大动脉浓度的比率。这类似于Mullani-Gould公式中关于时间的区分,被称为 "最大斜率法"。最大斜率法的主要优点是简单,因此可以快速计算灌注值。然而,为了满足无静脉流出的假设,需要非常高的造影剂注射率--通常至少为10ml/s。无静脉流出假设显然是过于简单化了,而且这种方法产生的是相对的,而不是绝对的灌注测量,使得病人之间或机构之间的结果难以比较。
基于去卷积的模型
考虑到将造影剂材料注入感兴趣的组织体素,我们可以用两个函数来定义组织中的示踪剂浓度Ctissue(t)。
1) 残留函数,R(t):在理想的瞬时单位注射后的时间t内,仍有一部分示踪剂存在于感兴趣的体素。R(t)是无单位的,在t = 0时等于1。
2) AIF, Cartery(t):时间t时,感兴趣体素的流入血管中示踪剂的浓度。
CBF的计算需要测量动脉输入和组织-时间-衰减曲线的时间形状。进入感兴趣的组织体素的真实输入不能直接测量;在实践中,AIF是从一条主要动脉(如MCA或颈内动脉的 "顶部")估计的,假设这代表了对感兴趣组织的确切输入。在从用于估计AIF的动脉到感兴趣的组织的过程中引入的任何延迟或分散都会在CBF的定量中引入误差。
观察到的组织-时间-衰减曲线代表了AIF的影响和固有的组织特性的结合。因此,为了适应模型,必须通过一个被称为 "去卷积 "的数学过程来消除AIF对组织浓度曲线的影响,从而得出R(t),它只取决于所考虑的体素的血液动力学特性。R(t)显示出一个突然的(实际上是瞬间的)上升,一个持续时间等于通过感兴趣的组织的最小传输时间的高原,然后向基线衰减。Meier和Zieler表明,组织浓度曲线可以表示为CBF乘以AIF与R(t)的卷积。
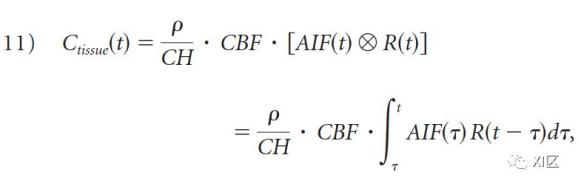
其中"⊗"是卷积算子,ρ是脑组织衰减,CH是毛细血管红细胞压积水平的校正因子。Ctissue和AIF是直接从动态CTP源图像的时间衰减曲线上测量的,然后问题就变成了CBF和R(t)的计算。已经提出了几种 "去卷积 "方程11的方法,从而解决CBF和R(t)的问题,主要分为两类。用参数化方法,假设R(t)有一个具体的分析表达。假设R(t)的特定形状,就会对固有的组织特性提出假设,而这些特性是无法事先知道的,也没有足够的精度。由于这一限制,最常用的方法是非参数方法,它不假设R(t)的形状。
方程11的去卷积不稳定,因为它在计算R(t)的解时经常产生非生理性的振荡(即噪声)。非参数方法可进一步细分为两类,它们在处理因去卷积不稳定性而产生的噪声的方式上有所不同。在第一类,即变换方法中,FT的卷积定理被用来去卷积方程11。该定理指出,2个时域函数的卷积的FT相当于它们各自FT的乘法。用卷积定理,方程11可以重写为
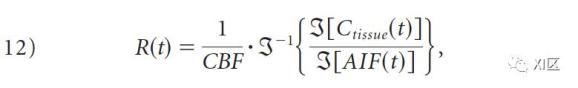
其中ℑ是傅里叶变换。因此,R(t)和CBF可以通过取采样的AIF(t)和Ctissue(t)的两个变换的比率的反FT来确定。然而,这种方法对噪声非常敏感。
第二种方法,即更常用的奇异值分解(SVD),是对方程11的卷积积分的代数重述,改写为

其中t1,t2,...tN是等间隔的时间点,AIF(t)和Ctissue(t)测量获得。方程13可以用简明的矩阵-矢量符号重写
其中b和c分别为R(ti)和Ctissue(ti)的向量,A是方程13的卷积矩阵。可以证明,b的最小二乘解由(AT-A)-1-AT给出,其中AT是卷积矩阵的转置,(AT-A)-1是对称矩阵AT-A的逆。SVD将A分解为矩阵的乘积,这样就可以很容易地找到(AT-A)-1,b的解决方案可以写成由A的奇异值的倒数加权的项之和。通过截断解向量b的小奇异值,避免了AIF(t)和Ctissue(t)中的噪声振荡。
SVD在所有用于绘制CBF的去卷积方法中产生了最稳健的结果,并获得了广泛的认可。一旦知道了CBF和CBV,MTT就可以通过中心容积定理从CBV和CBF的比率中计算出来。
使用去卷积方法计算CBF的潜在隐患包括患者运动和部分容积平均,这可能导致AIF(t)的低估。用图像配准软件校正病人运动和仔细选择AIF的感兴趣区域可以最大限度地减少这些缺陷。
商业软件供应商使用不同的数学方法。在过去,一些软件采用了最大斜率法,有些软件使用去卷积技术,虽然理论上优于非去卷积方法,但已经并将再次注意到,使用的全部临床意义尚未由脑卒中成像界建立和标准化。
CTP的验证
用CTP进行CBF定量已经在动物和人类中进行了初步测试。在动物中,量化CBF的公认参考标准方法是微球技术,其次是死后组织学。CTP测量已在健康动物、实验性缺血性脑卒中的动物和植入肿瘤的动物中得到验证。在人类中,CTP已经在健康人、急性卒中患者和慢性脑血管病患者中用正电子发射断层扫描和氙气增强CT进行了验证。表2总结了其中一些研究。Wintermark等人和Kudo等人进行的基于去卷积的CTP研究给出的斜率在13%以内,而Sase等人使用的最大斜率技术与统一性的差异为20%-60%。

编译整理自:Konstas AA, Goldmakher GV, Lee TY, Lev MH. Theoretic basis and technical implementations of CT perfusion in acute ischemic stroke, part 1: Theoretic basis. AJNR Am J Neuroradiol. 2009 Apr;30(4):662-8. doi: 10.3174/ajnr.A1487. 仅供专业人士交流目的,不用于商业用途。
2023年12月8日
如果你觉得写得还不错,请分享!
原标题:《急性脑卒中CT灌注成像的理论基础》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




