- +1
“抗癌神药”也致癌?6款CAR-T产品在美遭调查,影响到底有多大
“抗癌神药”CAR-T疗法因安全性问题遭遇监管机构的调查。
当地时间11月28日,美国食品药品监督管理局(FDA)官网发布公告称,将调查关于接受靶向BCMA或CD19自体CAR-T 细胞免疫疗法治疗的患者出现T细胞恶性肿瘤(包括嵌合抗原受体CAR阳性淋巴瘤)的风险,已经确认目前批准的所有靶向BCMA和CD19的CAR-T疗法都有该风险。简单来讲,FDA认为,接受CAR-T疗法的患者有患上其他肿瘤的风险。

FDA点名6款CAR-T产品
FDA在公告中直接点名了4家公司共计6款已在美国获批的CAR-T疗法,包括百时美施贵宝(BMS)的Abecma和Breyanzi,传奇生物/强生的Carvykti,诺华的Kymriah,吉利德的Tecartus和Yescarta。
或受上述消息影响,除了美股相关上市公司,港股、A股多家拥有CAR-T疗法的上市公司股价也出现不同程度的异动。面对FDA的调查,多家美国药企回应称,还没有证据证明CAR-T疗法与T细胞恶性肿瘤的关系。也有港股上市公司强调,这次事件对公司产品的研发和商业化进程没有实质影响。
6款产品被点名,FDA调查搅动全球CAR-T市场
CAR-T疗法属于细胞免疫疗法,是在体外利用基因工程的方法修饰患者外周血T细胞,赋予T细胞靶向识别肿瘤细胞表面抗原的特性 ,经体外扩增培养后回输到患者体内进行治疗肿瘤的方法。简单来说,CAR-T疗法就是利用人体免疫细胞抗癌,有“抗癌神药”之称。
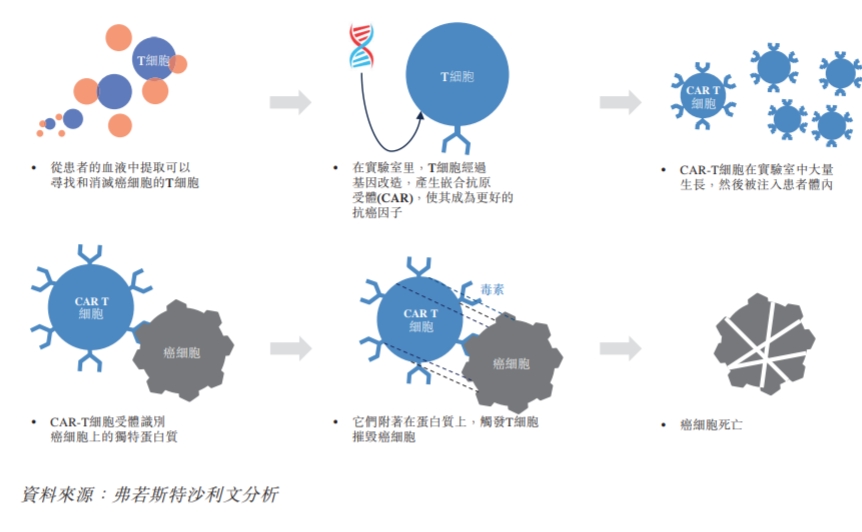
CAR-T的治疗过程
在此次FDA的调查公告之前,CAR-T疗法最受关注的是其价格,国内在百万级别,国外的价格最高超过45万美元。此次FDA的调查则将CAR-T疗法的安全性摆在了大众和行业面前。根据FDA的公告,报告的数据来自临床试验和/或上市后的不良事件。尽管这些产品的总体益处仍超过其批准用途的潜在风险,但FDA正在调查已确定的风险,这些风险会导致住院和死亡等严重后果。
或受上述调查消息的影响,美股多家拥有CAR-T产品的药企股价下跌:百时美施贵宝(BMY) 28日和29日均小幅收跌;吉利德科学(GILD)和诺华(NVS)28日均收跌,29日小幅收涨;传奇生物(LEGN)28日收跌2.55%,29日收跌0.28%。
传奇生物的CAR-T疗法是为数不多在美国获批的国产创新药,其出海方式是牵手知名跨国企业强生,目前该产品还未在国内获批。不过,传奇的母公司是港股上市公司金斯瑞生物科技(1548.HK),金斯瑞生物科技29日收跌6.02%,30日盘中跌幅一度超5%,收跌0.23%。
目前,国内已经获批的CAR-T疗法共有四款,其中包括复星医药(600196.SH;2196.HK)和药明巨诺(02126.HK)两家上市公司。
复星医药的阿基仑赛注射液是中国首个获批上市的CAR-T产品,是复星凯特从美国Kite Pharma(吉利德科学旗下公司)引进Yescarta技术,同时获得授权在中国进行本地化生产的靶向CD19自体CAR-T疗法,Yescarta此次也被FDA点名。复星医药29日A股收跌1.35%,港股收跌3.24%,30日港股收跌1.38%。
药明巨诺的瑞基奥仑赛注射液是国内获批的第二款CAR-T产品。11月28日,CDE 官网显示,拟将瑞基奥仑赛注射液纳入优先审评,用于治疗成人复发或难治性套细胞淋巴瘤。积极进展遭遇美国的调查风波,药明巨诺29日平收,30日微涨0.61%。
除了已经获批的CAR-T疗法背后的上市公司,此次调查风波也波及到在研CAR-T疗法的上市公司。以科济药业(02171.HK)为例,该公司专注于治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法,旗下CAR-T产品泽沃基奥仑赛注射液的上市申请于2022年10月获得受理,预期将于2023年底或2024年初获批用于治疗复发/难治多发性骨髓瘤。FDA的调查公告宣布后的29日,科济药业大跌23.29%。
多家企业回应:对公司CAR-T产品的安全性充满信心
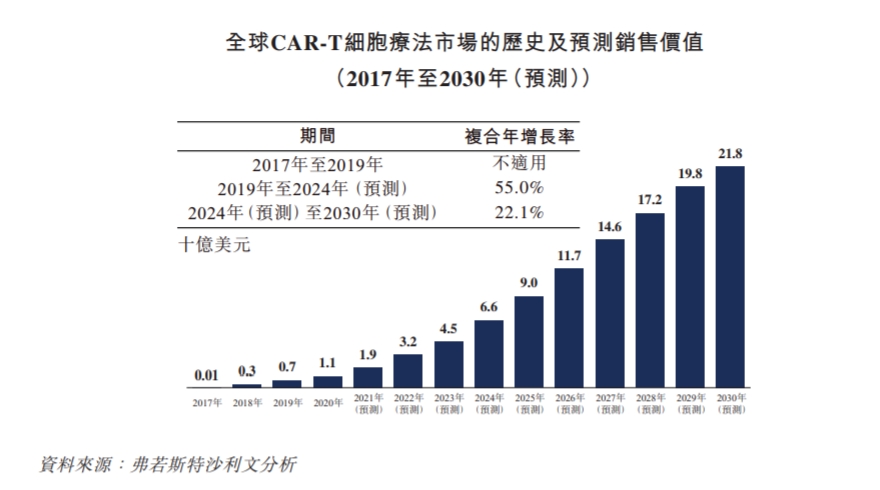
据弗若斯特沙利文数据,按销售价值计算,全球CAR-T市场规模从2017年的0.1亿美元增长到2019年的7亿美元,预计到2030年全球CAR-T市场规模预计达到218亿美元,2024年至2030年的复合年增长率为22.1%。
CAR-T赛道吸引了众多玩家,不仅包括强生、诺华等成熟的跨国药企,也包括传奇生物、科济药业等新兴的生物科技公司,有产品已经成为企业的重磅产品。以2022年为例,全球CAR-T市场规模接近27亿美元,其中吉利德的Yescarta全年营收11.6亿美元,成为首款年销售额超过10亿美元的CAR-T疗法。
面对FDA给CAR-T赛道泼的这盆冷水,众多公司纷纷作出回应,大都强调,公司对自家CAR-T疗法的安全性充满信心,且目前证据尚无法说明该产品与继发性肿瘤的因果关系。
吉利德方面表示,将完全配合FDA的要求,对CAR-T疗法的数据进行额外分析,公司对两款CAR-T疗法的整体安全性充满信心,已有17700名患者在临床试验和商业环境中接受了这些产品的治疗。目前为止,还没有证据表明接受两款产品治疗与新继发性恶性肿瘤的发生有因果关系。
对于Kymriah的安全性,诺华表示,在治疗了1万多名患者后,该公司尚未确定CAR-T产品与继发性恶性肿瘤之间的因果关系。值得关注的是,除了Kymriah,11月13日,诺华制药还曾宣布,与传奇生物就传奇生物的特定靶向DLL3的嵌合抗原受体T细胞(CAR-T)疗法签订独家全球许可协议,协议授予诺华开发、制造和商业化这些细胞疗法的全球独家权利,该协议的总交易金额达到11.1亿美元。
面对FDA对Carvykti的安全性调查,传奇生物公开回应称,即使没有进行CAR-T细胞治疗,多发性骨髓瘤患者也可能发生T细胞恶性肿瘤。此外,其他与骨髓瘤相关的治疗,例如烷基化剂、免疫调节药物和自体干细胞移植,都与继发性癌症的风险增加有关。传奇生物的合作伙伴美国强生公司也在表示,已与FDA共享Carvykti治疗后的监测数据,Carvykti迄今已在2000名患者身上使用,具有良好的收益风险比。
拥有两款CAR-T疗法的BMS也在声明中强调,对公司的细胞疗法的安全性和临床价值保持信心,公司已经在临床和商业环境中为超过4700名患者使用两款产品治疗,目前尚未观察到任何CAR阳性T细胞恶性肿瘤病例,因此我们未发现我们的产品与继发性恶性肿瘤之间存在因果关系。
对于FDA的调查,国内CART-疗法相关公司大多未对外发声。11月30日早间,科济药业发布声明表示,基于目前已经公开发表的信息,T细胞恶性肿瘤在接受CAR-T治疗患者中的发病率非常低。截至目前,科济药业在研CAR-T产品,临床试验治疗患者总数超过500例,其中靶向BCMA CAR-T产品250余例,未观察到T细胞肿瘤案例。这次事件对公司产品的研发和商业化进程没有实质影响。
11月30日,科济药业创始人、董事会主席、首席执行官、首席科学官李宗海在接受澎湃新闻记者采访时表示,FDA对CAR-T产品展开调查是出于对公众负责的态度,但最终还是需要做大量数据的采集分析,用数据说话,“最终还是回到数据上,这个药好不好,获益风险比是怎样的”。至少目前在血液肿瘤领域,CAR-T展示了非常强大的疗效和很好的获益风险比,这也是为什么CAR-T疗法受欢迎的重要原因。
科济药业在声明中援引Moffitt癌症中心的Frederick Locke教授在MedPage Today的观点提到,“接受CAR-T治疗的患者中,T细胞淋巴瘤的发生率约为万分之一或二”。李宗海向澎湃新闻记者介绍,现在围绕CAR-T的另一个研究方向是自身免疫性疾病,这类患者本身没有肿瘤,且是慢性病,哪怕有万分之几的可能致癌,也会受到更大关注。尽管如此,最终也要看获益风险比,至少CAR-T已看到在自免疾病治疗,如系统性红斑狼疮的良好前景,只是在慢病领域需要更长时间的观察和理解这种获益风险比。FDA此次的调查对做自身免疫性疾病的CAR-T公司可能冲击更大一些,对做肿瘤适应证的公司影响相对较小。
对于此次调查对整个CAR-T行业的影响,李宗海认为,短期有一定影响,但长期来看,行业的前景还是取决于CAR-T本身的安全性和有效性。目前还没有明确的证据证明CAR-T产品和继发性肿瘤之间的因果联系。此外,CAR-T的技术发展空间很大,将来还可以通过技术进一步改造提高产品的安全性,这也是企业可以做的方向。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




