- +1
《细胞》重磅综述:阿尔茨海默病临床试验经验总结,未来应走向何方?
原创 代丝雨
*仅供医学专业人士阅读参考


阿尔茨海默病(AD)素有“天坑”之名,因为它的新药研发在过去的几十年里几乎是来一个没一个,直到最近两三年,才有了抗β淀粉样蛋白(Aβ)单抗的成功案例。
继aducanumab有争议的获批之后,2022年,lecanemab的3期临床宣布阳性结果,在1795名前驱至轻度AD患者中,lecanemab治疗显著减缓了CDR-SB评分下降27%;2023年,donanemab结果宣布,疾病进展延缓达到了29%。二者均很快拿到了FDA的上市批准。
尽管还有很多问题需要解决,不过连续的阳性结果无疑给疲惫的研发环境和饱受质疑的Aβ假说注入了极大的信心。
为何研发历史已经过去了几十年才得以迎接这迟到的“胜利”?
《细胞》杂志发表了一篇综述,讨论了AD临床试验的巨大改变。固然,新药本身是治疗的根本,但不可忽视的是,近年来对病理生物标志物的理解大幅度增加,一方面帮助了选择合适的患者,一方面也能够更有效地评估临床疗效。而AD的临床试验也面临着时间长、成本高等等亟待解决的问题。让我们一起来看看这篇综述中所描述的AD临床试验的过去、现在和未来。

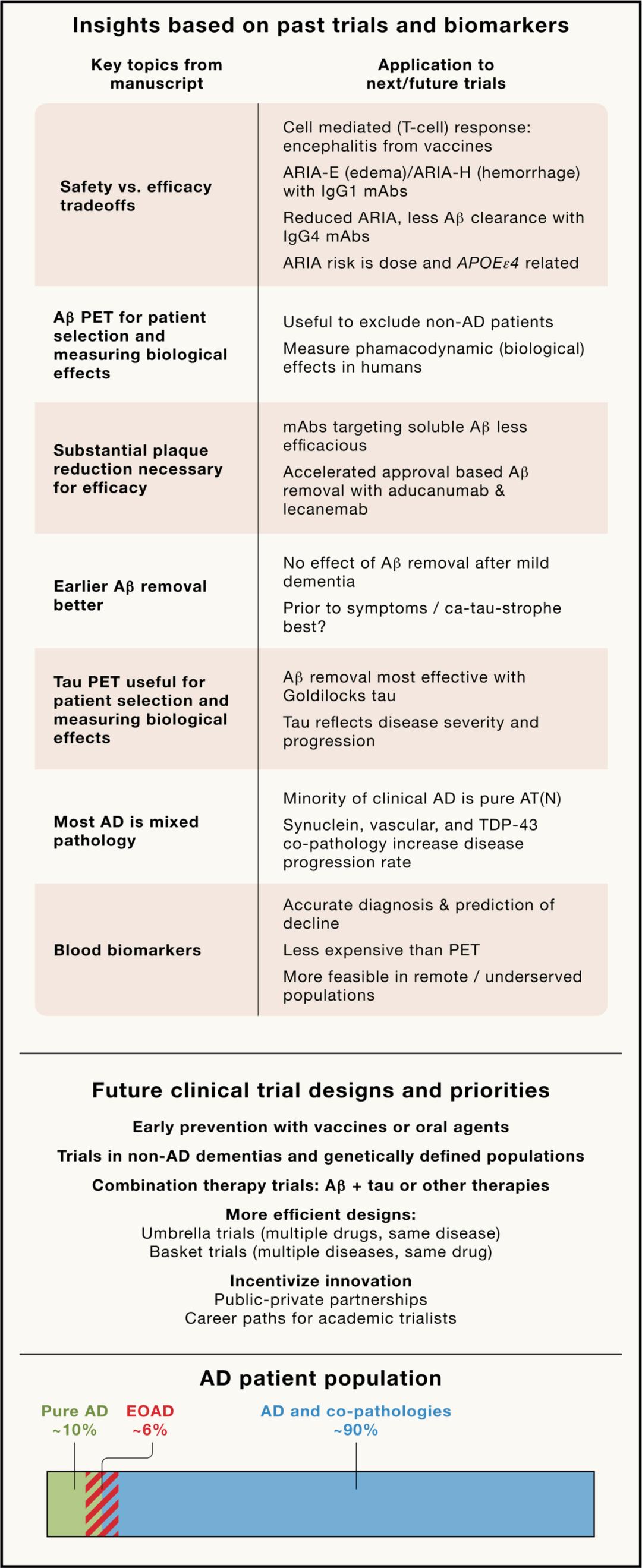
太长不看版总结图
临床试验教会我们的
AD的疾病修饰疗法研究或许可以从30年前算起,淀粉样蛋白级联假说和第一个过表达人淀粉样蛋白前体蛋白(APP)的转基因小鼠模型奠定了研究的基础。科学家发现,使用人类Aβ42免疫小鼠能够减少小鼠脑内Aβ的沉积,这促进了第一种主动免疫治疗手段,疫苗AN1792的出现。
AN1792有严重的不良反应,可能由于防腐剂产生了严重的细胞毒性T细胞反应。不过后续分析显示,接种高滴度疫苗的患者出现了明显的临床获益趋势。这支持了清除淀粉样蛋白的治疗潜力。
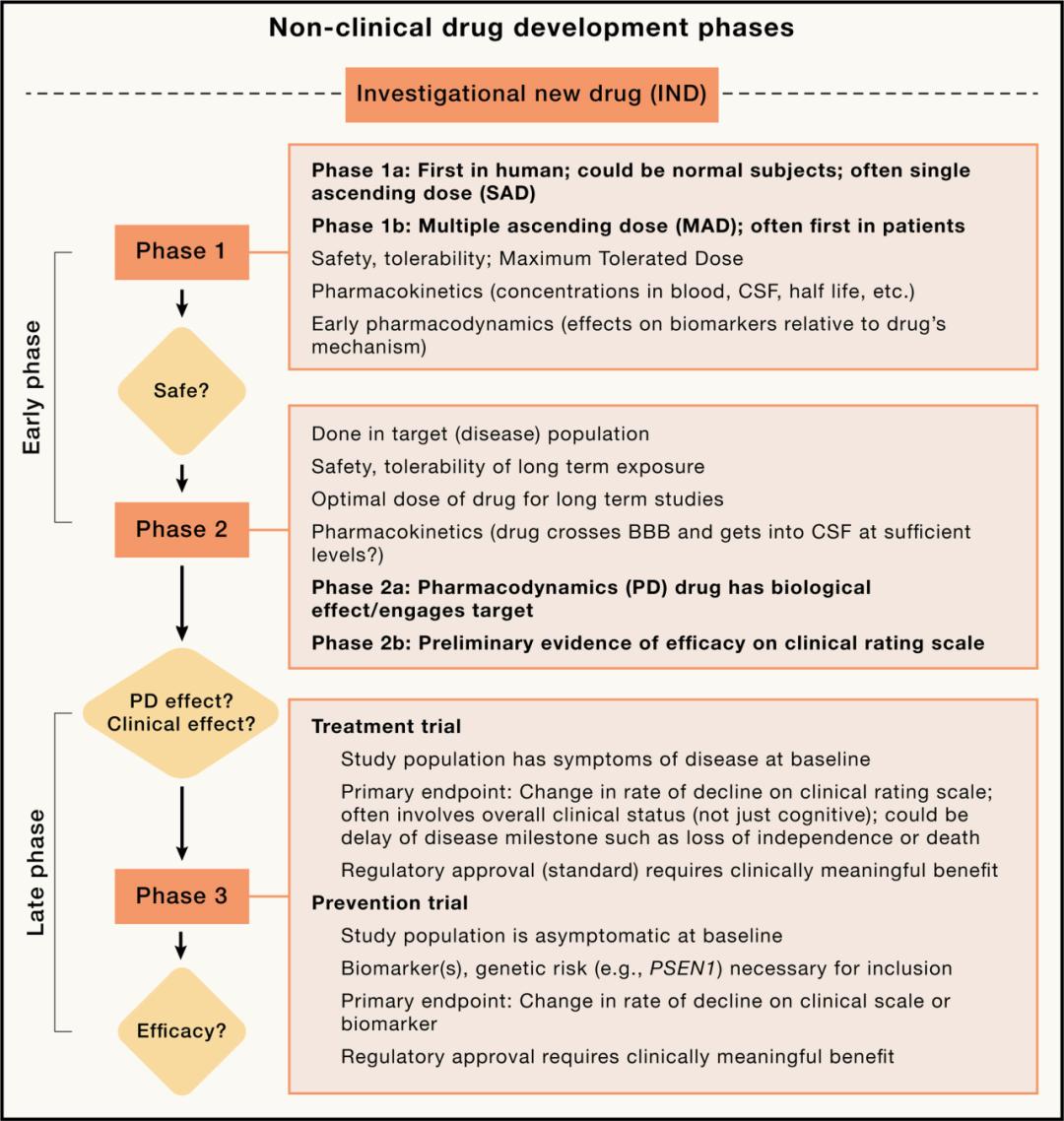
AD新药的开发阶段
首个进入晚期阶段的Aβ单抗bapineuzumab的试验中,我们认识到了淀粉样蛋白相关成像异常(ARIA)这种不良反应,包括脑水肿(ARIA-E)和微出血(ARIA-H)两种,今天已经成为抗Aβ疗法中最受关注的不良反应之一。
ARIA风险随APOE4等位基因数量和给药剂量的增加而增加,且与PET成像中淀粉样蛋白清除更多有关。对炎症性脑淀粉样血管病的研究中,发现证据表明ARIA可能由炎症反应介导。
根据这些发现,监管机构要求临床试验设计尽量避免ARIA风险,措施包括降低单抗的给药剂量,尤其是针对APOE4携带者;开发新的单抗,例如设计不激活小胶质细胞的IgG4骨架;限制脑淀粉样血管病(CAA)患者参与后续试验等等。
更根本的解决方案还是进一步了解ARIA的发病机制。有趣的是,基于与较少CAA相关的APP北极突变开发的lecanemab,相较donanemab和aducanumab ARIA-E发生率较低,或许能够提供一定的机制猜想。

AD相关研发时间线
bapineuzumab 2期临床试验中首次使用了淀粉样蛋白PET,由此带来的另一个关键发现是,约30%的APOE4非携带者中并没有大量的淀粉样斑块,因此他们可能实际上并不是AD患者,而是其他痴呆类疾病。
如今的试验设计中普遍要求以PET Aβ阳性或CSF中Aβ和tau水平作为关键纳入标准,同时,PET也可以作为药效学的生物标志物来确定临床疗效。
在aducanumab的剂量递增试验中,临床疾病进展延缓表现出了显著的和PET淀粉样斑块减少有关。由于临床评估的不准确性,PET结果显然是更容易量化的疗效指标。
基于PET变化预测临床获益,FDA正是基于这样的假设抛出了加速批准。
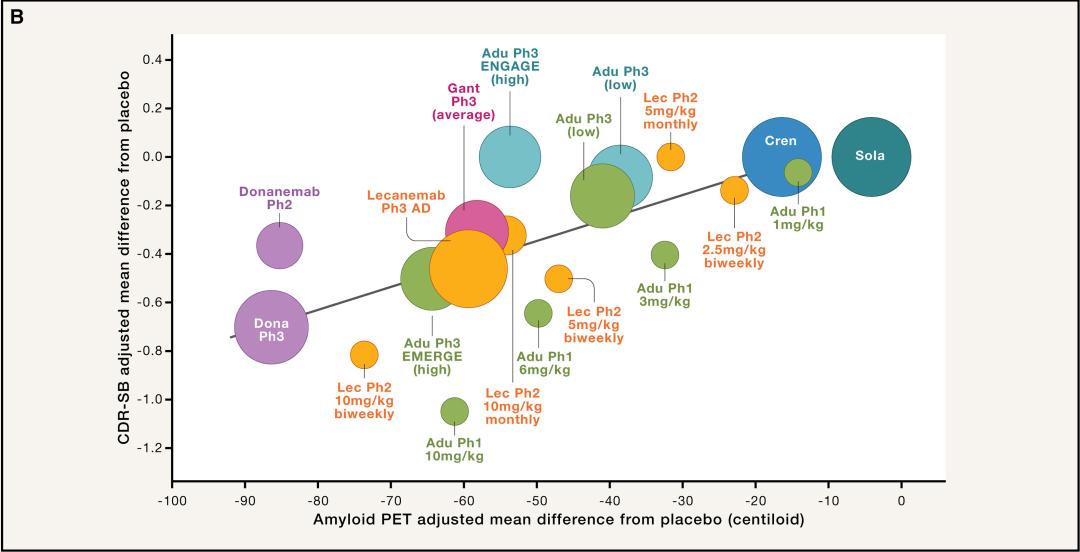
PET变化与认知结局的相关性
当然,对于一种疾病来说,临床疗效与治疗窗口也关系颇深。对于AD来说,治疗起始时机过晚、或者治疗过程中淀粉样蛋白清除速度过慢,都可能是疗效不佳的原因。
目前NIA-阿尔茨海默病协会的AD诊断标准采用AT(N)框架,即同时要求脑淀粉样蛋白(A)和tau(T)沉积的证据,神经变性(N)常见但不必需。虽然淀粉样蛋白级联假说中认为这三者存在递进的关系,但近年来的研究数据表明,Aβ和tau可能同时积累,并在tau沉积达到一定阈值后快速扩散至新皮质,即所谓的ca-tau-strophe阶段。
有充分研究证据显示,tau沉积的数量和解剖位置与临床症状的类型和严重程度密切相关,例如典型遗忘性AD中,当tau局限于内侧颞叶时,患者主要表现为记忆问题,而当tau出现在新皮质,则会出现语言、导航或执行功能等其他症状。从donanemab和lecanemab的临床试验结果也可以发现,当疾病进展过深,达到ca-tau-strophe阶段后,单独使用抗Aβ治疗可能效果已经不行了。
简单概括过去或失败或成功的临床经验,一旦患者进展超过轻度痴呆,那么去除淀粉样蛋白几乎没有临床效果。这提示我们,治疗在出现症状之前就开始应当是更好的选择。
API、DIAN-TU和A4等预防试验,很遗憾,没有一项拿到实质性的临床获益(不过它们使用的单抗在3期也都很失败就是了)。有趣的对比来自lecanemab、donanemab和gantenerumab。由于gantenerumab ARIA的发病风险较高,需要逐步调整剂量,所以实际上受试者要晚几个月才接受到潜在的有效剂量,这或许是gantenerumab达到相似的Aβ去除效果,认知改善却不如前两者的原因。
那么tau蛋白是否能够成为指示干预时机的指标呢?
在donanemab的试验中,内侧颞叶tau PET被定为纳入标准之一,而试验结果也显示低/中tau组临床效果要明显好于高tau组,但是不同tau水平组的临床疾病程度几乎相同。有研究者认为,女性AD风险更高可能与tau代谢的遗传差异有关,散发性早发性AD患者具有更严重的tau病理和更快的tau沉积速度,tau病理学还有很多未解之谜。
此外,作为疗效的生物标志物,tau PET目前在临床试验中的使用还不多,结论也并不一致。
PET的应用难点还在于其高昂的价格和对设备的要求。解决这个问题的或许是血液活检,例如p-tau 181和p-tau 217,这二者对抗Aβ疗法非常敏感,血浆浓度在治疗开始后6-12个月大幅度降低并达到稳定,且与PET结果保持一致。这也支持了Aβ和tau病理之间的紧密联系。
非淀粉样蛋白治疗靶点
tau蛋白就是仅次于Aβ的重要治疗靶点,理论上甚至比Aβ更好,因为tau沉积与AD症状密切相关,tau分布能够准确反应症状的严重程度和类型——tau蛋白假说认为,tau蛋白异常是引发临床症状所必需的。
第一代抗tau单抗靶向tau蛋白N端,尽管有证据表明在脑脊液中单抗与tau蛋白的结合,但是未见tau PET变化,也未能带来临床益处。这可能是因为靶向的tau片段并不致病。
第二代抗tau单抗和疫苗靶向MTBR和C端区域,目前已经进入临床试验。多种改变tau翻译后修饰的方法也正在临床经历考验,近期一项研究中反义核苷酸(ASO)能够实现长期安全地降低CSF tau水平。
如果减少tau蛋白能给AD患者带来有实质意义的改善,那么将是AD新药研发史上的另一座里程碑。不过还有一种可能就是减少tau对治疗AD没有意义,彼时我们需要重新审视tau蛋白假说。
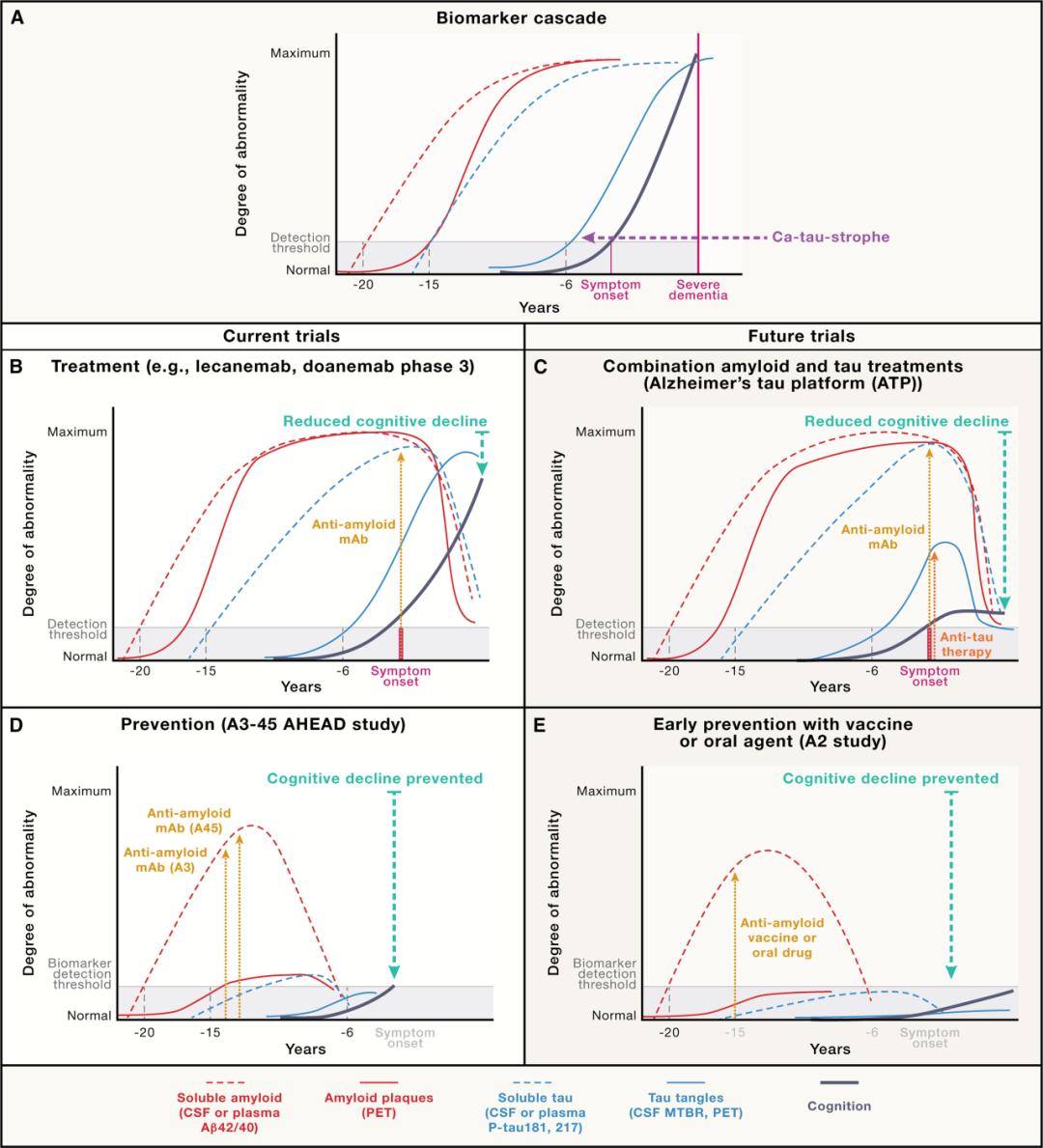
在不同疾病阶段和治疗阶段的生物标志物变化
大多数临床上的AD病例不仅存在ATN病理,还常伴有各种血管疾病、TDP-43和α-突触核蛋白病理,有研究证据表明这些共病理可能有助于AD进展并影响临床症状。在lecanemab和donanemab的试验中也有部分受试者病理减少程度与疾病进展程度不匹配的情况。
针对更普遍的蛋白质降解或清除机制的方法可能通过同时影响多种蛋白质带来整体的益处。对罕见突变携带者的研究也可能带来针对AD相关免疫和溶酶体功能障碍的新疗法。
新的临床试验设计
目前的AD标准3期临床安慰剂对照研究中,受试者以1:1分配治疗或安慰剂。依照2022年的一项分析,此类试验平均需要耗时4.4年,674名参与者,并耗资3.7亿美元。在已有药物获批的情况下,或许还需要新药与现有药物的头对头比较或联合治疗。乐观估计,2022年时已经进入2期临床的31种药物中,有50%可以进入3期,那么它们的评估成本将以数十年、数千名参与者和数十亿美元计算。
新的临床研究设计或将很好地解决这些问题。例如伞式试验,可以同时测试多种疗法,节约时间并降低成本,试验中实质接受了治疗的参与者比例也更高。DIAN-TU采用的就是伞式试验设计,lecanemab与tau单抗E2814也将采用伞式试验。
篮子试验在肿瘤领域大获成功,但相较肿瘤,神经退行性疾病的可用生物标志物还不足。有研究尝试以tau病理为突破口,但是结果显示原发性和继发性tau病的安全性和耐受性差异很大,这可能意味着不同tau病的潜在生物学差异。
总而言之,在最近的几年中,AD新药领域取得了令人期盼已久的可喜突破,与之前的丰富失败经验一同,它们为研发者打开了下一步的大门。
参考资料:
[1]https://www.cell.com/cell/fulltext/S0092-8674(23)01077-2


本文作者丨代丝雨
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




