- +1
【学术前沿】Sci Immuno丨董晨团队揭示抗肿瘤CD8+ T细胞功能调控新机制
在肿瘤的发生发展过程中,抗原特异性CD8+ T细胞会首先在引流淋巴结(Tumor-draining lymph nodes, TDLNs)中被持续性的肿瘤抗原所激活并分化成为干细胞样耗竭型T细胞(Stem-like/Progenitor exhausted T cells, Tprog cells),进而迁移到肿瘤微环境中,并大量发育成为终末分化的耗竭型T细胞(Terminally differentiated exhausted T cells, Tterm cells)。Tprog细胞被认为是响应PD-1阻断剂药物的主要细胞。然而, 这一个过程中的细胞外信号和细胞内转录调控机制仍缺乏系统和深入的研究。
2023年10月20日,董晨团队在Science Immunology杂志在线发表了题为 BCL6 promotes a stem-like CD8+ T cell program in cancer via antagonizing BLIMP1 的研究论文。该研究详细阐述了TGF-β-BCL6和IL-2-BLIMP1信号通路拮抗调控抗肿瘤CD8+ T细胞分化的重要作用和分子机制。

2009年,董晨院士团队报道BCL6是调控TFH细胞发育的谱系转录因子,由此TFH细胞被鉴定为特异性的CD4+ T细胞亚群。同时,BCL6也是调控生发中心B细胞分化以及生发中心反应的关键转录因子。在病毒感染模型中, BCL6对于记忆型CD8+ T细胞和滤泡杀伤性CD8+ T细胞的发育十分重要。然而,在CD8+ T细胞中,BCL6的表达、功能和调控机制仍缺乏研究。
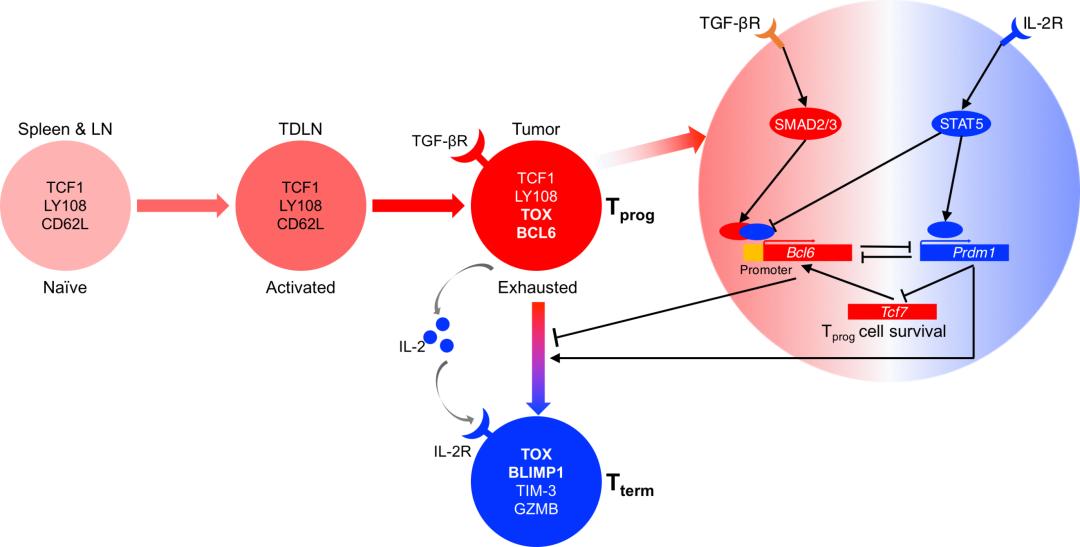
在本研究中,研究人员通过分析癌症病人的单细胞转录组测序数据,发现BCL6在肿瘤浸润的CD8+ Tprog细胞中高表达。然后,研究人员进一步验证,在小鼠E.G7和B16-OVA肿瘤模型中,BCL6同样特异性地高表达在TDLN和肿瘤浸润的CD8+ Tprog细胞中。此外,在肿瘤发生阶段的TDLN中,BCL6不表达在幼稚型和激活的CD8+ T细胞中;而当肿瘤进展到第9天,BCL6的表达被显著诱导在耗竭的TOX+TCF1+ CD8+ Tprog细胞中。同时,随着肿瘤微环境的形成,Tprog细胞迁移至肿瘤中并进一步分化成为TOX+TCF1-BCL6- CD8+ Tterm细胞。因此,BCL6的表达标志着肿瘤特异性Tprog细胞的形成。此外,利用谱系追踪系统,研究人员验证,在肿瘤的发展过程中,肿瘤浸润的BCL6+ Tprog细胞能够持续分化成为Tterm细胞,并是维持肿瘤浸润CD8+ T细胞数量的关键T细胞亚群。
接下来,研究人员进一步探究BCL6的功能。研究人员将幼稚型WT和BCL6缺失的OT-I细胞过继输送至E.G7荷瘤受体小鼠体内,发现BCL6的缺失显著增强OT-I细胞对E.G7肿瘤生长的控制效果。分析结果显示,在第16天,BCL6的缺失导致Tterm细胞的比例显著升高,并导致肿瘤浸润OT-I细胞的数量显著增加,尤其是Tterm细胞的数量,而Tprog细胞的数量没有显著变化。进一步地,研究人员将WT和BCL6缺失的肿瘤浸润OT-I细胞过继输送至第二个E.G7荷瘤受体小鼠体内,发现BCL6的缺失显著损害OT-I细胞对肿瘤生长的持续控制能力,并导致TDLN和肿瘤浸润的OT-I细胞的数量显著减少,Tprog细胞亚群近乎消失。这说明,BCL6对于CD8+ T细胞的长期抗肿瘤能力十分重要,并在Tprog细胞的长期维持而不是产生中不可或缺。接下来,为了探究BCL6在Tprog细胞应对二次肿瘤挑战中的作用,研究人员将TDLN中的WT和BCL6缺失的Tprog细胞过继输送至第二个E.G7荷瘤受体小鼠中,发现BCL6的缺失显著损害Tprog细胞的抗肿瘤效果,并导致肿瘤浸润OT-I细胞的数量显著降低,Tprog细胞的比例显著降低。这说明BCL6对于Tprog细胞应对长期肿瘤挑战十分重要。同时,BCL6对于肿瘤特异性Tprog细胞的维持主要发生于肿瘤微环境中,而对TDLN中Tprog细胞的产生和维持无显著调控作用。
研究人员进一步探究在CD8+ T细胞中诱导BCL6表达的上游信号。体外筛选结果显示,TGF-β和IL-2的中和抗体能够显著诱导BCL6在CD8+ T细胞的表达。进一步的结果显示,Tgfbr2的缺失导致TGF-β无法诱导BCL6在体外培养的CD8+ T细胞中的表达。相一致的是在E.G7小鼠肿瘤模型中,Tgfbr2的缺失导致肿瘤浸润的TCF1+BCL6+ Tprog细胞的比例显著降低。此外,随着E.G7肿瘤进展到第24天,Tgfbr2的缺失导致TCF1+BCL6+ Tprog细胞亚群近乎消失。这说明TGF-β是维持肿瘤模型中BCL6表达和Tprog细胞亚群的关键细胞因子。另外,在E.G7肿瘤进展到16天,Tgfbr2的缺失导致肿瘤浸润OT-I细胞的数量显著增多;而在第24天,OT-I细胞的数量则显著减少。这说明了TGF-β双面性的调控作用:虽然它显著抑制CD8+ T细胞的增殖,但是它在其长期生存中不可或缺。接下来,研究人员进一步探究TGF-β调控BCL6表达的分子机制。ChIP-seq和ChIP-qPCR结果显示,TGF-β的下游分子SMAD2显著结合在Bcl6基因的启动子区域。同时,体外实验结果显示,SMAD2的缺失显著减弱TGF-β对BCL6表达的诱导能力。综上研究成果说明TGF-β-SMAD2信号通路可能直接转录诱导BCL6在CD8+ T细胞中的表达。
体外结果显示,在IL-2受体CD25缺失的CD8+ T细胞中,BCL6的表达显著升高。一致地,在E.G7肿瘤模型中,CD25的缺失导致肿瘤浸润OT-I细胞几乎全部维持为TCF1+BCL6+ Tprog细胞,而无法分化成为TCF1-TIM-3+ Tterm细胞。同时,肿瘤浸润OT-I细胞的数量,尤其是Tterm细胞的数量显著降低,说明IL-2是Tterm细胞发育的关键细胞因子。在机制上,ChIP-seq和ChIP-qPCR结果显示,IL-2的下游分子STAT5显著结合到Bcl6基因的启动子区域。同时,体外实验结果显示,阻断STAT5的功能能够显著诱导BCL6在CD8+ T细胞中的表达。这说明,IL-2-STAT5信号通路可能直接转录抑制BCL6在CD8+ T细胞中的表达。此外,ChIP-qPCR结果显示,IL-2和TGF-β分别显著减弱SMAD2和STAT5在Bcl6的同一启动子位点的结合,说明SMAD2和STAT5可能通过竞争性结合到该位点拮抗性地调控BCL6的表达。
接下来,研究人员对BCL6的作用机制进行了探索。通过整合Bcl6过表达的RNA-seq数据和BCL6在CD8+ T细胞中的ChIP-seq数据发现,BCL6直接转录诱导一系列Tprog特征基因的表达,并转录抑制一系列Tterm特征基因的表达。然后,研究人员进一步比较BCL6和TCF1在Tprog细胞中的功能。体内实验结果显示,Bcl6和Tcf7过表达均显著提高肿瘤浸润Tprog细胞的比例。然而,Bcl6的过表达显著抑制T细胞的增殖,导致肿瘤浸润CD8+ T细胞的数量显著减少,其中Tprog和Tterm细胞的数量均显著减少;Tcf7的过表达则不影响T细胞的增殖和它的数量,导致Tprog细胞的数量显著增加,而Tterm细胞的数量显著减少。进一步地,研究人员发现,在TCF1缺失的条件下,Bcl6的过表达仍能够显著增加Tprog细胞的比例;而在BCL6缺失的条件下,Tcf7的过表达则无法改变Tprog细胞的比例,但仍能显著增加CD8+ T细胞的数量。此外,ChIP-seq结果显示,BCL6和TCF1具有不同的DNA结合谱。同时,TCF1显著结合到Bcl6的基因位点,而反之则不。这说明,BCL6是TCF1的下游分子,二者具有非冗余的调控功能:BCL6特异性抑制Tprog细胞向Tterm细胞的分化,同时显著抑制T细胞的增殖;而TCF1则特异性调控T细胞的生存能力。
在B细胞和CD4+ T细胞中,BLIMP1是拮抗BCL6的关键转录因子。因此,研究人员进一步探究BLIMP1在肿瘤特异性CD8+ T细胞中的作用。ChIP-seq结果显示,BCL6和BLIMP1具有不同的DNA结合谱。RNA-seq数据显示,Bcl6和Prdm1的过表达诱导产生负相关的CD8+ T细胞转录组特征。同时,分析结果显示,BLIMP1直接转录抑制一系列Tprog特征基因的表达,并直接转录诱导一系列Tterm特征基因的表达。另外,体外实验结果表明,BLIMP1通过响应IL-2信号显著诱导TIM-3+ Tterm细胞的分化。一致地,Prdm1缺失和过表达的体内实验结果表明,BLIMP1是促进肿瘤浸润Tprog细胞分化成为Tterm细胞的关键转录因子。另外,Bcl6和Prdm1单独过表达和双过表达的实验结果进一步显示,BCL6和BLIMP1互逆调控Tprog/Tterm特征基因的转录,进而拮抗调控Tprog向Tterm细胞分化的过程。
由于Bcl6的过表达或者Prdm1的缺失产生更高比例的Tprog细胞亚群,研究人员进一步探究,它们能否和PD-L1/PD-1阻断疗法产生协同性的抗肿瘤效果。分析结果显示,Bcl6的过表达显著损害OT-I细胞的抗肿瘤能力,并无法和anti-PD1联用产生更有效的肿瘤控制效果。同时,流式数据显示,anti-PD1无法有效促进Bcl6过表达的Tprog细胞的扩增和分化。不同的是,Prdm1缺失的OT-I细胞的过继输送和anti-PD1产生最佳的抗肿瘤效果,显著优于anti-PD1单独处理组。流式数据显示,anti-PD1能够显著诱导肿瘤浸润的Prdm1缺失的Tprog细胞的扩增和分化。
综上所述,该研究鉴定并解析了TGF-β-BCL6和IL-2-BLIMP1信号通路在肿瘤特异性CD8+ T细胞分化中的关键调控作用,为开发新型的抗肿瘤T细胞过继疗法、细胞因子疗法和免疫检查点阻断联合疗法提供了重要的理论基础。同期Science Immunology发布了专项评论:BCL6 fine-tunes long-term tumor control。董晨团队的论文对BCL6上下游的全面详实的研究,指出了BCL6是CD8+ T祖细胞的守门员,保证其干细胞特性,支持长期肿瘤控制。
清华大学医学院基础医学系直博生孙勤利为该论文的第一作者,上海免疫治疗创新研究院和西湖大学董晨院士为本文的通讯作者,其他参与人员包括清华大学免疫研究所和上海市免疫治疗创新研究院的实验室成员。
原文链接:
http://doi.org/10.1126/sciimmunol.adh1306
原标题:《【学术前沿】Sci Immuno丨董晨团队揭示抗肿瘤CD8+ T细胞功能调控新机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




