- +1
【学术前沿】Nature重磅综述 | 从机制到干预:内皮细胞衰老的深度解析
翻译 by 尹剑,马米阳,张彬,陆晓雍,方帅淇,张添翔
俗话说,“人老先从血管老”,内皮细胞作为血管的重要组成部分之一,是人体血管健康的基石。基石不稳,大厦将倾,内皮细胞的衰老无疑是导致血管衰老的一个重要因素,也是衰老研究中的一大热点。近日,美国犹他大学的Anthony J. Donato教授在Nature Reviews Cardiology发表了题为“Mechanisms and consequences of endothelial cell senescence”的综述,讨论了内皮细胞衰老的诱发机制和相关疾病,并指出了未来研究中急需解决的问题。
摘要
内皮细胞定位于循环血液和半实体组织之间的重要界面中,在维持全身生理功能中起着重要作用。血管内皮特别容易受到病原体刺激,激活肿瘤抑制通路从而导致细胞衰老。众所周知,衰老的内皮细胞是非常活跃的,表现出高度的分泌性和促炎性,并且具有异常的形态。此外,内皮细胞衰老已被确定为各种心血管和代谢疾病的重要诱发因素。在这篇综述中,作者讨论了内皮细胞暴露于损伤性刺激(血液流动产生的压力、循环和内皮衍生因子)的后果以及诱导内皮细胞衰老的细胞和分子机制。作者还讨论了内皮细胞衰老如何引起动脉功能障碍,并在临床上诱发心血管疾病和代谢紊乱。最后,作者总结了清除内皮衰老内皮细胞的疗法(senolysis)有效性的最新证据,并确定了未来研究中亟待解决的重要问题。
关键要点
• 构成血管内膜的内皮细胞暴露在一个独特的损伤性刺激环境中,这些损伤性刺激包括血液流动产生的压力,以及循环和内皮衍生因子。
• 内皮细胞暴露于损伤性刺激导致其端粒和非端粒DNA损伤,线粒体功能障碍以及能量传感器通路的改变。
• 损伤性刺激引起的变化导致肿瘤抑制通路例如p53-p21和pRb-p16的激活,从而导致细胞增殖停滞和衰老。
• 衰老的内皮细胞在形态上变大变平,对剪切应力的变化不再敏感;与此同时,它们代谢更加活跃,并分泌多种炎症分子。
• 衰老的内皮细胞及其分泌的各类因子是动脉功能障碍和各种心脏代谢疾病的病理生理过程的主要诱发因素。
• 新的证据表明,靶向衰老内皮细胞的治疗方法可能是抑制心脏代谢疾病的有效策略。
前言
内皮是排列在血管网络上高度动态的单层细胞。内皮细胞通过影响血管发生过程调控血管的形成。内皮细胞帮助血液处于流动状态,并通过产生血管活性化合物调控血管张力,进而维持血压,预防直立性低血压。此外,内皮具有选择渗透性,可以介导大分子和免疫细胞从血液中转运。
由于内皮细胞持续暴露于许多循环因子和致病性刺激下,因此极易受到损伤,引起血液流动功能和屏障功能失调,进而导致组织和器官功能受损。此外,内皮细胞衍生的促炎细胞因子和趋化因子会将损伤信号传递给其他血管细胞和非血管组织和器官。内皮损伤的后果之一是细胞衰老,即在多种应激因素的作用下产生的永久性细胞周期停滞状态,防止受损细胞的无限增殖和肿瘤发生。然而,细胞衰老也可能是有害的。越来越多的研究表明,内皮细胞损伤可导致衰老和各种疾病的发生。
几条证据链为研究内皮细胞的衰老提供了线索。血管结构的特点以及内皮细胞更新的速度,很可能使这些细胞更容易衰老。富含内皮细胞的组织被认为是衰老细胞最多的组织,同时内皮细胞是最早被发现随着年龄增长而衰老的细胞类型。在体内,内皮细胞衰老发生于多种组织的血管床,包括肾脏、视网膜、肝脏、大脑和主动脉等,这表明内皮细胞衰老参与了多种与血管功能障碍相关的病理过程。能够选择性清除衰老细胞的模型,以及能够选择性杀伤衰老细胞的药物(senolytics),为证明衰老内皮细胞是一个可行的治疗靶点提供了额外的证据。因此,内皮细胞的衰老已成为一个研究热点。
内皮细胞的衰老会导致内皮依赖性舒张(endothelium-dependent dilatation,EDD)、血管生成以及血管-组织间的屏障功能受损。此外,许多研究已经确定了内皮细胞衰老在动脉粥样硬化、心力衰竭、肺动脉高压和代谢功能障碍中的作用。因此,了解内皮细胞衰老在这些疾病中的作用,可能会促进心脏代谢性疾病治疗方法的发展。
本综述详细讨论了内皮细胞衰老领域的研究进展,包括衰老内皮细胞的表型和促进衰老或延缓衰老的分子机制;讨论了衰老内皮细胞数量增加的后果,以及它们对动脉功能障碍和心脏代谢疾病的影响;最后还总结了关于清除衰老内皮细胞疗法的研究进展。
衰老内皮细胞的表型
在衰老诱导因素的刺激下,有两条主要的肿瘤抑制途径会被激活。这些途径包括细胞肿瘤抗原p53-细胞周期蛋白依赖性激酶抑制剂1A(CDKN1A;也称为p21)和视网膜母细胞瘤相关蛋白pRb-CDKN2A(也称为p16)。p21和p16会使细胞进入衰老状态,因此它们也通常被用作衰老的标志物。p21和p16的激活会根据细胞类型和刺激因素有所不同。然而,在某些类型的细胞中会观察到p21阳性和p16阳性的衰老细胞之间明显趋同,即损伤导致p21水平的早期升高,但随着时间的推移,p21水平下降,而p16水平随之上升。尽管p21和p16在体内的表达规律仍然难以捉摸,但来自小鼠模型的证据表明,p21或p16高水平的细胞形成了不同的亚群。损伤的严重程度、持续时间和类型决定了细胞的分子反应和细胞的命运。例如,轻微的损伤会影响p53的稳定,损伤修复前p21会进行转录,损伤修复后细胞重新进入细胞周期。然而,p21的延迟激活以及严重、持续的损伤,会导致衰老,这通常与p16的表达增加有关。除了衰老,当更强的刺激因素出现时p53会诱导细胞凋亡。在健康个体中,衰老和凋亡都会清除受损细胞。然而,在病理或高龄状态下,由于过度损伤或免疫功能障碍(免疫衰老),衰老和清除之间的平衡被破坏,会导致衰老细胞的积累。
除了p21和p16外,衰老细胞也可以通过溶酶体衰老相关β-半乳糖苷酶的活性升高来识别。此外,在过去的两年中已经确定了其他的衰老标志(例如,溶酶体和增殖特征以及衰老相关基因的表达),在具体研究中应该尽可能使用两个或两个以上标志来准确地识别衰老细胞。
衰老细胞具有很强的活性,以异质性的衰老相关的分泌表型(senescence-associated secretory phenotype,SASP)为特征,这种异质性由细胞类型和衰老机制决定。典型的SASP因子包含了衰老细胞分泌的炎症趋化因子、细胞因子、生长因子,以及衰老细胞分泌的活性氧(reactive oxygen species,ROS)。在内皮细胞的衰老过程中,其会产生一种独特的形态和分泌表型——衰老的内皮细胞是扁平的、增大的,且细胞表型不易受剪切应力的影响而变化。在机制上,衰老的内皮细胞增加了与基底膜的粘附,使得自身排列不利于血液流动(图1)。增加粘附功能的后果是,细胞可以在很长一段时间抵抗剥脱。此外,这些细胞无法适应血液的流动,可能导致衰老内皮细胞中一氧化氮(nitric oxide,NO)水平的降低和炎症信号通路的激活。
有趣的是,内皮细胞的SASP反映了年龄相关的变化,这是动脉功能障碍的重要因素,但最初并未归因于衰老。有证据表明,内皮细胞衰老导致炎症细胞因子和ROS的表达升高,类似于典型的SASP。因此,衰老内皮细胞比例的增加可能导致炎症和氧化应激,通过分泌SASP因子,损害内皮功能,产生动脉硬化。虽然衰老内皮细胞中ROS的来源尚未完全阐明,但有证据表明线粒体功能障碍是一个潜在的来源。例如,与非衰老细胞相比,衰老细胞的线粒体呼吸受损,线粒体过氧化物的产生增加。相反,靶向线粒体ROS可以减少过氧化氢诱导的衰老。促炎转录因子NF-κB(nuclear factor-κB)与内皮功能受损相关,可能参与了内皮细胞的SASP。例如,慢性暴露于炎症因子TNF(tumour necrosis factor)会导致过早衰老,其特征是NF-κB活性和ROS产生升高。在这种情况下,抑制NF-κB或用抗氧化剂处理细胞可以延缓衰老并抑制SASP的分泌。衰老的内皮细胞也会产生许多炎症趋化因子和细胞因子,包括白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8),CXC-趋化因子配体11(CXC-chemokine ligand 11,CXCL11)和纤溶酶原激活物抑制剂1(plasminogen activator inhibitor 1,PAI1),并降低抗炎细胞因子白细胞介素-10(IL-10)的表达,以及增加多种细胞粘附分子的表达。尽管观察到内皮细胞的SASP具有促炎作用,但一些研究也证明了内皮细胞的衰老具有相反的抗炎作用,这说明需要在体内和体外对这一现象进行更多的探索。
血管重塑会降低动脉弹性,导致动脉硬化,促进心血管疾病(cardiovascular diseases, CVDs)的发生。衰老的内皮细胞使动脉重塑相关的通路上调,如转化生长因子-β和基质金属蛋白酶通路,这可能促进了动脉硬化。事实上,在具有内皮细胞DNA修复缺陷的年轻小鼠中,内皮细胞中p21的表达增加,导致了主动脉的重塑和硬化,从而重现了内皮衰老的特征。
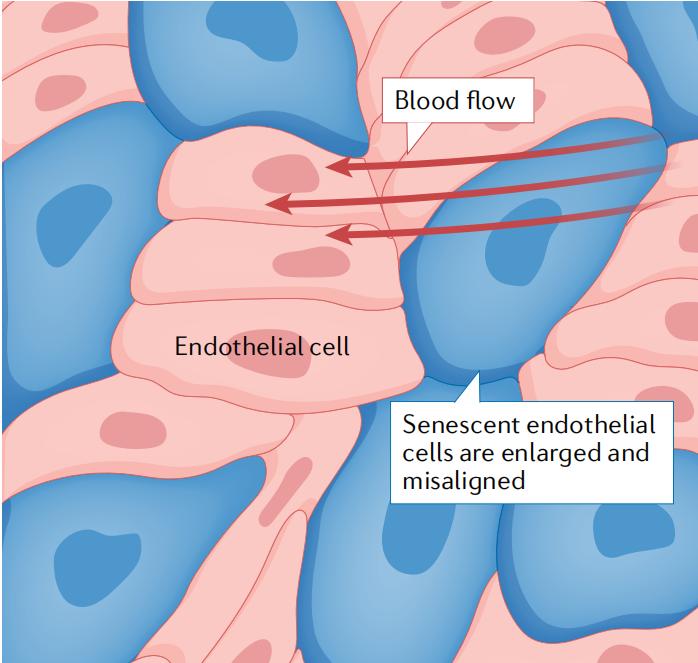
图1 | 衰老内皮细胞的形态学变化。衰老内皮细胞(蓝色)增大,与基底膜的粘附增加,从而阻碍它们对血流剪切应力的调整。
来自内皮细胞和其他细胞类型的证据表明,衰老细胞分泌的SASP因子可以诱导邻近细胞的衰老。内皮细胞产生的SASP或许不足以驱动如血管平滑肌细胞(vascular smooth muscle cells,VSMCs)等邻近细胞的衰老,但NO在动脉重塑相关的通路中减少,衰老内皮细胞中炎症性SASP因子和ROS的产生升高,这些都可能对动脉和外周组织中的其他细胞产生广泛的有害影响。
内皮衰老的起源
由于其解剖位置较为特殊,内皮细胞不断暴露于流动的血液中,血液中含有许多可能引起衰老的物质,包括氧气、葡萄糖、脂质、氨基酸代谢产物、免疫细胞、ROS和炎性细胞因子(图2)。另外血液流动产生的压力,如剪切应力、高压或脉压,也会导致衰老。暴露于血流干扰下的区域,其内皮细胞的更新循环较快,因此这些细胞会受到有害的血流动力学以及复制应激的影响。在不受血流干扰的区域,内皮细胞有较长的寿命,推测有些细胞能存活长达平均人类寿命的80%。然而,长寿命的细胞也会由于长时间暴露于血液中的有害物质下而积累损伤。因此,无论是短寿命还是长寿命的内皮细胞都会因为暴露于多种刺激下而衰老。以下部分将讨论导致内皮衰老的各种环境因素。
血流动力学环境 内皮细胞在血管树中的位置决定了其所处的血流动力学环境。在大动脉中,内皮细胞暴露于高血压和脉动剪切应力下,这两者都可能造成损伤。位于血管分支口或弯曲处(如颈动脉窦和主动脉弓)的内皮细胞受到较低且振荡的剪切应力作用,这对细胞有害并会导致与SASP相似的表型。相比之下,位于远离体内的颈内动脉或胸降主动脉中的内皮细胞暴露于较高的层流剪切应力环境下,对其有益。
血流动力环境的重要性通过细胞培养和小鼠动脉的研究得到了验证:暴露于紊流的内皮细胞显示出高细胞周转率,导致复制性衰老。此外,来自人体组织样本的证据表明,在靠近动脉分支口的内皮细胞中,细胞周转率和复制性衰老程度要比在受血流动力学应激较小的动脉内皮细胞、静脉内皮细胞和平滑肌细胞中更高。内皮细胞受到有害血流动力环境的影响,可以解释振荡剪切应力部位动脉粥样硬化的负担增加的现象。人类动脉粥样硬化斑块中衰老内皮细胞丰度大于健康血管中的证据可以支持这一观点。
氧气和代谢产物 在静息和缺氧状态下,血液中的氧分压在动脉中约为100毫米汞柱,在静脉中约为40毫米汞柱。相比之下,脾脏中的间质氧分压约为66毫米汞柱,骨骼肌中约为34毫米汞柱,心脏、肝脏和肾脏中约为25毫米汞柱。在代谢需求增加的情况下,如运动时,动脉血液和周围组织之间的氧分压梯度会大大增加,使得周围组织的细胞内氧分压低至3毫米汞柱。长时间暴露在高氧分压环境中已被广泛认为是促进细胞衰老的因素。因此,位于动脉血管的内皮细胞持续面临一种促进衰老的刺激,而其他细胞在体内并不经历,这可能解释了内皮细胞早发性衰老的现象。同时,还需要考虑到大多数细胞培养实验是在超生理氧条件下进行的,并且相比人类细胞,小鼠细胞对氧化性DNA损伤诱导衰老的敏感性更高。
内皮细胞始终暴露于营养物质、代谢产物和激素(如葡萄糖、脂质、氨基酸和胰岛素)中,而这些溶质的浓度在进食后会增加。同样,肥胖和糖尿病等病理状态以及年龄增长,会导致循环中胰岛素、葡萄糖、甘油三酯、胆固醇和氨基酸的水平升高,这可能会导致内皮细胞衰老。事实上,将内皮细胞培养在高胰岛素水平下会导致早发性衰老和增殖能力减弱。在机制上,胰岛素激活RACα丝氨酸/苏氨酸蛋白激酶(AKT1)信号通路,抑制叉头框家族蛋白O3a(Forkhead box protein O3,FOXO3A),导致锰超氧化物歧化酶活性减少,进而产生过氧化物。多项研究表明,无论在体内还是在体外条件下,葡萄糖都会促进内皮细胞衰老和SASP产生。将内皮细胞培养在高葡萄糖水平下抑制了sirtuins蛋白家族(SIRTs)和组蛋白乙酰化酶的表达,以及叉头框家族蛋白O1 (Forkhead box protein O1,FOXO1)的活性,导致氧化应激。增加的过氧化物减少了NO的生物利用度,诱导DNA损伤并激活p53-p21信号通路,导致增殖停滞和细胞衰老。也有证据表明高葡萄糖水平会降低端粒酶活性、端粒长度和内皮一氧化氮合酶(eNOS)的磷酸化,从而使NO的产生减少,这都会导致内皮细胞衰老。
多种证据表明氨基酸代谢产物和脂质也能够在体外和非人类灵长类动物体内诱导内皮细胞衰老。甲硫氨酸代谢产生的同型半胱氨酸会加速细胞衰老的进程。在体外培养的人脐静脉内皮细胞中,使用同型半胱氨酸长期处理会导致衰老标记物的表达上调,而由于端粒酶逆转录酶脱甲基化,会导致端粒缩短(下文会详细讨论)。在小鼠模型中,高甲硫氨酸摄入的饮食会增加血清同型半胱氨酸水平,并诱发血管老化的多个特征,包括动脉衰老。有趣的是,减少甲硫氨酸的摄入是少数已被证明可以延长生物寿命的干预措施之一,部分原因可能是其延缓了内皮细胞衰老的发生。循环脂质与内皮细胞之间的相互作用对于理解细胞衰老如何促进疾病的发生非常重要。动脉粥样硬化是由于内皮功能障碍,导致脂质在内皮屏障下沉积所引起的。而由于结合蛋白的表达减少和屏障功能受损,内皮细胞的衰老可能会进一步促进脂质沉积。这些发现表明,由于生理功能障碍和病理状态引起的胰岛素、葡萄糖、氨基酸和脂质水平升高,会导致内皮细胞衰老,反过来内皮细胞的衰老又推动了疾病的发生发展。
血管扩张剂和血管收缩剂 内皮细胞产生大量的血管舒张物质和血管收缩物质,并具有对非内皮来源的血管活性物质的受体。值得注意的是,内皮细胞产生强效的血管舒张分子NO,该分子通过扩散到血管平滑肌细胞引起血管舒张,降低内皮细胞粘附分子的表达,改善屏障功能,防止凝血,具有普遍的血管保护作用。此外,有证据表明,NO可能是预防细胞衰老的主要血管舒张物质。血管舒缓激肽是一种活性肽,通过增加NO和其他内皮源放松因子的产生而促进血管舒张。重要的是,通过药物抑制NO生成破坏了血管舒缓激肽对衰老的延缓作用。这一发现得到了来自细胞培养研究的证明,在细胞培养的体系下,eNOS的抑制诱导了细胞衰老。衰老的内皮细胞中NO的生成受到了损害,而缺乏NO进一步导致了内皮的衰老,减少了NO的生物利用度。NO生物利用度的减少是动脉衰老的标志,促进了许多疾病的进展。
其他与内皮细胞衰老有关的血管收缩物质包括内皮素1 (endothelin 1)和血管紧张素II (angiotensin II)。血管紧张素II受体拮抗剂缬沙坦(Valsartan)可以减轻由血管紧张素II诱导的衰老,这表明这种收缩血管物质的效应是通过I型血管紧张素II受体介导的。有趣的是,内皮细胞的重复传代(一种衰老的细胞培养模型)增加了其对血管紧张素II诱导的衰老的敏感性。综上所述,这些研究结果提示了一种前馈机制,即血管扩张剂和血管收缩剂共同调节内皮细胞衰老,从而导致NO生物利用度的改变和生理功能障碍。
炎症和氧化应激 包括免疫细胞、内皮细胞以及其他组织和外源性产生的循环因子在内的炎症和氧化应激都会导致内皮功能障碍,部分原因可能是细胞衰老。支持这一概念的证据表明,暴露于肿瘤坏死因子(tumor necrosis factor,TNF)的内皮细胞会过早发生复制性衰老,并使细胞因子、趋化因子和粘附分子(如细胞间粘附分子1 (intercellular adhesion molecule 1,ICAM1)和血管细胞黏附蛋白1(vascular cell adhesion protein 1,VCAM1))的表达增加。TNF诱导的过早衰老和随之产生的炎症环境可以通过抗氧化剂的给药或NF-κB的抑制来缓解。同样的,用抗氧化剂联合酶促NO生成的辅因子处理内皮细胞可部分预防葡萄糖诱导的衰老。从机理上讲,ROS和炎症因子可能通过DNA损伤和激活DNA损伤响应途径促使内皮细胞衰老。衰老的内皮细胞可作为炎症因子和ROS的来源,并以正反馈方式诱导周围健康细胞的衰老,从而传播和持久化炎症微环境。总的来说,这些证据表明炎症、氧化应激和内皮细胞衰老之间存在复杂的相互作用。
医源性衰老 导致细胞衰老的医疗治疗称为医源性衰老。值得注意的是,内皮功能障碍和心血管疾病往往是由癌症治疗引起的,其中的部分原因可能是内皮细胞衰老所致。这个观点得到了多种化疗药物在体外培养中诱导内皮衰老的观察结果的支持,并且这些药物是通过静脉直接与内皮细胞发生作用的。与药物诱导内皮细胞衰老一致的是,用化疗药物多柔比星处理小鼠会导致EDD受损,这是由于线粒体ROS增加和主动脉SASP因子IL-1β和IL-6表达增加。此外,多柔比星治疗后清除衰老细胞可以改善EDD,这表明化疗药物与内皮细胞衰老之间存在直接联系。另一种化疗药物即血管内皮生长因子抑制剂阿昔替尼,也已显示可以通过ROS在人脐静脉内皮细胞中诱导内皮细胞衰老。
化疗对心血管系统的影响通常在治疗后10年以上才会出现,这支持了衰老内皮细胞积累导致心血管疾病的观点。化疗引起的内皮细胞衰老的另一个后果是SASP因子的产生,这又会促进肿瘤生长。因此,使用senolytics靶向清除衰老的内皮细胞可能是一种预防癌症进展和减少化疗相关心血管疾病风险的有效策略。目前一项正在进行的临床试验评估了Senolytics在儿童癌症幸存者中的作用。尽管这样试验的主要结果是Senolytics的应用与内皮功能或心血管疾病的发展无关,但如果在这项测试中senolytics被证实是安全的,那么今后进行关于senolytics使用前后内皮功能的研究以及心血管疾病发病率的长期研究将具有重要的意义和价值。
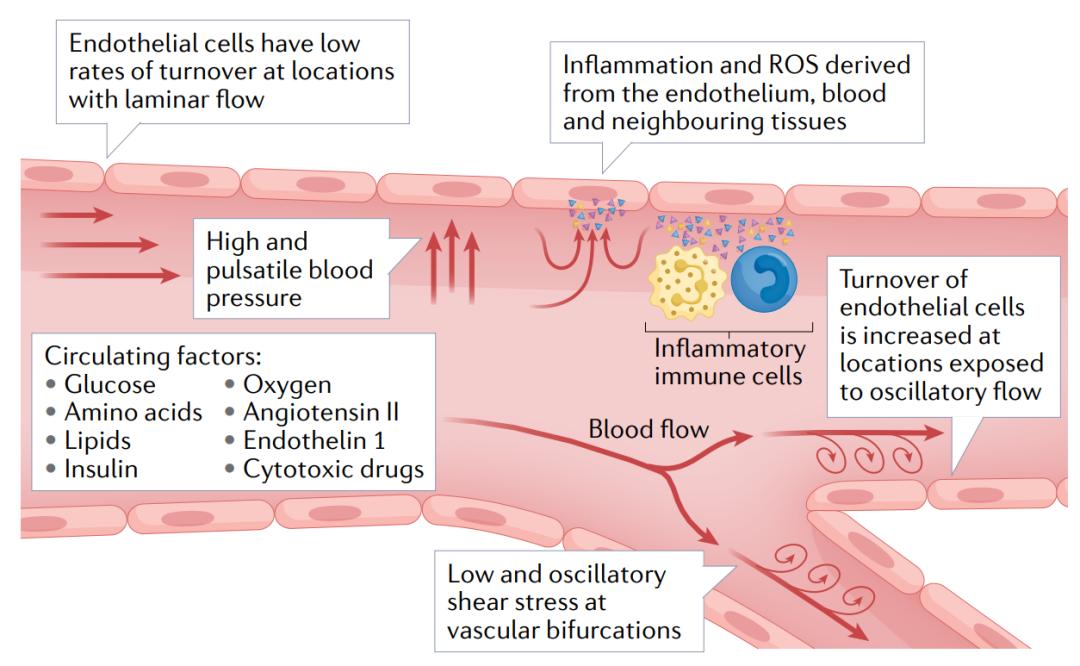
图2 | 暴露于循环和内源性刺激下的内皮细胞。由于其解剖位置的特殊原因,内皮细胞不断暴露于循环生化因子和血液流动压力的作用下。这些因子包括氧气、营养物质(如葡萄糖、氨基酸和脂质)、激素(如胰岛素、血管紧张素II和内皮素1)以及细胞毒性药物(如化疗药物)。血液流动压力包括血管分支口或弯曲处的振荡剪切应力,以及其他区域的脉动剪切应力。内皮细胞还暴露于循环免疫细胞和每个器官和组织直接产生的炎性细胞因子和活性氧自由基(ROS)。这些特有的有害刺激的组合使得内皮细胞对细胞衰老特别敏感。此外,由于内皮细胞的寿命特性,特别是在大动脉中内皮细胞几乎不会被祖细胞替代,因此与有害刺激的相互作用还会进一步延长。
内皮细胞衰老的机制
上述损伤刺激通过多种细胞和分子机制诱导内皮细胞衰老,包括端粒功能障碍,非端粒DNA损伤和能量敏感通路的改变。因此,内皮细胞会激活肿瘤抑制途径,永久抑制细胞周期进程,发生形态变化并增加SASP因子的产生(图3)。
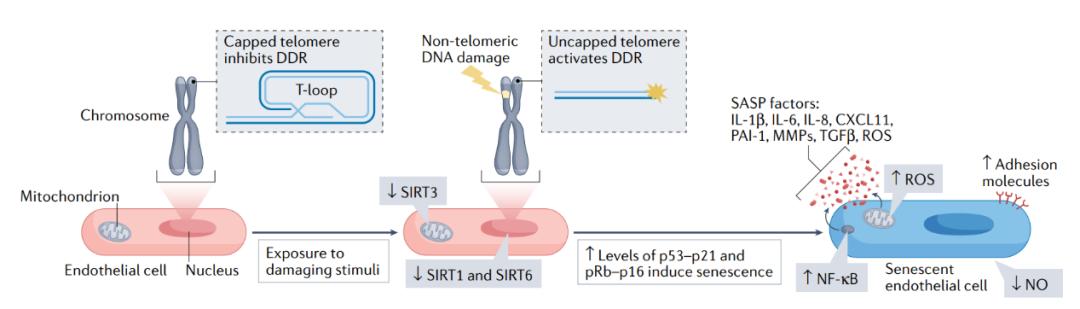
图3 | 损伤刺激诱导的内皮细胞衰老机制。循环和内源性刺激导致端粒和非端粒DNA损伤并改变能量感知通路,例如涉及sirtuins蛋白家族(SIRT1,SIRT3和SIRT6)的途径。因此,内皮细胞激活了肿瘤抑制通路(p53-p21和pRb-16通路),引起基因表达的重编程,导致一系列细胞和分子变化。例如,内皮细胞失去增殖能力并变得衰老(蓝色细胞);激活SASP,包括炎症通路,例如NF-κB、炎性细胞因子和ROS的分泌;并减弱关键血管活性分子(如NO)的产生。总的来说,细胞和分子的变化会促进动脉功能障碍,导致心脏代谢疾病。CXCL11,CXC-趋化因子配体11;DDR,DNA损伤反应;MMP,基质金属蛋白酶;PAI1,纤溶酶原激活剂抑制剂1;TGFβ,转化生长因子β;T环,端粒环。
端粒和DNA损伤 在大动脉中,内皮细胞的更新主要通过有丝细胞分裂发生,而非由祖细胞替代。在没有祖细胞替代的情况下增加细胞分裂的结果是端粒损耗,这增大了复制性衰老的可能性。由于DNA复制机制的特性,染色体末端的端粒包括重复序列(TTAGGG)会随着每次细胞分裂而缩短。当端粒变得非常短时,它们就失去了维持覆盖染色体末端的端粒环(T环)结构的能力。端粒解帽启动DNA损伤反应,激活p53-p21肿瘤抑制通路,导致细胞衰老。
在细胞培养水平发现血流紊乱缩短了内皮细胞的端粒,这支持了端粒缩短对内皮衰老的贡献。在人体中也观察到类似的表型,即暴露于扰动血流的血管区域内皮细胞的端粒损耗比经历层流区域的更大。虽然这些研究并没有直接证明端粒损耗足以产生复制性衰老的后果,但是正如端粒极短引起衰老的预期一致,可以通过端粒酶(延长端粒的酶)的外源性活化来阻止,血流紊乱通过p53-p21途径在小鼠体内以及在细胞培养水平导致的内皮细胞衰老。当然,复制引起的磨损可能只是这些位点端粒严重缩短的部分原因,因为氧化应激也会加速端粒损耗。
在血液层流区域,内皮细胞被认为是长寿的,并且长期暴露于有害刺激下。端粒序列含有丰富的鸟嘌呤三联体(TTAGGG),可以作为氧化靶标,因此它们极易发生氧化DNA损伤。端粒氧化可通过与端粒长度无关的方式介导端粒解帽和细胞衰老。这一猜想得到了以下发现的支持:无论端粒长度如何,老年人和高血压患者体内,与p53-p21诱导的衰老相关的端粒解帽水平,始终高于年轻和血压正常的对照个体。尽管导致端粒解帽的确切机制仍然未知,但来自小鼠模型的证据支持这样一种观点,即由于复制和氧化应激引起的解帽都会导致内皮功能障碍。例如,端粒缩短或端粒解帽的遗传诱导会导致年轻小鼠动脉表型老化。端粒功能障碍在血管老化中的作用此前已有综述报道。除端粒功能障碍外,非端粒DNA损伤也可在体内体外诱导内皮衰老。类似于端粒解帽的后果,研究表明,DNA损伤修复反应的受损也会导致年轻小鼠动脉衰老表型加速。
Sirtuins SIRTs是NAD+依赖的去乙酰化酶和ADP核糖基转移酶。为了响应细胞NAD+升高,SIRT1和SIRT6通过介导肿瘤抑制因子和DNA损伤修复途径来提高细胞修复和应激能力。因此,SIRTs已成为内皮细胞衰老的重要介质。
暴露于氧化或复制压力下会使内皮细胞中SIRT1和SIRT6的表达降低。此外,在细胞培养水平,SIRT1和SIRT6的抑制导致了内皮细胞的衰老。这些结果提示了存在一种正反馈环路,通过复制使细胞随着时间的推移而衰老。抑制内皮细胞中的SIRT1会增强p53活性,这可能解释了SIRT1介导内皮细胞衰老的机制。相反,SIRT6减少导致衰老的机制似乎在p53-p21激活的上游,并且与SIRT6在端粒保护和DNA修复中的作用有关。例如,抑制内皮细胞中的SIRT6导致端粒解帽事件加剧以及全核DNA损伤。鉴于SIRT6被公认可以作为异染色质和DNA的中介体,SIRT6缓解了已知会诱发DNA损伤和端粒功能障碍的ROS诱导的细胞衰老。所有证据表明,SIRT1和SIRT6通过保护DNA和减少p53-p21衰老途径的激活来预防内皮细胞衰老。
SIRT3在预防内皮细胞衰老方面也有作用。这种分子定位于线粒体,保护细胞免受氧化应激。在细胞培养的体系下,SIRT3表达升高可减缓内皮细胞的衰老。相反,在衰老内皮细胞中SIRT3的表达水平降低。SIRT3的全身过表达保护小鼠免受血管紧张素II诱导的内皮功能障碍并减轻主动脉衰老。这些发现提示了SIRT3和线粒体功能在内皮细胞衰老中的重要作用。线粒体功能障碍被认为是许多细胞类型衰老的诱因和结果。然而,线粒体功能对内皮细胞衰老的直接贡献仍未得到充分研究。内皮细胞具有高度糖酵解性,不会完全依赖氧化磷酸化来产生ATP。尽管如此,线粒体功能的改变似乎先于衰老的诱导,因为人脑微血管内皮细胞的复制衰老增加了它们对氧化磷酸化能量产生的依赖。此外,在内皮细胞中,辐射诱导的衰老已被证明可以增加线粒体ROS的产生,而用抗氧化剂保护细胞可以通过保持端粒长度并减少脂质过氧化和全基因组范围的DNA损伤减轻衰老的负担,从而增强复制能力。总之,这些发现表明线粒体功能的分子中介体,如SIRT3,在预防内皮衰老方面起着至关重要的作用。
内皮细胞衰老的后果
内皮细胞衰老对血管功能和心脏代谢疾病的影响在下文和图4中有所总结。
内皮依赖性舒张 EDD随着年龄的增长而受损,并与心血管疾病、发病率和死亡率相关。氧化应激和炎症水平升高可能是EDD减少的原因,而常驻衰老细胞的增加可能是这种氧化应激和炎症的起源。此外,衰老的内皮细胞eNOS表达降低,也会导致EDD受损。虽然还没有研究明确表明,内皮细胞的衰老本身就足以破坏EDD,但许多报告都暗示了这一推论。例如,在老年小鼠中,用达沙替尼和槲皮素治疗可改善颈动脉EDD并减少主动脉内皮细胞中端粒解帽现象的产生,但对平滑肌介导的血管舒张反应没有影响。这项研究提供了令人信服的证据,证明减少高龄人群衰老细胞的负担有利于内皮功能,而对平滑肌的影响很小。这些数据得到了一项来自健康、久坐人类的血管内皮细胞研究的支持,在这项研究中发现衰老程度的增加与EDD受损有关。
端粒解帽也与EDD相关。在小鼠中,在全身诱导的端粒解帽可通过产生大量ROS的方式引起动脉衰老,降低EDD和NO生物利用度,尽管在NO存在的情况下对平滑肌血管舒张没有影响。此外,培育出的端粒严重缩短的小鼠会由于氧化应激积累衰老的内皮细胞,在大动脉中出现氧化损伤和EDD受损,但平滑肌对NO的舒张反应仍然保持完好。在人体中,动脉端粒解帽与衰老以及已知会影响EDD的炎性细胞因子的表达相关。这些研究支持了这一假设,即内皮对衰老诱导刺激尤为敏感,而内皮细胞的衰老会导致EDD受损。然而,仍然不能排除其他与内皮存在相互作用的细胞类型的衰老效应,或是循环因子的变化对EDD的影响。因此,有必要直接在内皮中进行诱导或预防衰老的研究。
血管生成 新血管的形成过程被称为血管生成,这是一种重要的生理过程。例如,人体对运动的适应需要血管生成以满足氧气和营养物质的高需求;因此,血管生成受损会导致老人的运动耐受力下降。同样,心脏修复或其他组织的损伤修复也需要血管生成,而破坏这一过程会导致康复时间的延迟,对康复产生负面影响。值得注意的是,衰老会导致内脏脂肪组织血管生成能力降低。内皮细胞是启动和维持血管生成过程的主要细胞类型,主要通过血管内皮生长因子、成纤维细胞生长因子(fibroblast growth factor,FGF)和缺氧诱导因子1α(hypoxia inducible factor,HIF1α)来实现。因此,了解影响这些信号通路和损害血管生成的内皮细胞衰老的相关变化可能揭示新的治疗靶点。
细胞衰老可能是衰老相关和疾病相关的血管生成改变的基本机制。实验证据表明,内皮细胞衰老中端粒重复结合因子2(telomeric repeat- binding factor 2,TRF2)的破坏会损害血管生成能力。同样,基因缺失或抑制端粒酶也会损害啮齿动物的血管生成,影响缺血再灌注损伤模型中的组织修复。还有证据表明,电离辐射会诱导脑血管内皮细胞衰老,降低血管生成能力。此外,内皮中p53基因(Trp53)的遗传缺失改善了心力衰竭小鼠模型中的血管密度,暗示内皮细胞衰老对心脏损伤中的血管生成有影响。在机制上,内皮细胞衰老降低了血管内皮生长因子的表达,这可能导致了血管生成能力的减弱。
将细胞衰老作为靶点来恢复和维持血管生成已经得到了多条证据的支持。例如,小鼠中Cdkn1a基因(p21)或Trp53的缺失可以减轻内皮细胞衰老程度,改善增殖和血管生成能力。内皮细胞Trp53的缺失还能够改善血管生成能力,预防小鼠压力过载引起的心脏纤维化和糖尿病性心肌病。尽管这些研究已经为内皮细胞衰老抑制血管生成的假说提供了令人信服的证据,然而2021年发表的一份研究展示了矛盾的结果。这项研究发现在视网膜病变的小鼠模型中,内皮细胞衰老会诱导病理性血管生成和促进SASP因子的表达,SASP因子能够导致异常的血管新生和纤维化。使用senolytics治疗可以通过减少血管生成并允许功能性血管的再生来减轻疾病的严重程度。综上所述,文献表明内皮细胞衰老强烈影响血管生成,并且可以作为治疗靶点;然而,在未来仍有必要对这个主题进行深入研究。
屏障功能 作为血管的内膜,内皮形成了一种选择性渗透的屏障,调节血液和外周细胞以及组织之间分子的通过。内皮的渗透性是组织类型特异的,并由连接蛋白介导。由于屏障破坏与许多疾病有关,维持屏障功能至关重要。有趣的是,将内皮细胞培养至衰老会导致连接蛋白钙粘蛋白5 (cadherin 5,也称为血管内皮钙粘蛋白)和紧密连接蛋白ZO-1(tight junction protein ZO-1)的功能紊乱,并减少连接蛋白occludin和claudin 5的表达。此外,当与衰老内皮细胞共培养时,非衰老细胞的紧密连接蛋白会发生功能异常,这也许可以通过SASP理论来解释,因为已知炎症会增加单层内皮细胞的渗透性。重要的是,诱导内皮细胞衰老在体外和体内都会损害血脑屏障功能。内皮细胞衰老以及随后发生的屏障功能受损的后果在下面讨论的疾病状态中进行讲述。
高血压 与氧化应激和炎症水平升高有关的高血压,是全球发病率和死亡率最高的因素之一。内皮功能障碍会参与到氧化应激、炎症和高血压发展之间的相互作用。这些过程对血管保护性舒张分子(如NO)和血管收缩分子(如血管紧张素II和内皮素1)之间的平衡产生负面影响,从而导致系统性血管阻力和收缩压增加。因此,内皮细胞衰老的分子机制和后续的表型强烈表明内皮细胞衰老和高血压的发生发展有关。尽管存在这种联系的证据,但很少有研究证明内皮细胞衰老与高血压之间存在直接的因果关系。
对端粒功能障碍的研究是将衰老作为高血压驱动因素的研究领域中最令人信服的。例如,通过基因遗传方式使小鼠的端粒严重缩短会导致内皮素1水平升高,从而引起高血压。此外,独立于端粒长度,基因诱导的端粒脱帽会导致动脉衰老和小鼠收缩压升高。与正常血压个体相比,高血压患者中发现与细胞衰老相关的端粒脱帽显著增加,这与细胞衰老是动脉粥样硬化的最佳预测因素的证据相一致。
除了作为高血压的诱因以外,内皮细胞衰老也可能是血压升高的后果,因为促高血压的刺激因子,包括血管紧张素II和内皮素1,都会诱导内皮细胞衰老。此外,增加的脉压使内皮细胞暴露于机械应力,会导致衰老。如在横向主动脉缩窄导致的脉压增加的小鼠模型中的研究表明,脑微血管发生了p53-p21介导的衰老。这些数据表明存在一个正反馈循环,衰老降低一氧化氮并增加内皮素1和血管紧张素II的水平,从而诱导更多的内皮细胞衰老,进一步提高血压并导致衰老程度加剧。内皮细胞衰老作为高血压的独立机制是如何发挥作用的,需要进一步研究。为此,如端粒脱帽,或调控p16、p21或p53等内皮细胞特异性诱导衰老的小鼠模型可能是有帮助的。同样,在高血压模型中基因或药物清除衰老内皮细胞(例如高盐高脂饮食或eNOS抑制)也可能会揭示靶向内皮细胞衰老治疗高血压的基础和转化价值。
动脉粥样硬化 动脉粥样硬化是一种炎症性疾病,最初以动脉腔内脂肪条纹的形成为特征,发展为含氧化脂质、坏死核心和新生血管的粥样硬化斑块的形成。疾病的严重程度可以通过斑块的稳定性斑块大小和组成来衡量。具有薄纤维帽的不稳定斑块容易破裂,并且会在血液流动压力发生改变时脱落,阻塞毛细血管,导致临床心血管事件的发生,如心肌缺血和梗死、中风和外周动脉疾病。内皮细胞在动脉粥样硬化斑块的发生发展以及斑块稳定性和斑块破裂中起着关键作用。健康的单层内皮细胞形成紧密连接,防止血液中的低密度脂蛋白胆固醇和免疫细胞进入亚内膜空间。同样,内皮细胞能通过分泌NO来防止免疫细胞的粘附、滚动以及血小板的聚集。然而,在动脉树的动脉粥状硬化易感区域,损伤刺激下产生的第一个可检测到的改变就是内皮功能障碍。内皮功能障碍减弱了NO的产生并损害屏障功能,促进了低密度脂蛋白、胆固醇和免疫细胞的浸润。此外,内皮炎症信号和ROS的激活促进了疾病的发生发展并导致了斑块的不稳定性。动脉粥样硬化斑块中的内皮细胞会形成渗漏的血管,被称为血管外膜。血管外膜促进了营养物质的输送、免疫细胞的浸润和出血,加剧了斑块的生长和不稳定性。
动脉粥样硬化中内皮细胞功能障碍的许多特征类似于细胞衰老表型。关于内皮细胞衰老在动脉粥样硬化中的作用的第一个证据来自于2002年发表的一项观察性研究,该研究表明内皮细胞衰老在人类动脉粥样硬化斑块中加剧。在过去的20年中,更多的研究进一步阐明了内皮细胞衰老在动脉粥样硬化中的因果关系、机制和治疗前景。例如,内皮细胞与巨噬细胞、泡沫细胞和血管平滑肌细胞一起被确定为动脉粥样硬化斑块形成和稳定的重要参与者。通过过表达TRF2的显性负突变形式诱导内皮细胞特异性衰老促进动脉粥样硬化,而不影响血浆甘油三酯水平,这支持了内皮细胞衰老在动脉粥样硬化中发挥的因果作用。在机制上,衰老的内皮细胞通过损害屏障功能,导致低密度脂蛋白胆固醇和免疫细胞的浸润,从而促进动脉粥样硬化疾病的进展。同样,内皮细胞衰老减弱了NO的产生,并增加了NADPH氧化酶(NADPH oxidase)和前列腺素G/H合酶2(prostaglandin G/H synthase 2也称为环氧合酶2,cyclooxygenase 2)的产生,导致血小板的激活、粘附和聚集。NO产量下降促进了白细胞滚动、粘附和浸润,增加了血管平滑肌细胞的收缩和增殖,并抑制了红细胞输送氧气,所有这些都促进了动脉粥样硬化疾病的进展。
如上所述,衰老的内皮细胞分泌大量SASP因子,包括炎性细胞因子、基质蛋白和蛋白酶以及生长因子,所有这些因子都已知参与了动脉粥样硬化的发生。值得注意的是,与健康细胞相比,衰老的内皮细胞在NF-κB依赖性方式下应对TNF和脂多糖产生更高水平的VCAM1。来自人类和小鼠动脉粥样硬化斑块的内皮细胞也上调了notch受体1(NOTCH1)信号通路,这促进了ICAM1、IL-1α、IL-6和IL-8的表达和单核细胞的跨内皮迁移。除了促进斑块生长外,有令人信服的证据表明,衰老细胞还通过产生基质金属蛋白酶驱动斑块不稳定。这些发现来自于一项对混合人群的动脉粥样硬化斑块中衰老细胞产生基质金属蛋白酶的研究。因此,需要进一步揭示内皮细胞衰老在斑块不稳定中的个体作用。假设诱导衰老的内皮细胞凋亡不会对斑块稳定产生不利影响,那么清除衰老的内皮细胞可能是动脉粥样硬化的潜在治疗靶点。研究表明,使用基因消融技术、senolytics、通过抑制血管相关蛋白2(angiopoietin-related protein 2也称为类血管生成素2,angiopoietin-like 2)和细胞周期依赖性激酶5(cyclin-dependent kinase 5)、激活过氧化物酶体增殖物激活受体-α(peroxisome proliferator-activated receptor-α)都可以抑制动脉粥样硬化疾病的进展。总的来说,这些研究表明内皮细胞衰老不仅对动脉粥样硬化有贡献,而且也代表了一个可行的治疗靶点。
心力衰竭 心力衰竭的特征是心肌功能降低,影响心腔的充盈(舒张功能障碍,称为射血分数保留的心力衰竭;HFpEF)或适当地排出血液的能力(收缩功能障碍,称为射血分数降低的心力衰竭;HFrEF)。
在HFpEF中,类似于衰老表型的内皮功能障碍被认为是疾病发生发展的主要因素。糖尿病等合并症以及高龄等风险因素(这些因素都会引起内皮细胞衰老)促进冠脉循环中内皮源性的炎症和氧化应激,降低NO水平,从而导致病理性重构。尽管直接证据很少,但现有研究都支持内皮细胞衰老在HFpEF中的作用。例如,在一个加速衰老的小鼠模型中,高脂高盐的西方饮食加剧了内皮细胞衰老和炎症,并损害了NO介导的血管舒张作用,最终导致心肌肥厚、纤维化和舒张功能降低。相反,在糖尿病小鼠模型中,p53的系统性抑制改善了心脏炎症、氧化应激和随后的病理性重构,这些结果的产生可能部分归功于内皮细胞衰老的延缓。在老年小鼠中的研究进一步证明,由于可以减少心肌肥厚和纤维化,通过遗传学或药理学手段清除衰老细胞是HFpEF的潜在治疗靶点。尽管这项研究中两种清除衰老细胞的方法都针对多种细胞类型,但衰老细胞清除剂navitoclax能够特异性地杀死衰老的内皮细胞。HFpEF的有效药物治疗尚缺乏,靶向心肌细胞以外的细胞可能是一种有前景的新方法,因为HFpEF是多个器官系统的功能障碍,包括血管系统。此外,因为担心清除衰老心肌细胞后可能缺乏细胞替代(尽管它们是有丝分裂后的终末分化细胞,但心肌细胞显示出许多衰老特征),因此靶向内皮细胞的senolytics可能是有优势的。
文献中的证据也支持内皮细胞衰老在HFrEF中的作用。例如,在横断性主动脉缩窄小鼠心肌肥厚和HFrEF模型中,p53-p21途径在内皮细胞中上调。相反,通过在内皮细胞中特异性敲除Trp53来延缓衰老,可以降低SASP因子PAI1、TNF、CC-趋化因子配体2(也称为单核细胞趋化蛋白1)和ICAM1的表达,从而减少心脏纤维化和心肌细胞肥大,改善收缩功能和生存率。这些发现得到了缺血再灌注损伤小鼠模型的支持,在该模型中,收缩功能受损,并且心肌梗死后心力衰竭的风险增加。使用衰老细胞清除剂navitoclax治疗可以通过增加内皮细胞的增殖能力,刺激血管生成,改善受损的收缩功能和减少梗死面积。总的来说,这些研究表明内皮细胞衰老对HFpEF和HFrEF都有贡献,并且清除衰老内皮细胞的senolytics对心脏功能有益。尽管有这些令人鼓舞的发现,但在这种情况下使用senolytics可能会影响其他缺乏再生潜力的细胞类型,因此需要进一步研究。
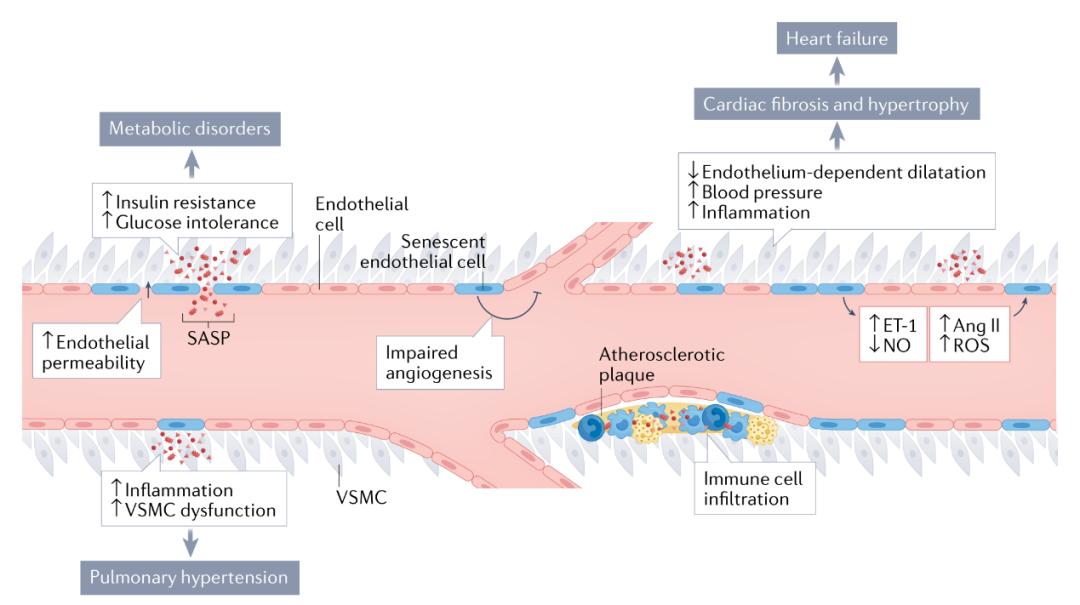
图4 | 内皮细胞衰老的病理后果。内皮细胞衰老(蓝色细胞)减少一氧化氮(NO)的产生,直接导致内皮依赖性舒张功能受损,并促进免疫细胞滚动、粘附和浸润、血小板聚集和内皮通透性增加。内皮细胞衰老还改变了其他血管活性分子(如血管紧张素II和内皮素1)的产生和功能,导致血压升高。此外,NO水平的降低和血管紧张素II和内皮素1水平的增加会进一步诱导内皮细胞衰老。总体而言,这些变化促进了动脉粥样硬化斑块的形成,导致心血管疾病。此外,内皮细胞衰老使血管生成能力失调,加剧了疾病的病理过程并阻滞了组织修复过程。内皮细胞衰老和衰老介导的血管功能障碍会导致多器官功能障碍和疾病,包括高血压、心力衰竭、肺动脉高压和代谢紊乱。ROS,活性氧自由基;SASP,衰老相关分泌表型;VSMC,血管平滑肌细胞。
肺动脉高压 肺动脉高压有着广泛的病因,既包括罕见的特发性病例、又可作为常见的心血管或呼吸系统疾病的并发症发生。许多细胞类型都会参与肺动脉高压的病理生理学过程,但是研究已经确定内皮细胞衰老是这种疾病发生发展的重要因素。在肺动脉高压的啮齿类动物模型、肺动脉高压患者的细胞培养模型和肺的单细胞RNA测序数据中,都已鉴定出衰老的内皮细胞。对损伤的易感性增加是肺动脉高压患者内皮细胞衰老的可能原因。例如,在细胞培养模型中来自肺动脉高压患者的肺内皮细胞比来自对照个体的细胞更容易受到血流紊乱和辐射诱导的衰老的影响。另一项研究为肺动脉高压的内皮细胞衰老提供了进一步的机制见解。研究人员发现,线粒体铁硫簇生物发生蛋白frataxin的缺乏会导致内皮细胞衰老,从而使炎症增加和血管重塑,并导致肺动脉高压。
在肺动脉高压中,内皮细胞衰老似乎会通过上调几种典型的SASP因子(如IL-6、TNF和PAI1)来推动其他血管细胞的功能障碍。例如,在来自肺动脉高压患者衰老内皮细胞的条件培养基内培养,增加了非衰老平滑肌细胞的炎症标志物和增殖水平。重要的是,可以通过senolytics治疗减轻肺动脉高压内皮衰老的后果,减轻衰老的负担和SASP因子的表达,并改善肺动脉高压的临床表现,例如减少内中膜增厚和降低肺血压。需要进一步的研究来评估在肺动脉高压的临床前模型和肺动脉高压患者的临床试验中清除衰老细胞的效果。
代谢功能 全身代谢紊乱,如高血糖和血脂异常,会导致血管功能障碍。然而,新出现的证据表明,内皮细胞衰老和功能障碍先于这些疾病发生,并且在许多情况下具有因果作用。例如,NF-κB的内皮细胞特异性失活可通过抑制血管衰老和SASP来预防高脂饮食引起的代谢功能障碍。还有证据表明,在内皮细胞中上调p53表达并诱导细胞衰老会减弱AKT1的磷酸化,导致胰岛素信号传导受损。另一项研究表明,在来自衰老内皮细胞的条件培养基中培养,增加了脂肪细胞中的SASP因子和氧化应激水平。此外,这种处理减弱了胰岛素受体底物1的蛋白表达,导致脂肪细胞中胰岛素刺激的AKT1磷酸化减少,与胰岛素信号传导受损一致。在小鼠中,内皮细胞特异性Trp53缺失缓解了高脂饮食诱导的肥胖、全身性葡萄糖耐受不良和胰岛素抵抗。相反,内皮细胞特异性的p53上调加剧了这些不良代谢表型,这些研究证明了内皮细胞衰老在全身代谢功能中的关键作用。在另一项研究中,内皮细胞特异性的抑制端粒结合蛋白TRF2会部分通过循环SASP因子导致全身性胰岛素抵抗。综上所述,这些发现表明,内皮细胞衰老导致炎性细胞因子分泌,以旁分泌和内分泌方式对邻近细胞产生不利影响,导致全身代谢功能障碍,并且可以通过靶向内皮细胞改善代谢功能。内皮细胞衰老与全身代谢损伤之间的机制联系可能是由于代谢活跃组织(如脂肪组织和骨骼肌)中免疫细胞浸润、血流、血管舒张、毛细血管密度和毛细血管募集的改变。未来有必要对这些过程进行进一步研究。
Senolysis的不良反应
虽然清除衰老细胞通常被认为是有益的,但使用senolytics杀死某些衰老细胞可能是有害的。Senolysis的有害影响源于全身药物给药,导致表达衰老标志物,但无法被替代的有丝分裂后细胞的意外死亡。来自心力衰竭小鼠模型的证据表明,使用遗传学(p16阳性细胞)或药理学(navitoclax给药)手段清除衰老细胞可减轻心肌细胞肥大和纤维化。然而,这些干预措施也会导致出现多核心肌细胞,有可能在未来成为心肌细胞肥大和病理性重塑的潜在诱因。杀死衰老细胞的方法似乎是不良反应产生的重要决定因素,因为遗传学和药理学方法的senolysis已被证明对动脉粥样硬化具有不同的影响。在这项研究中,navitoclax抑制动脉粥样硬化并减轻炎症,但对体内衰老标志物没有影响,这表明常用标志物的潜在局限性。来自小鼠的证据支持了清除衰老细胞的全身性影响,在横主动脉收缩或左颈动脉结扎引起的心力衰竭模型中,p53(Trp53-/-)或p16(Cdkn2a-/-)的全身缺失加剧了心脏纤维化。此外,通过遗传学手段去除p16阳性细胞可诱导肝脏和血管周围纤维化以及血管通透性的改变。总的来说,现有证据表明,在临床环境中有效清除衰老细胞需要确定靶细胞类型,并使用对该特定细胞类型和疾病状态具有选择性的senolytics。有趣的是,槲皮素和漆黄素是目前正在临床试验中被评估使用的两种senolytics药物,它们被首次鉴定时依据的就是它们能够选择性地杀死衰老内皮细胞。
结论
细胞衰老是一种重要的生物现象,在这种现象中,细胞经历永久性增殖停滞,保持代谢活性并变得具有分泌特性。衰老细胞在发育和伤口愈合过程中具有重要作用,因此对于维持生理稳态至关重要。在正常的生理条件下,衰老细胞会被免疫细胞清除,以防止它们随着时间的推移而积累。然而,随着年龄的增长和病理状态的发生,衰老细胞会积聚在组织和器官中,导致疾病的发生发展和生理功能障碍。转基因小鼠模型的发展使研究人员能够追踪和清除衰老细胞,以及在模型中诱导衰老发生,这极大地促进了对细胞衰老在疾病中发挥作用的理解。此外,senolytics药物的发展表明衰老细胞是一种可行的治疗靶点,并推动了大量临床试验的开展。
在本综述中,作者探讨了内皮细胞由于其解剖位置和暴露于独特的机械和生化刺激下对细胞衰老特别易感的观点。还描述了内皮细胞衰老的细胞和分子机制和后果,以及衰老的内皮细胞在脉管系统疾病和多种系统疾病中的生理效应——特别是在心脏代谢疾病中。
该领域中研究的普遍局限性为未来的研究留下了一些有待解决的问题。例如,许多模型不具有细胞类型特异性——由于内皮细胞,循环因子和其他细胞类型之间存在的相互作用,使用小鼠全身操作的研究或来自人类的临床样本,都不能排除其他细胞类型的影响。尽管在技术上具有挑战性,但还是需要内皮细胞特异性的操作来提高对衰老和疾病中内皮细胞衰老所发挥作用的理解。研究衰老诱导损伤如何以及在什么环境中发生,将提供有关内皮细胞如何衰老的基础知识。转基因小鼠模型和技术,如谱系追踪、活细胞成像、单细胞RNA测序和其他组学方法,将有助于进一步了解细胞衰老是如何被诱导的。这些信息很重要,因为细胞衰老诱导方法会影响SASP,而SASP是细胞衰老负担增加产生有害影响的主要原因。此外,了解细胞衰老如何发生可以提供新的治疗机会,如通过防止细胞衰老诱导的损伤或杀死衰老的内皮细胞。从转化医学的角度来看,正在进行的senolytics临床试验将揭示内皮细胞衰老在人类衰老和疾病中的作用。

原标题:《【学术前沿】Nature重磅综述 | 从机制到干预:内皮细胞衰老的深度解析》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




