- +1
Cell Stem Cell:吴军/于乐谦团队建立新一代人类“类囊胚”并探索母胎对话

2021年,德克萨斯大学西南医学中心吴军教授团队在 Nature 期刊发表论文【1】,构建了世界第一个人类人造类囊胚的模型。
2023年9月7日,吴军教授联合中国科学院动物研究所于乐谦团队在 Cell 子刊 Cell Stem Cell 上发表了题为:Large-scale production of human blastoids amenable to modeling blastocyst development and maternal-fetal cross talk 的研究论文【2】。
该研究在2021年“类囊胚I代”的基础上,打造出了与真实胚胎更为接近、效率超过80%的“类囊胚II代”。他们还研究了类囊胚形成过程中的关键信号通路,并且构建了早期胚胎发育过程中的母胎对话模型,在此模型上,类囊胚可以进一步进行发育。

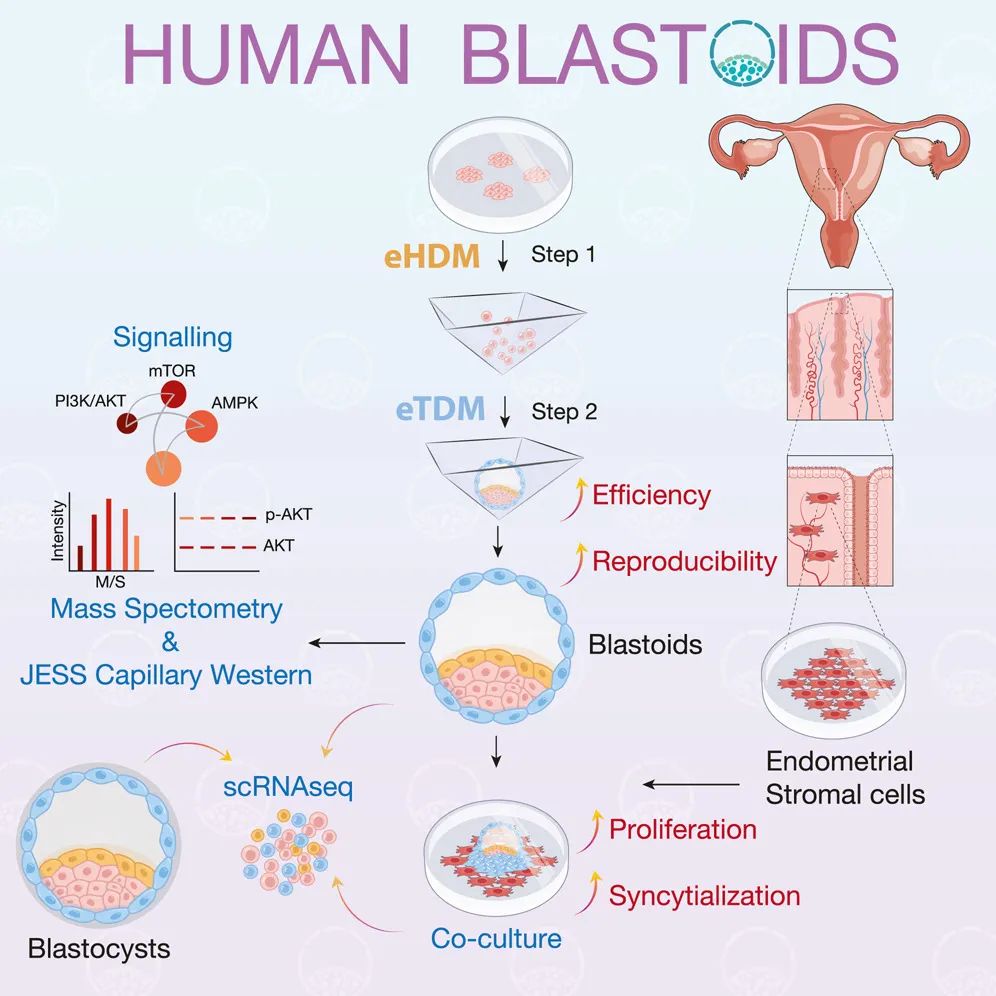
此次方法升级过程中,研究人员发现细胞活力是影响类囊胚形成效率的关键因素,小分子混合物CEPT可以显著提高人胚胎干细胞的活率并增加类囊胚形成效率,由此将补充了CEPT的下胚层分化培养基(hypoblast differentiation medium,HDM)命名为eHDM。此外,通过调控Hippo-yap/TAZ通路,在滋养层分化培养基(TB differentiation medium,TDM)中加入lysophosphatidic acid(LPA),建立了改良的TDM(命名为eTDM)。通过优化的eHDM和eTDM培养条件,可以高效提升类囊胚的形成效率,在不同细胞系背景的基础上,皆可将效率提高到80%以上,并在一定程度上缩短了类囊胚的构建时间。
优化后的“类囊胚II代”的滋养层样细胞(TB-like cells, TLCs)表达GATA3、TEAD4、CDX2、YAP-1、KRT7和KRT18等滋养层细胞(trophoblast,TE)标记基因并形成紧密连接;上胚层样细胞(epiblast-like cells ,ELCs)表达上胚层(epiblast,EPI)标记基因SOX2、OCT4和KLF17;下胚层样细胞(epiblast-like cells ,ELCs)表达下胚层(hypoblast,HYP)标记基因GATA6和SOX17。并且,与“类囊胚I代”相比,不同起始条件下的原始态(naive)人胚胎干细胞形成的“类囊胚II代”均具有更高的保真度,ELCs,HLCs,TLCs等与真实人类囊胚的细胞分群和基因表达更加贴近,但与人类真实囊胚仍有转录本差异。
由于人类胚胎获取受限,我们对人类早期胚胎发育过程中的信号通路也知之甚少,因此亟需一个工具、方法去研究这一过程。而使用类囊胚对人类胚胎发育进行研究的可信度在之前是未知的。团队通过使用类囊胚/真实胚胎的比较,以及成功聚集的类囊胚/未成功聚集的细胞集合体的比较,探索了影响类囊胚形成的关键调控通路。
通过使用类囊胚,研究团队通过一种化学发光和荧光蛋白质印迹系统(A chemiluminescent and fluorescent western blotting system,JESS)首次对可能在人类早期胚胎发育中的起作用的关键蛋白AKT,MAPK,STAT3,S6K1和AMPK进行了研究。通过检测发现,这些蛋白的表达水平,以及它们的磷酸化(活性)水平,发现人类囊胚中p-AKT/AKT和p-S6K1/S6K1的在类囊胚和人类真是胚胎中都表达,但是在细胞聚集体中未表达。这表明人类真实囊胚与类囊胚一致,并且PI3K/AKT和mTOR在囊胚形成过程中起着重要作用。研究人员进一步对类囊胚进行了蛋白质组学和磷酸化蛋白质组学分析,发现了PI3K/ AKT、mTOR和AMPK信号通路在类囊胚形成中发育着关键作用。
接着,团队通过使用串联质谱标签(TMT)对类囊胚进行了蛋白质组学和磷酸化蛋白质组学分析。分析鉴定了2551种蛋白质,其中大多数与人类真实囊胚的转录组谱重叠。通过磷酸化物特异性特征富集分析(PTM-SEA),团队发现了:
1)使用AKT抑制剂IV阻断PI3K/AKT途径导致空腔形成效率,聚集体大小显著降低等现象 。
2)雷帕霉素处理降低了空腔形成效率,聚集体大小,总细胞数以及TLC的数量和比例。
3)AMPK抑制剂BAY-3827在空腔形成效率,聚集体大小等方面具有剂量依赖性负面影响。
这些观察结果与AMPK途径在小鼠囊胚发育中的公认作用一致。团队首次通过蛋白质组学,发现并探究了囊胚形成过程中的关键信号通路,并且将该推论在人类囊胚中得到验证,初步证明了以类囊胚为模型研究人类胚胎早期发育的可行性。
胚胎与子宫内膜对话的建立是影响胎儿在母体受孕的重要因素之一,子宫内膜上皮是植入胚胎的第一个母体接触,作为胚胎植入的瞬时门户影响胚胎着床效率,但是子宫内膜基质细胞如何影响植入囊胚的生长和分化并不清晰。团队通过使用永生化原代子宫内膜基质细胞(immortalized primary endometrial stromal cells,IESC)与类囊胚建立共培养系统,以此建立胚胎体外着床模型,研究IESCs和类囊胚间的相互作用。
首先,共培养3-5天后,EPI、HYP和TE细胞分离,少量类囊胚形成含羊膜腔样结构,绒毛膜促性腺激素β(chorionic gonadotropin beta,CGB)阳性细胞位于类囊胚外周并分泌CGB,证明了类囊胚具有形成早期植入后胚胎样结构的能力。其次,IESCs可以支持囊胚和类囊胚的增殖,通过在纤维连接蛋白包被培养皿中使用扩展类囊胚培养基(extended blastoid culture medium,EBC)培养,IESCs条件EBC培养基和直接与IESCs共培养的囊胚与类囊胚对比发现,IESCs分泌促进类囊胚增殖的蛋白因子,促进ELCs/EPI和TLCs/TB的增殖,并促进TB的合胞体化。最后,通过单细胞转录组进一步研究了类囊胚模拟的胚胎着床发育模型。比较在IESCs和纤维连接蛋白包被培养皿上培养的类囊胚,发现与IESCs共培养的类囊胚与真实囊胚在转录水平上更接近,对每个样本间的ELCs、HLCs和TLCs进一步分析,还发现了共培养时期囊胚和类囊胚的基因表达差异。
综上,该研究通过优化类囊胚构建方案,显著提高了稳定性和类囊胚的保真度。确定了囊胚形成过程中关键的几个信号通路,证明了类囊胚和子宫内膜基质细胞共培养可以模拟人类囊胚着床发育过程,并研究了植入后胚胎的早期发育。类囊胚的大规模生产使高通量的基因和药物筛选成为可能,胚胎着床后早期发育过程的研究为深入理解胚胎发育过程提供了有价值的研究模型。
该论文的通讯作者为美国德克萨斯大学西南医学中心吴军教授、科罗拉多生殖医学中心主任袁野以及德克萨斯大学西南医学中心Gary C. Hon教授。第一作者为中国科学院动物研究所于乐谦研究员(类囊胚第I、II代第一作者)、德克萨斯大学西南医学中心博士Carlos A. Pinzon-Arteaga、Jialei Duan、科罗拉多生殖医学中心博士Deirdre Logsdo、Toshihiko Ezashi,以及中国农业大学魏育蕾教授。
论文链接:
1. https://www.nature.com/articles/s41586-021-03356-y
2. https://doi.org/10.1016/j.stem.2023.08.002
题图为论文第一作者、中国科学院动物研究所于乐谦研究员
中国科学院动物研究所于乐谦研究组现招聘:副研究员(编制),助理研究员(编制),博士后。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




