- 266
- +1
中国科学院微生物所李明/向华团队CHOM:揭示CRISPR护卫RNA的全新生理功能
原创 Cell Press CellPress细胞科学

生命科学
Life science
2023年9月1日,中国科学院微生物研究所李明团队和向华团队合作在Cell Press细胞出版社旗下期刊Cell Host & Microbe上发表题为“Widespread RNA-based cas regulation monitors crRNA abundance and anti-CRISPR proteins”的研究论文。该研究揭示了CRISPR护卫RNA不仅能够守护CRISPR-Cas系统的稳定性,而且可介导CRISPR-Cas的自抑制调控,实现感应crRNA胞内浓度和anti-CRISPR蛋白进攻的多重生理功能。该研究论文共同第一作者为中国科学院微生物研究所博士生刘超、博士后王锐、程飞跃、舒宪和副研究员李洁,通讯作者为中国科学院微生物研究所李明研究员和向华研究员。
CRISPR-Cas系统是广泛存在于细菌和古菌中的适应性免疫系统,它的多样性和普遍性不仅为基因组编辑技术这一革命性生物技术提供了丰富多样的元件,同时也为理解微生物进化与适应机制提供了广泛的视角。该系统主要由CRISPR结构和Cas蛋白组成,在抵御外源病毒等遗传元件入侵时,CRISPR 存储阵列会频繁发生新spacer的获取增长,也会发生CRISPR结构的内部重组丢失,从而导致CRISPR结构和crRNA丰度的动态变化。然而,Cas蛋白的表达如何适应这一动态变化是该领域长期存在的基本科学问题。
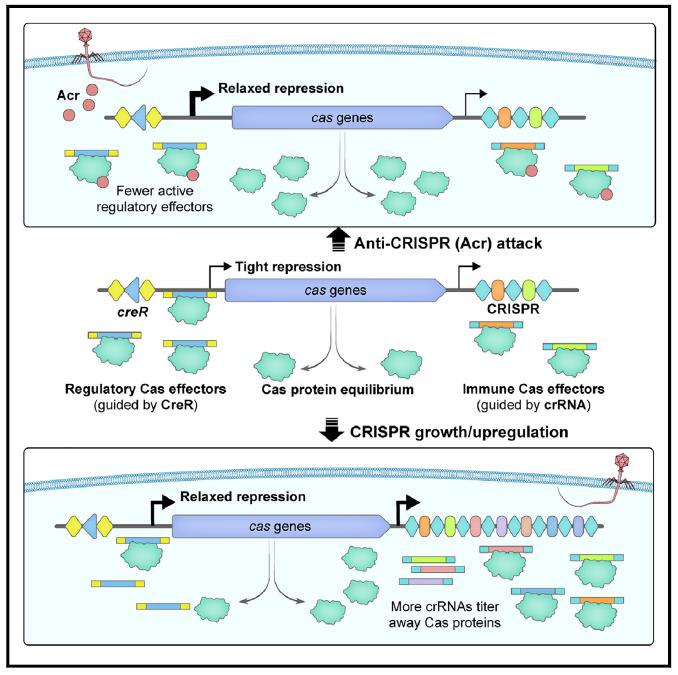
2021年,该团队在Science上报道了一类可以护卫CRISPR-Cas稳定性的双RNA型毒素-抗毒素系统—CreTA(CRISPR-regulated toxin-antitoxin)。其抗毒素CreA可以指导Cas蛋白复合物抑制毒素基因creT的表达,一旦Cas蛋白被失活或抑制,CreT毒素将表达抑制菌体生长,使细胞对Cas蛋白成瘾,从而护卫了CRISPR-Cas系统的遗传稳定性。该团队在此基础上通过分子遗传学实验进一步发现,CreA还介导了Cas蛋白的自抑制调控回路,一旦CreA突变后,Cas蛋白的表达将显著增加(图1)。这种自抑制回路不仅有效避免了Cas蛋白过度表达导致的能量浪费,还降低了CRISPR-Cas的自免疫风险。
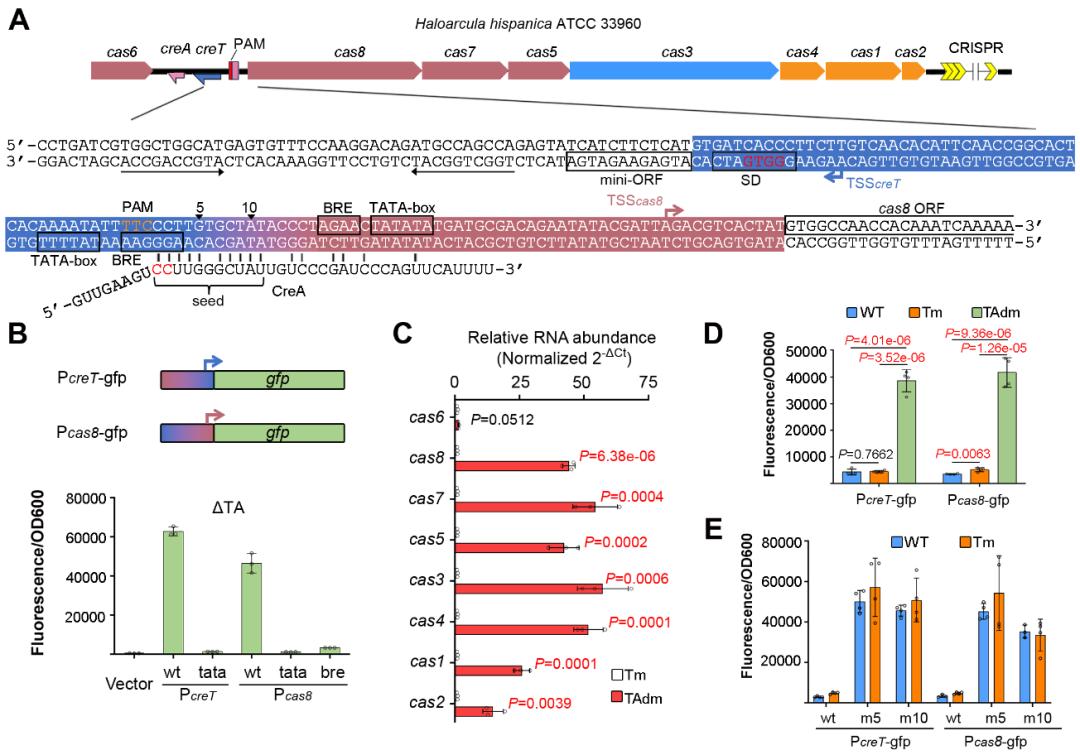
图1. CreA同时抑制Pcas8和PcreT
随后通过大量生物信息学分析发现, CreA的类似分子(由于大多缺乏偶联的CreT毒素,因此称为Cas-regulating RNA,即CreR)广泛存在于Class 1和Class 2的CRISPR-Cas系统中(主要是I型和V-A型)(图2),表明了CreR偶联CRISPR-Cas系统的普遍性。
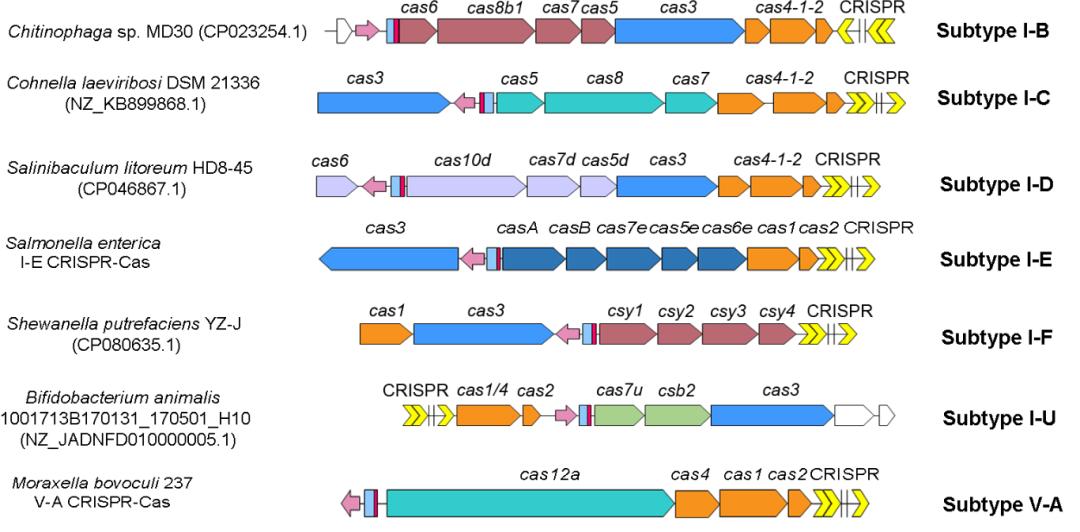
图2. I型和V-A型CRISPR-Cas系统中的CreR
研究团队进一步实验证实,I型和V-A型CreR均具有指导Cas蛋白实现自抑制调控的功能。更重要的是,通过表达不同长度或不同诱导强度的CRISPR结构改变胞内crRNA的含量,研究人员可以利用这一自调控回路调节Cas蛋白的表达水平,即CreR介导的Cas蛋白自抑制回路可以感应crRNA的丰度(图3),以实现crRNA和Cas蛋白之间的协调表达。
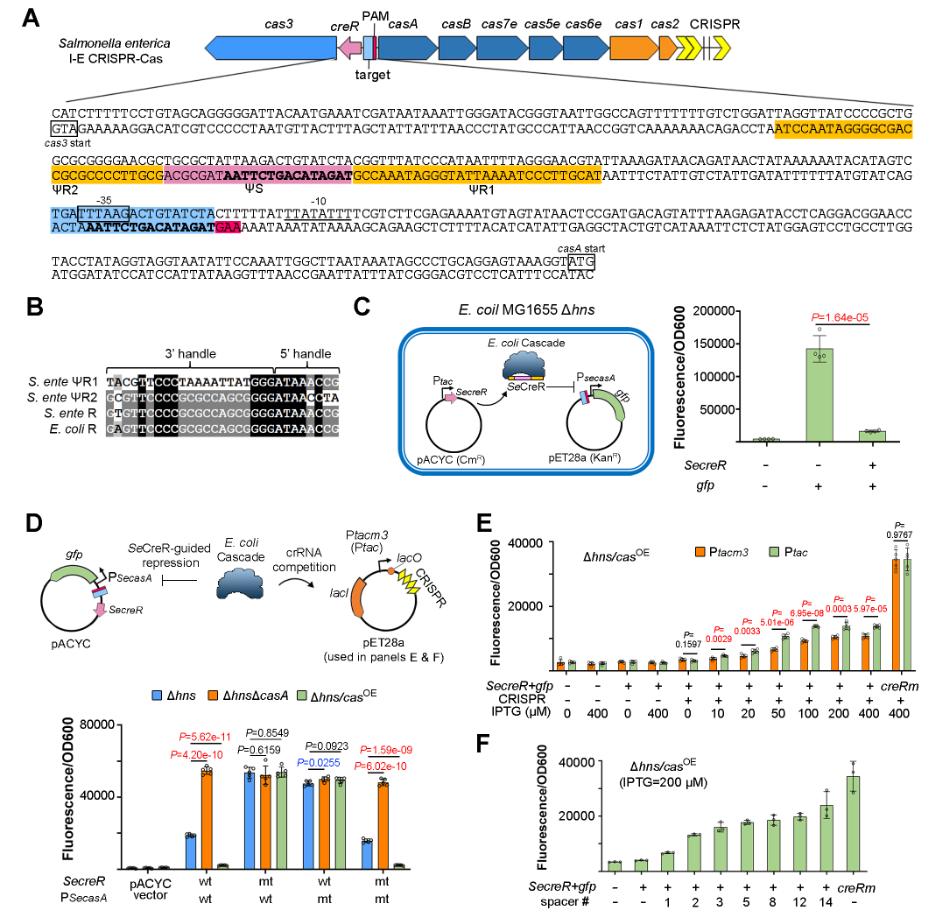
图3. CRISPR-Cas系统可以利用CreR调控Cas蛋白的表达以响应CRISPR长度和丰度
此外,研究团队在I-E型和V-A型CRISPR-Cas系统中通过表达不同的Anti-CRISPR(Acr),发现CreR介导的Cas蛋白自调控回路还可以有效地响应噬菌体携带的Acr蛋白,从而快速、高效地激活cas基因的高水平表达,以应对Acr的攻击(图4)。
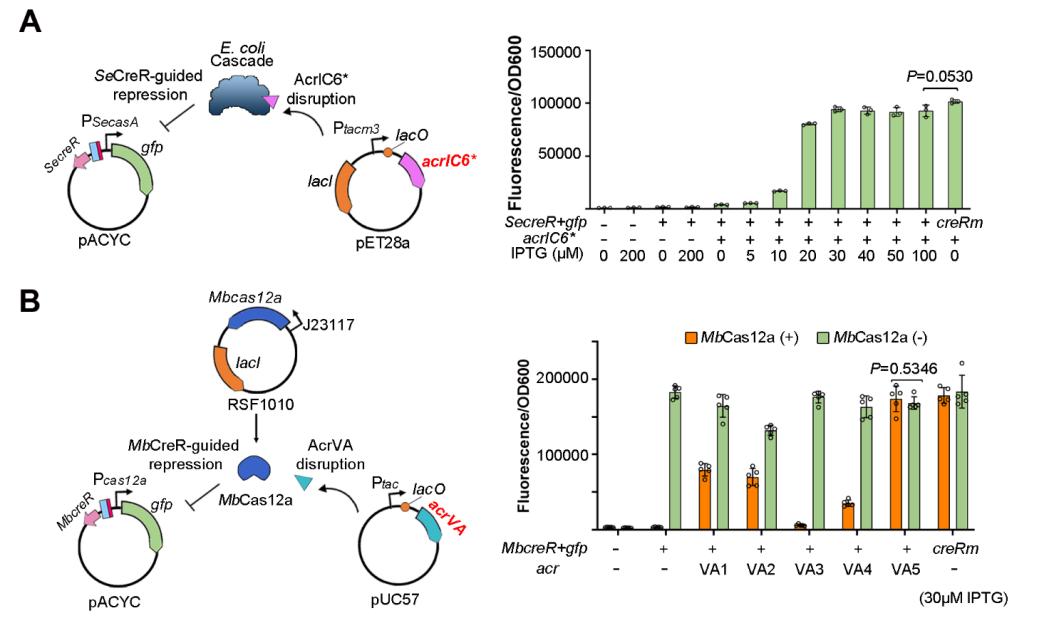
图4. CreR介导的Cas蛋白自抑制可以被不同的Acr蛋白破坏
综上,此项研究揭示了不同类型的CRISPR系统中广泛存在由CreR介导的Cas自抑制调控回路,不仅回答了CRISPR-Cas系统如何协调Cas蛋白和crRNA表达这一领域内基础科学问题,还揭示了一种作用于转录水平的anti-anti-CRISPR新策略。该工作为理解原核生物防御系统与噬菌体之间的攻防互作关系及CRISPR-Cas系统的广泛分布和进化提供了全新视角,也将为开发新型CRISPR工具提供新理论和新元件。

作者介绍

李明
研究员
李明,中国科学院微生物研究所研究员,微生物生理与代谢工程研究室副主任,中国科学院特聘研究员、青年创新促进会会员。聚焦微生物CRISPR等噬菌体防御机制的理论研究,以及基因编辑、菌群编辑、耐药菌消杀等新型使能技术的开发,以通讯作者发表Science、Cell Host & Microbe、Nature Communications、Nucleic Acids Res等论文,在国际上首次发现了CRISPR的护卫RNA系统,并利用其开发了新型CRISPR杀菌剂,推动并引领了该国际热点领域的研究。获国家自然科学基金优秀青年基金、国家原创探索计划等项目资助。

向华
研究员
向华,博士、研究员、博士生导师,中国科学院微生物研究所副所长,微生物资源前期开发国家重点实验室主任,国家杰出青年科学基金获得者,国家重点研发计划项目首席科学家。现任中国微生物学会秘书长、中国遗传学会微生物遗传专业委员会主任,中国生物工程学会合成生物学分会副主任。历任J Genetics Genomics、Front Microbiol、mLife等期刊副主编及Appl Environ Microbiol,Biology等期刊委,第6~10届全国微生物遗传学学术研讨会共同主席和主席等。致力于极端环境微生物资源与微生物组,CRISPR-Cas分子机制与基因组编辑技术创新,嗜盐微生物遗传代谢与PHA合成生物学等研究,已在Science, Nature Communications, Nucleic Acids Research, Biomaterials, Mol Microbiol等专业期刊发表论文140余篇。
相关论文信息
论文原文刊载于Cell Press细胞出版社
旗下期刊Cell Host & Microbe上
▌论文标题:
Widespread RNA-based cas regulation monitors crRNA abundance and anti-CRISPR proteins
▌论文网址:
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00330-X
▌DOI:
https://doi.org/10.1016/j.chom.2023.08.005
2021年,Cell Press推出了“集体审稿”(Community Review)模式,作者可以选择多本Cell Press旗下期刊同时提交稿件。“集体审稿”模式可以增加您的文稿在Cell Press得到正式同行评审的可能性,同时避免一轮又一轮的评审,缩短从投稿到正式出版所需的时间。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。



















- 男乒失守,“狼”来了
- 丢冠不稀奇,谁来扛起男乒大旗
- 重大偷税骗补案涉700余名主播

- 立方制药:第一季度净利润3825.03万元,同比增长25.94%
- 大千生态:截至目前,公司及千宠家科技没有收购杭州宠胖胖科技有限公司的安排

- 一项世界性的环境保护纪念日,在每年4月22日
- 中国南北朝时期传唱的乐府民歌,后人把它与《孔雀东南飞》合称为“乐府双璧”

- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司