- +1
miRNA的生物发生与miRNA的剂量控制
原创 Cell Press CellPress细胞科学

生命科学
Life science
在哺乳动物细胞中,microRNAs (miRNAs)通过碱基互补配对识别mRNA,形成一个复杂的“多对多”调控网络。以往的研究主要集中在单个miRNA的调控机制和功能上,但大多数情况下单个miRNA的改变并不会强烈干扰miRNA调控网络。最近的研究显示全局性miRNA剂量调控在生理过程和发病机制中起着重要作用,表明miRNA可以被认为是控制细胞命运的“细胞缓冲剂”。近日,来自北京大学生命科学学院的杜鹏研究员和未来技术学院的汪阳明教授团队在Cell Press细胞出版社旗下Trends in Cell Biology发表了题为“miRNA dosage control in development and human disease”的综述文章,系统地阐述了全局性miRNA剂量如何严格控制以调节胚胎发育、肿瘤发生、神经和免疫系统的研究现状,并提出通过控制全局性miRNA剂量来治疗人类疾病的新观点和新思路。
miRNA的生物发生与miRNA的剂量控制
miRNA的发生途径是高度保守的。在哺乳动物中,miRNA最初由RNA聚合酶II转录,随后由微加工复合物Microprocessor(由DROSHA和DGCR8组成)切割,产生具有茎环结构的pre-miRNA。通过转运蛋白XPO5以RAN-GTP依赖的方式输出到细胞质后,核酸酶DICER1进一步对pre-miRNA进行切割,将其加工为双链成熟的miRNA。其中一条链与AGO等蛋白形成功能性miRNA诱导的沉默复合物(miRISCs)来沉默靶标mRNA,而另一条链一般被降解 [1]。
miRNA主要通过5'末端2到8位的7个碱基的种子序列识别靶标mRNA。来自不同miRNA家族的多个miRNA与其靶标mRNA组成了一个复杂的“多对多”调控网络;即一个miRNA可以调控多个mRNA,一个mRNA也可以被多个miRNA靶向。通过这种方式,大量miRNA和mRNA之间的协调作用有助于维持细胞稳态并控制各种生理过程。
miRNA发生途径中的任何异常都可能导致miRNA整体剂量的变化。例如,在人类肿瘤患者中发现了DROSHA、DGCR8、DICER和AGO蛋白的突变,以及miRNA基因位点的异常扩增(如19号染色体上的miRNA簇,即C19MC); LIN28和DDX5/17等RNA结合蛋白可以直接结合miRNA生物发生过程中的关键组分或未成熟/预成熟的miRNA,从而改变miRNA生物生成的效率,控制全局miRNA的剂量。因此,全局性miRNA剂量在哺乳动物细胞中起着“细胞缓冲剂”的作用,当miRNA剂量发生变化时,细胞稳态会随之受到影响,并在不同的生理或病理条件下调控细胞命运和行为(图1)。
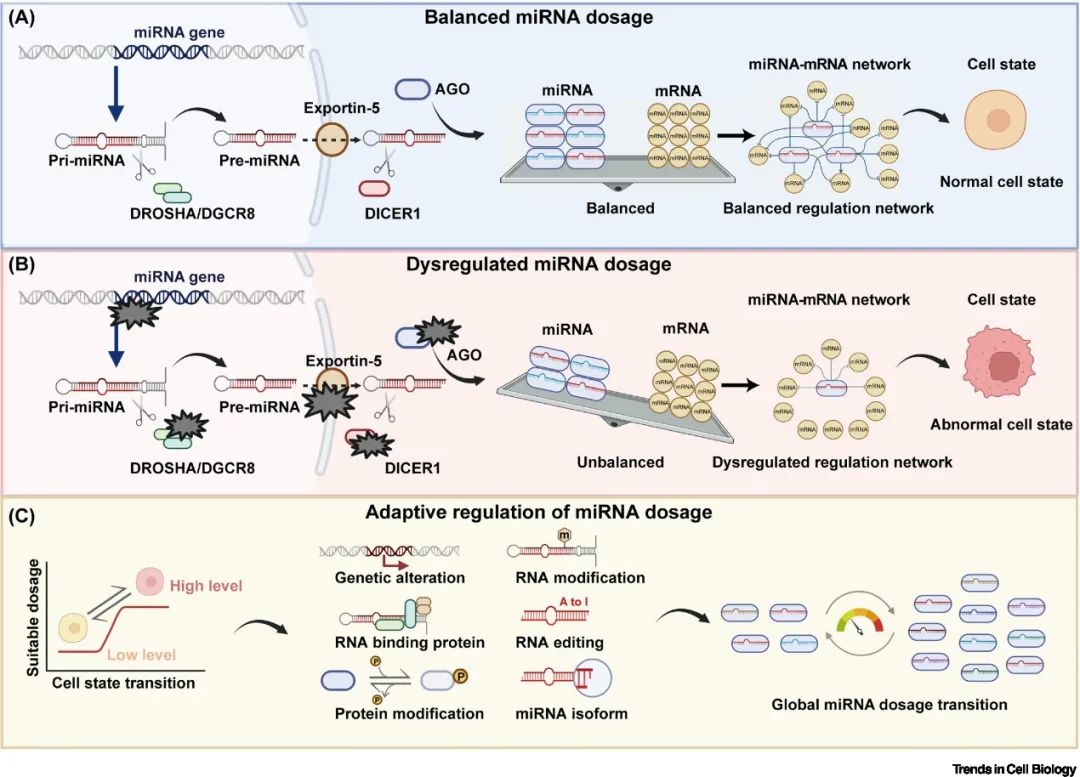
▲图1. miRNA全局性剂量的调控模型。
胚胎发育过程中的miRNA剂量控制
miRNA剂量对于正常的胚胎发育有重要的作用。卵母细胞时期存在miRNA的表达,但是其功能受到全局性抑制[2]。受精卵第一次分裂后,母源miRNA被迅速降解。在随后的胚层谱系分化过程中,小鼠胚胎干细胞发生Dgcr8的选择性转录起始,抑制了成熟miRNA的全局表达,驱动干细胞向内胚层分化,抑制了往外胚层和中胚层的分化[3]。此外,剪接因子ISY1可以介导pro-miRNA生成,激活大量miRNA,进而促进类似于E4.5-E5.0左右植入胚胎的上胚层细胞的“poised”多能性的建立[4, 5]。综上所述,全局miRNA剂量在早期胚胎发育中动态调节,确保了在不同胚胎发育时期都维持合适的miRNA浓度(图2)。
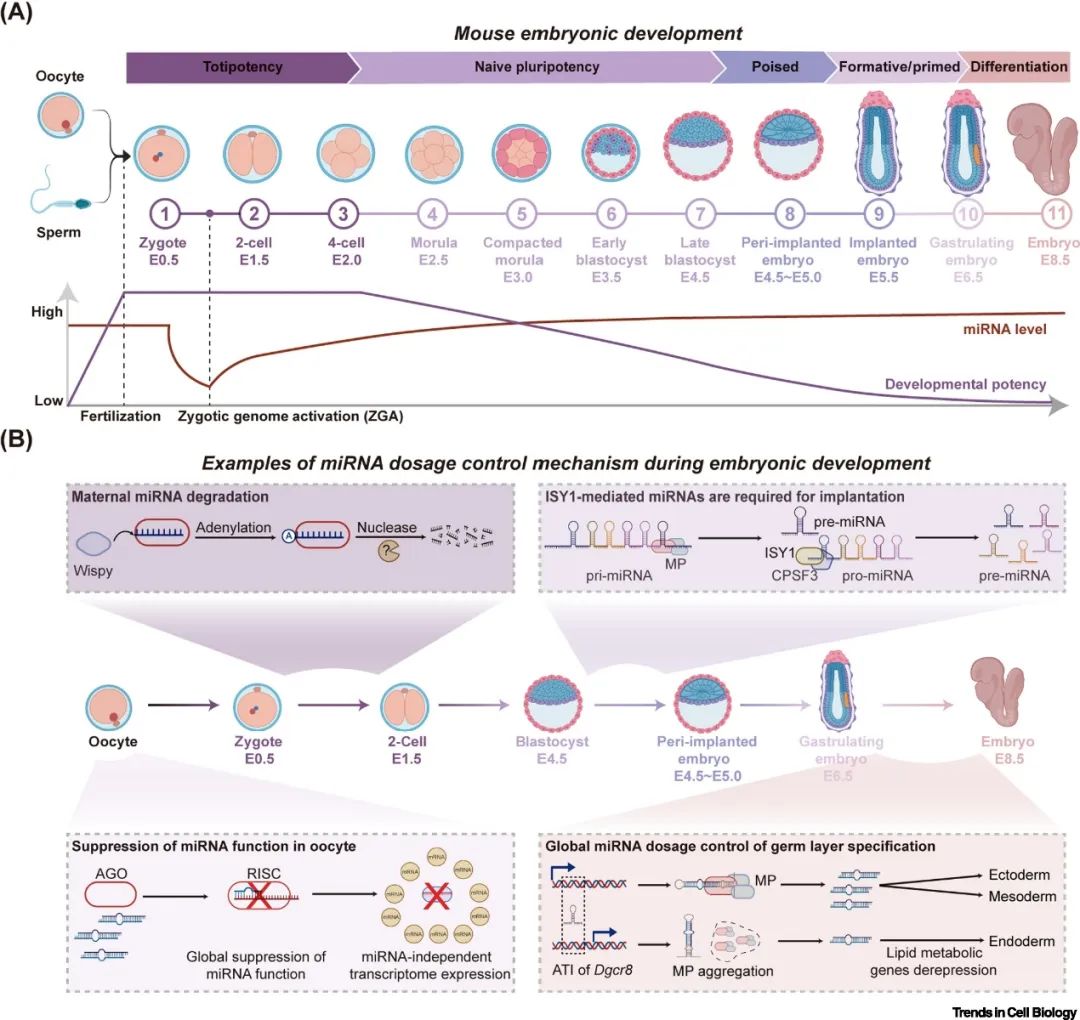
▲图2. 胚胎发育过程中miRNA剂量控制的示例。
癌症中的miRNA剂量控制
在不同类型的癌症中已发现miRNA的广泛下调,说明miRNA的全局性剂量在各种癌症发生过程中起关键作用[6],而miRNA生物发生中各个过程的改变都会引起miRNA的剂量失调。C19MC位点在转录水平上的扩增, KSRP、DDX5/17等RNA结合蛋白的调节,DROSHA、DGCR8、XPO5、DICER、AGO等蛋白的突变等,都会改变细胞内miRNA全局性表达。
此外,肿瘤细胞中存在具有不精确5 '端的miRNA异构体(与经典的miRNA序列相比,具有缩短、延长或者突变几个碱基的miRNA被称为miRNA异构体),这可能会影响miRNA与其靶标之间的碱基配对。进一步发现,在不同人类原发性癌症样本和肿瘤细胞系中,3’末端短1-nt的异常miRNA异构体广泛积累,为肿瘤细胞中全局miRNA剂量降低提供了潜在的全新解释。非常有趣的是,基于植物免疫蛋白RDR1的生物工程,可以挽救癌细胞中有缺陷的miRNA通路,最终使活化的细胞周期基因重新沉默,广谱抑制癌细胞增殖,但不影响正常细胞[7]。总之,全局性miRNA剂量控制为多种癌症提供了新的治疗策略,并为开发新的广谱抗肿瘤药物奠定了基础(图3)。
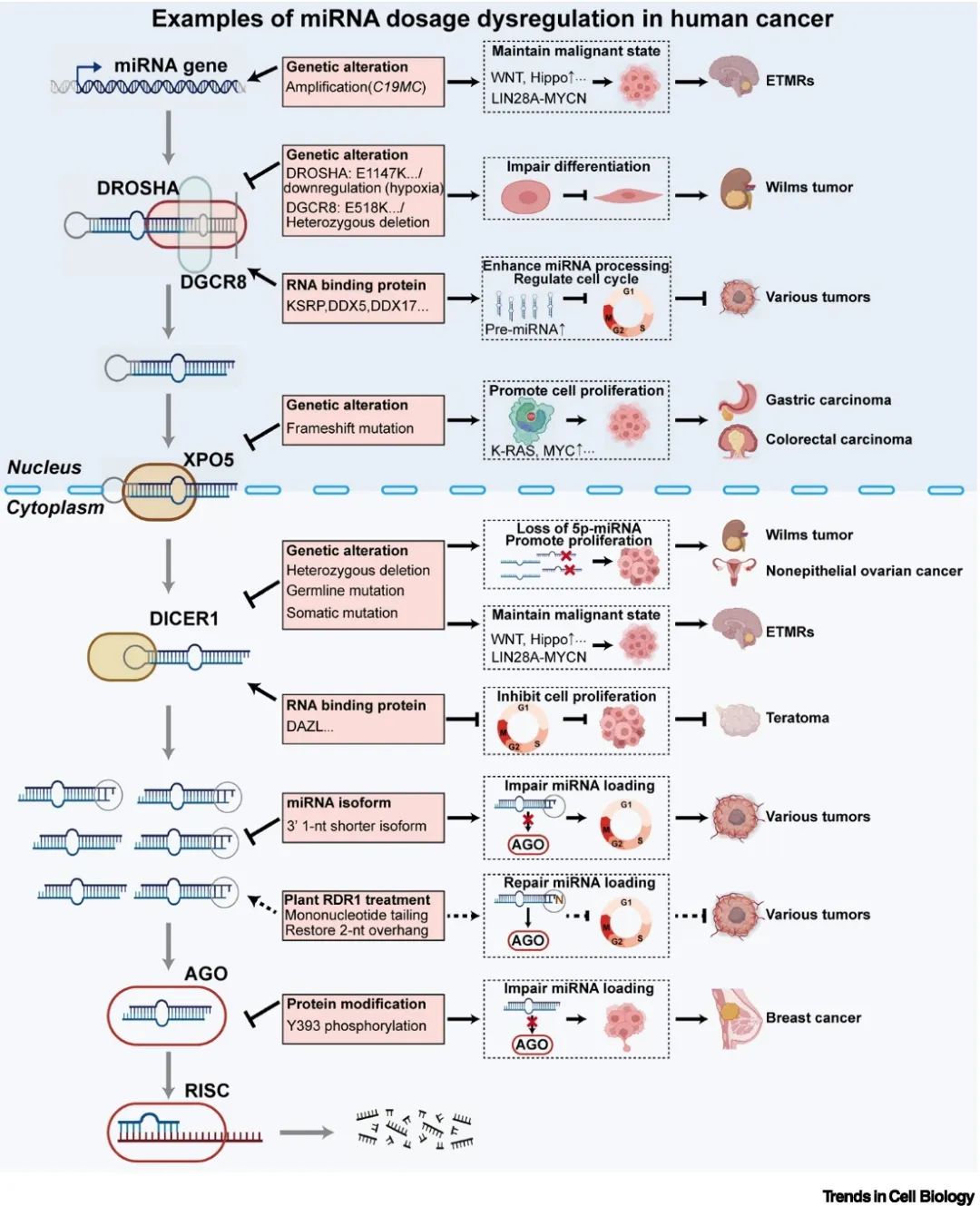
▲图3. 癌症中miRNA剂量失调的示例。
神经系统中的miRNA剂量控制
神经系统的发育以及相关疾病的发生也与miRNA剂量的变化息息相关。22q11.2缺失综合征是典型的由miRNA剂量缺失引起的严重的神经系统疾病,包括精神分裂症、自闭症等,主要都是Dgcr8单倍体剂量不足所造成的[8]。此外,RNA结合蛋白与miRNA生物发生通路关键组分的相互作用、亨廷顿舞蹈症以及帕金森病患者中AGO2活性的改变等,都能引起全局性的miRNA含量或活性的改变, 导致异常的神经元分化和疾病的发生。因此,miRNA剂量控制也可以作为治疗神经疾病的潜在靶点 (图4)。
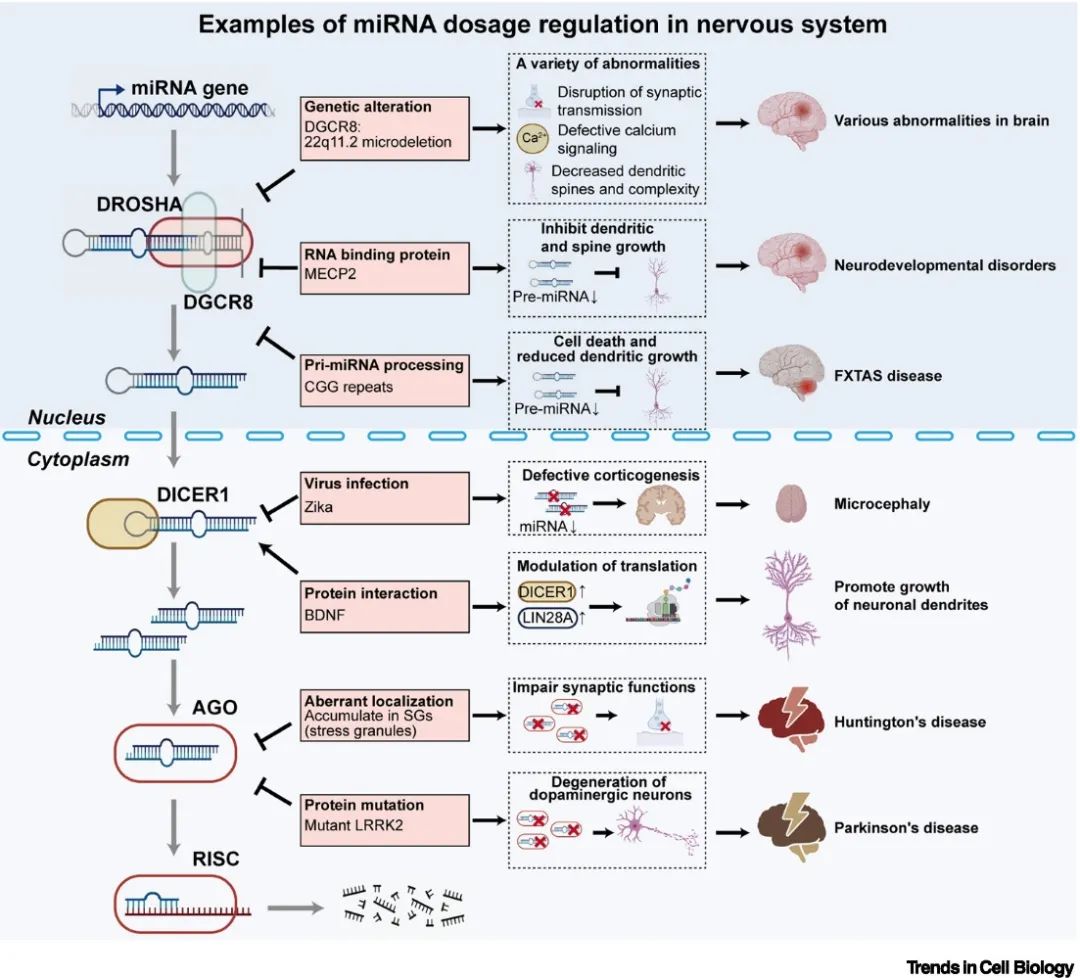
▲图4. 神经系统中miRNA剂量控制的示例。
免疫系统中的miRNA剂量控制
miRNA剂量对免疫同样至关重要。在正常细胞中,miRNA作为干扰素刺激基因(ISG)的内源性抑制因子来维持细胞稳态。在病毒感染后,miRNA对ISG的抑制作用被广泛消除,进一步启动抗病毒反应。全局miRNA剂量在造血和免疫细胞分化中也起着重要作用[9]。在初始CD4 (+) T细胞分化过程中,全局miRNA表达降低,促进初始T细胞向辅助性T细胞分化;而T细胞激活后,miRNA的整体表达又有所上升。由此可知,miRNA剂量对先天免疫反应和适应性免疫系统的发育和功能都有重要影响。
miRNA剂量控制的应用前景
在以往的研究中,一些特异性的miRNA,如miR-34和miR-15/16,在不同人类疾病中扮演重要角色,是潜在的治疗靶点。然而,单一使用这些miRNA对患者进行治疗显示出非常严重的毒副作用[1,3,5],人为操纵单个miRNA极有可能导致整个miRNA调控网络的严重失调并致功能障碍。相比之下,通过操纵整体miRNA剂量,如植物RDR1蛋白对于异常的miRNA异构体的修复,既可以特异性地提高疾病细胞中miRNA剂量,又不会对健康组织产生毒性作用[2,9]。因此,操纵全局miRNA剂量控制是一种潜在的更有效、更安全的治疗策略。最后,作者认为,利用不同的干预形式,如小分子化合物、miRNA模拟物、合成寡核苷酸、蛋白质递送以及DNA和RNA编辑工具等,靶向miRNA的生物发生及相关途径,也可用于控制全局性miRNA剂量,有望治疗癌症和神经系统异常等人类疾病(图5)。
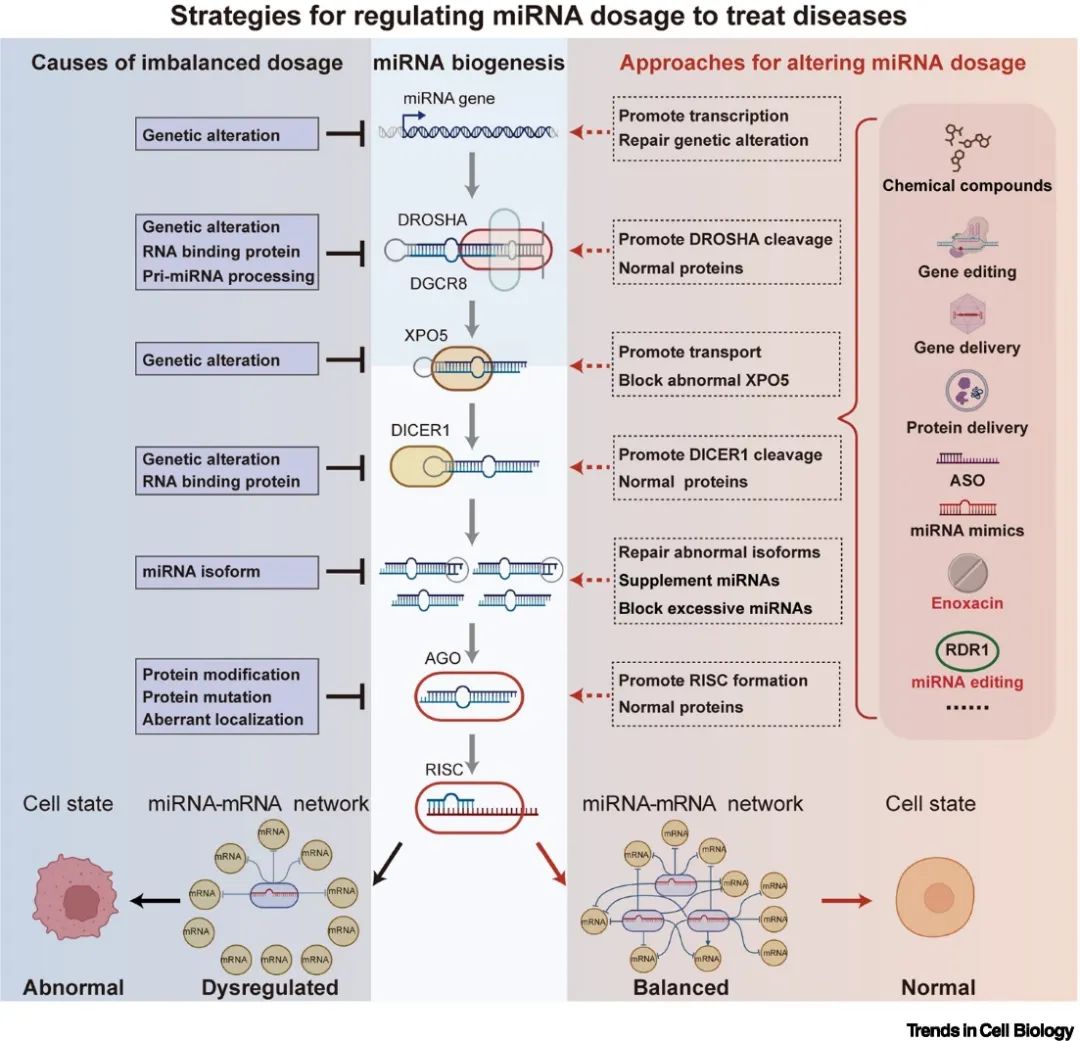
▲图5. 通过调节miRNA剂量治疗疾病的潜在策略。
本文参考文献(上线划动查看)
1. Bartel, D.P. (2018) Metazoan MicroRNAs. Cell 173 (1), 20-51.
2. Suh, N. et al. (2010) MicroRNA function is globally suppressed in mouse oocytes and early embryos. Curr Biol 20 (3), 271-7.
3. Cui, Y. et al. (2021) Global miRNA dosage control of embryonic germ layer specification. Nature 593 (7860), 602-606.
4. Du, P. et al. (2015) A Biogenesis Step Upstream of Microprocessor Controls miR-17∼92 Expression. Cell 162 (4), 885-99.
5. Du, P. et al. (2018) An Intermediate Pluripotent State Controlled by MicroRNAs Is Required for the Naive-to-Primed Stem Cell Transition. Cell Stem Cell 22 (6), 851-864 e5.
6. Lu, J. et al. (2005) MicroRNA expression profiles classify human cancers. nature 435 (7043), 834-838.
7. Qi, Y. et al. (2022) A plant immune protein enables broad antitumor response by rescuing microRNA deficiency. Cell 185 (11), 1888-1904.e24.
8. Chun, S. et al. (2014) Specific disruption of thalamic inputs to the auditory cortex in schizophrenia models. Science 344 (6188), 1178-82.
9. Hoefig, K.P. and Heissmeyer, V. (2018) Posttranscriptional regulation of T helper cell fate decisions. Journal of Cell Biology 217 (8), 2615-2631.

论文作者介绍

杜鹏
研究员
杜鹏,2012年于北京大学获得博士学位,后进入哈佛大学医学院/波士顿儿童医院从事博士后研究。2018年起任北京大学生命科学学院和北京大学-清华大学生命科学联合中心研究员,主要从事RNA生物学与干细胞生物学相关研究,同时致力于在动物细胞中重组植物或微生物中特异的RNA调控通路,并分析其潜在的对于基础科学研究和转化医学研究中的价值。以独立及共同通讯作者,分别在Cell (2021, 2022), Nature (2021)和Cell Stem Cell (2022) 杂志上发表论文。获得国家自然科学基金委原创探索计划、科技部干细胞重点研究计划、颠覆性技术创新项目等资助;并获得国家杰出青年基金、入选首届“亚洲青年科学家基金项目”、钟南山青年科技创新奖,顾孝诚讲座奖,中国干细胞协会卓越青年研究员奖,中源协和突破创新奖等荣誉奖励。

汪阳明
教授
汪阳明教授,2006年获美国伊利诺伊大学香槟分校博士学位,同年赴加州大学旧金山分校再生医学研究所从事博士后研究,2011年至今在北京大学分子医学研究所从事教研工作,获国家杰出青年基金资助(2021-2025)。研究领域主要为干细胞和RNA生物学。主要成果包括建立了miRNA 全敲除小鼠胚胎干细胞系,率先揭示了miRNA 通路对于胚胎干细胞增殖与分化的重要作用;发现了调控胚胎干细胞增殖、细胞周期、糖酵解代谢和自我更新等功能的miR-290和miR-302家族并解析了其分子机制;发明了miRNA激活CRISPR-Cas9基因编辑体系开启的技术平台,以及新型非编码RNA启动子活性报告基因技术;鉴定了调控FGF/ERK通路活性的长非编码RNA,解析了其促进胚胎干细胞自我更新的功能和分子机制;发现了调控早期胚胎发育合子基因组激活 (ZGA) 和体外全能干细胞转化的新分子通路PIAS4-SUMO2-DPPA2/4;发明了新的线粒体基因编辑工具,拓展了线粒体单碱基编辑适用范围。在学术杂志Nature Genetics、Nature Cell Biology、Nature Communications、EMBO Journal、Cell Research和PLoS Biology等以第一或通讯作者发表学术论文30余篇。总引用5000余次。现任Cell Proliferation编委,中国细胞生物学学会干细胞分会委员,中国生物化学及分子生物学学会RNA分会委员,RNA分会青年委员会主任委员。
相关论文信息
相关研究发表在Cell Press细胞出版社
旗下期刊Trends in Cell Biology,
▌论文标题:
miRNA dosage control in development and human disease
▌论文网址:
https://www.cell.com/trends/cellbio-logy/fulltext/S0962-8924(23)00105-8
▌DOI:
https://doi.org/10.1016/j.tcb.2023.05.009
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




