- +1
《细胞》重磅:癌细胞,你躲不住了
原创 奇点糕 奇点网
*仅供医学专业人士阅读参考


免疫细胞和癌细胞之间的“猫鼠大战”,很多时候都以癌细胞的胜利而告终。
其中一个重要原因,是癌细胞通过清除表面呈递抗原的MHC-I,隐藏了自己的身份,导致免疫细胞认不出迎面走来的癌细胞。这也是炙手可热的免疫治疗拿很多癌症没办法的重要原因之一。
今天,由纽约大学格罗斯曼医学院王俊和Iannis Aifantis领衔的研究团队,在顶级期刊《细胞》上发表重磅研究成果[1],报道了癌细胞表面MHC-I的首个负调控机制,有望催生新的免疫治疗方案。
具体来说,他们发现在急性髓系白血病(AML)和一些实体肿瘤的癌细胞中,膜蛋白SUSD6和TMEM127会与MHC-I结合,并招募E3泛素连接酶WWP2泛素化MHC-I,促进MHC-I的降解,进而赋予癌细胞对免疫细胞隐身的功能。
好消息是,抑制SUSD6/TMEM127/WWP2这个免疫抑制轴,就可以促进癌细胞MHC-I的抗原呈递,并以CD8阳性T细胞依赖的方式抑制肿瘤生长,延长模式动物的生存时间。纽约大学格罗斯曼医学院的陈旭峰和鲁峤是论文的共同第一作者。

论文首页截图
由于癌细胞的MHC-I抗原呈递是免疫细胞识别癌细胞的重要方式,因此围绕癌细胞MHC-I调控的研究非常多。
不过,绝大部分研究都是围绕MHC-I抗原呈递过程中一些关键蛋白展开的。这些研究发现,一些关键蛋白编码基因的突变或缺失,会导致MHC-I水平下降或者抗原加工/呈递不畅。
不过,在王俊等看来,上面的这些MHC-I正调控机制不能完全代表大部分肿瘤免疫原性低的一般机制。更关键的是,因基因变异导致的蛋白功能缺失,很难通过药物干预恢复正常,也就是说,围绕这些靶点很难研发相关的治疗药物。
因此,王俊团队将研究重点放在了MHC-I的负调控机制上,也就是寻找那些表达上调会导致癌细胞表面MHC-I水平降低的调控因子。这条路并不好走,因为到目前为止还没有人找到这样的调控因子。不过,王俊团队注意到,这种负调控机制在病毒感染中非常常见。
为了找到相关的负调控因子,王俊团队先构建了抗原特异性多肽MHC-I(pMHC-I)报告细胞系,然后在全基因组的水平上开展CRISPR-Cas9功能缺失筛选。经过多次的筛选和分析之后,一个反复出现且排名一直靠前的负调控因子SUSD6浮出水面。由于SUSD6和MHC-I一样定位于细胞膜,王俊团队决定将它作为研究对象。

抢占前排的SUSD6
在小鼠和人的AML细胞系中,王俊团队证实,膜蛋白SUSD6确实可以抑制抗原特异性pMHC-I和一般MHC-I的表达,而且SUSD6的缺乏可以促进抗原特异性CD8阳性T细胞反应,增强T细胞对癌细胞的杀伤力。小鼠体内实验也证实了上述结论。
更重要的是,除了AML之外,SUSD6在几种人类实体瘤中也显著上调,如胰腺腺癌(PAAD)、胆管癌(CHOL)、胶质母细胞瘤(GBM)和脑低级别胶质瘤(LGG)等。这意味着,实体瘤中可能也存在上述的MHC-I负调控机制。
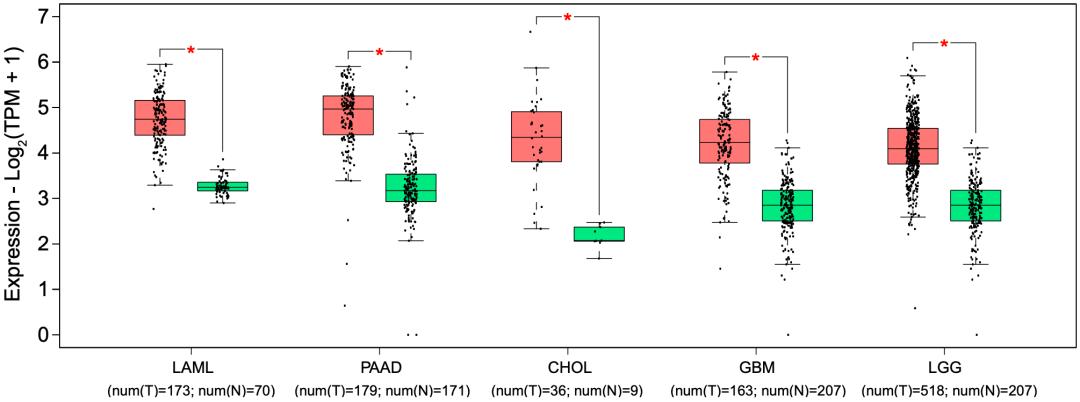
实体瘤可能也存在类似的机制
于是,王俊团队将黑色素瘤细胞系B16F10-OVA、肺癌细胞系CMT167、胰腺癌细胞系KPC和肠癌细胞系MC38/CT26的Susd6基因敲除,发现这些实体瘤癌细胞细的MHC-I表达都增强了。
基于B16F10-OVA和CT26的小鼠体内研究表明,Susd6的敲降能增加MHC-I的表达和肿瘤微环境中CD8阳性T细胞的占比,延缓两种实体肿瘤的进展,并改善小鼠的存活率,但不影响癌细胞系在体外的生长。如果耗竭两个小鼠模型体内的CD8阳性T细胞,Susd6的敲降的抗癌作用就会消失。
以上数据说明,在AML和一些实体瘤中,SUSD6可以通过降低癌细胞表面MHC-I的水平,促进免疫逃逸。
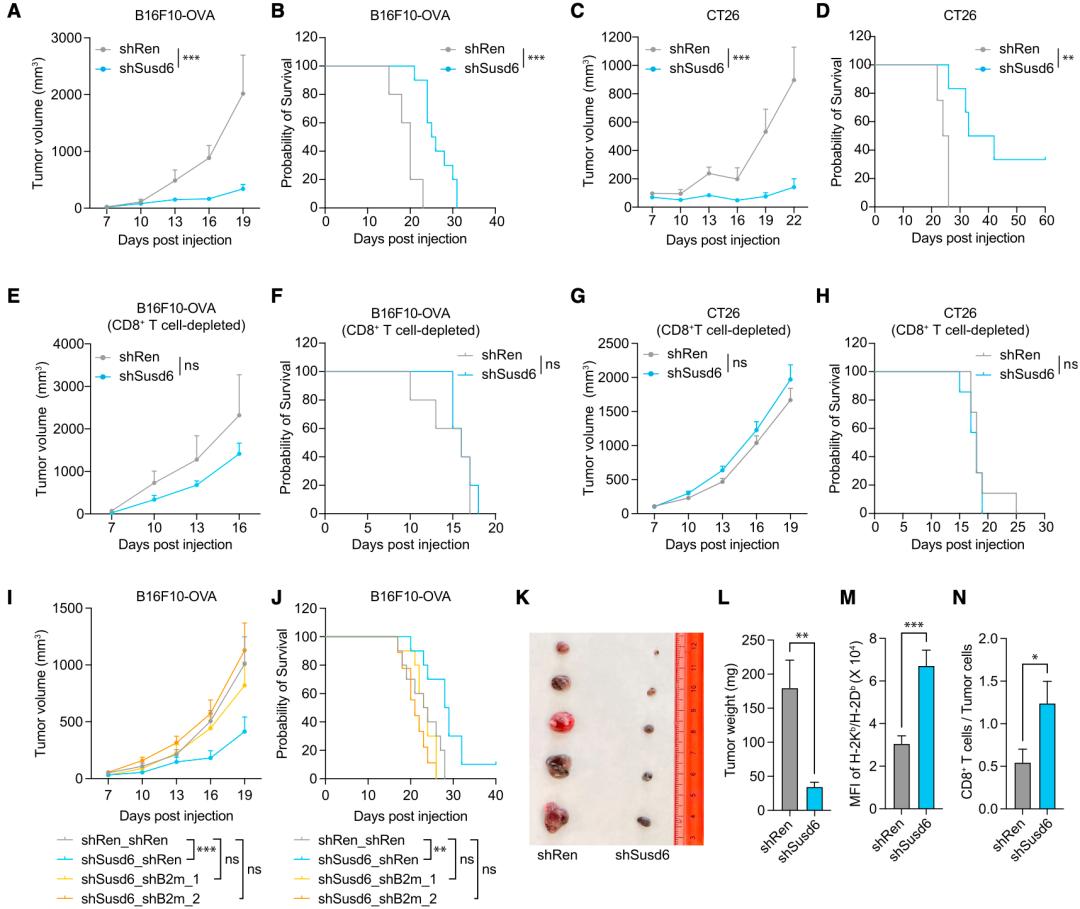
敲降Susd6的抗癌效果很明显,且依赖于CD8阳性T细胞
至于SUSD6负调控MHC-I的机制,王俊团队也做了深入的探索。
原来SUSD6发挥负调控作用,需要膜蛋白TMEM127和E3泛素连接酶WWP2的帮忙。具体来说,SUSD6和TMEM127会与MHC-I结合形成一个三聚体,然后招募E3泛素连接酶WWP2对MHC-I进行泛素化,导致MHC-I被降解。
在研究的最后,王俊团队发现,无论是敲降SUSD6还是TMEM127,都能增强肿瘤(AML或实体瘤)MHC-I的表达,并延缓肿瘤生长,延长动物生存时间。
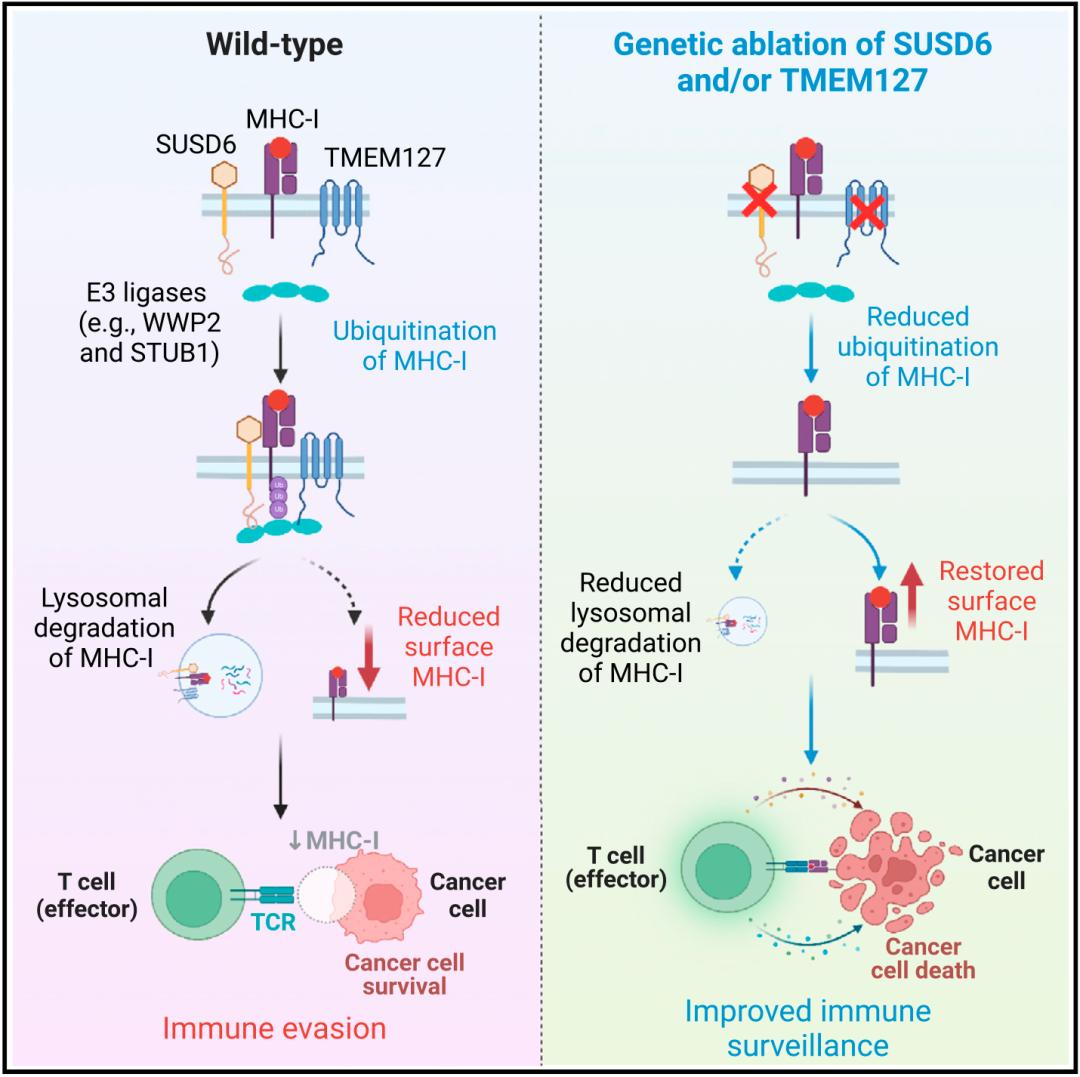
机制示意图
总的来说,王俊团队的这项研究表明,SUSD6/TMEM127/WWP2是癌细胞表面MHC-I的重要负调控因子,靶向这一组合可以增加肿瘤MHC-I的水平,破除癌细胞对免疫细胞的隐身技能,增强免疫细胞对癌细胞的监视和杀伤作用。
不难想见,这一发现对于癌症的免疫治疗,尤其是免疫原性低的“冷”肿瘤的治疗有重要的指导意义。
参考文献:
[1].Chen et al., A membrane-associated MHC-I inhibitory axis for cancer immune evasion, Cell, 2023, doi: 10.1016/j.cell.2023.07.016


本文作者丨BioTalker
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




