- +1
四川大学任海燕团队鉴定出哺乳动物细胞中膜蛋白PD-L1的调节因子
原创 Cell Press CellPress细胞科学

生命科学
Life science
2023年8月3日,四川大学任海燕团队在Cell Press细胞出版社期刊Cell Chemical Biology上发表了题为“Genetically incorporated crosslinkers identify regulators of membrane protein PD-L1 in mammalian cells”的研究成果。靶向PD-1/PD-L1免疫疗法在临床实践中取得了显著成功。然而,对PD-1/PD-L1治疗的耐药性也在相当多的患者中出现。深入了解PD-L1的调节机制可能为癌症治疗提供新的策略。然而,探索膜蛋白相互作用蛋白网络仍然是一项具有挑战性的任务。本研究探索遗传编码光交联剂的巨大潜力,结合遗传编码、共价交联、串联变性纯化和蛋白质组学,在生理条件下研究膜蛋白PD-L1的相互作用蛋白组,成功鉴定PGRMC1为PD-L1的互作蛋白,并阐明了PGRMC1调节癌症细胞中GSK3ß介导的PD-L1降解和T细胞毒性的机制 (图1),为临床靶向PD-1/PD-L1免疫检查点联合其他药物治疗提供了思路。四川大学任海燕研究员为论文通讯作者,柴芳妮、李攀、何勇为论文共同第一作者。该研究获得了国家自然科学基金委面上项目、科技部重点研发项目及四川大学华西医院135项目等的资助。
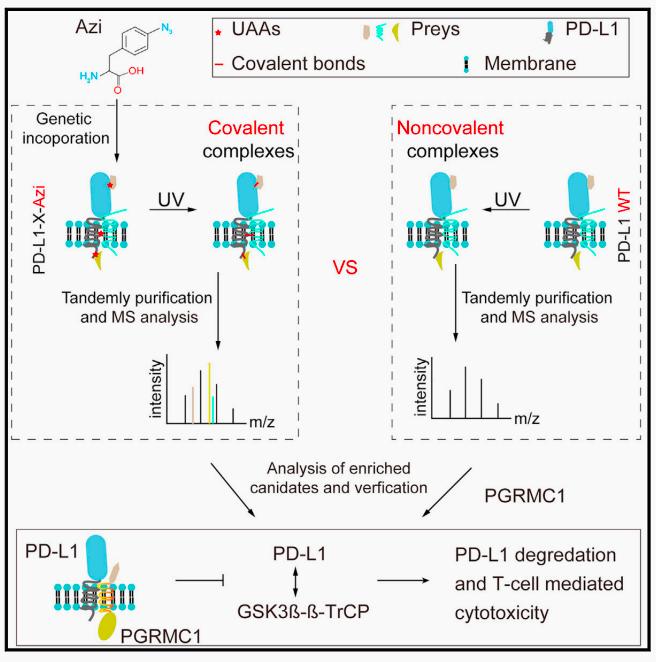
图1 遗传密码子拓展技术捕获PD-L1互作蛋白
靶向PD-1/PD-L1免疫检查点具有广谱抗肿瘤效果。目前,PD-1/PD-L1免疫检查点抑制剂联合其他药物用于晚期癌症的治疗,往往可以大幅度地提高治疗效果。但并不是所有的患者都对抗PD-1/PD-L1免疫治疗药物有响应,且部分患者在免疫治疗后发生获得性耐药。PD-L1表达水平与肿瘤的免疫治疗抵抗及不良预后密切相关。PD-L1表达是目前临床上应用最广泛的免疫治疗生物标志物之一。PD-L1蛋白表达检测已被NMPA、FDA等批准,并且在国内外各种权威指南推荐中作为多种肿瘤免疫治疗的生物标志物,用于指导免疫治疗方案的制定和预测免疫治疗疗效。深入了解PD-L1的调节机制可能为癌症治疗提供新的策略。
然而,使用传统方法鉴定膜蛋白的相互作用伴侣是极具挑战性的,主要原因在于其跨膜区域的疏水性和苛刻的提取条件极大破坏了蛋白质-蛋白质的相互作用。遗传编码交联剂已成为研究活细胞中天然蛋白质-蛋白质相互作用(PPIs)的一种有吸引力的策略。然而,膜蛋白的低表达、苛刻的提取条件和质谱分析的高背景限制了其在哺乳动物细胞中膜蛋白相互作用网络分析中的应用。任海燕团队首先利用遗传密码子扩展的非天然氨基酸技术,在哺乳动物细胞HEK293T中表达特定位点引入交联分子Azi的PD-L1蛋白,并通过流式及免疫荧光染色方法检测改造蛋白的正确定位及功能(图2)。
其中PD-L1-I247Azi捕捉到46 KDa及55 KDa大小的两个共价复合物。研究者利用串联亲和变性纯化复合物,质谱分析并验证到PD-L1-I247Azi的相互作用蛋白。这些差异互作蛋白富集于泛素依赖性ERAD途径、蛋白质折叠、蛋白质去磷酸化的调节、蛋白质稳定化、蛋白酶体蛋白质分解代谢过程和蛋白质定位到质膜的调节等。值得注意的是, DisGeNET疾病富集分析显示这些差异互作蛋白主要富集在肿瘤疾病中(前15个簇中的9个)(图3)。进一步实验表明常在肿瘤细胞中高表达的PGRMC1在肿瘤细胞中与PD-L1互作。与此同时,免疫共沉淀实验显示PGRMC1倾向与非糖基化形式的PDL1结合(图3)。
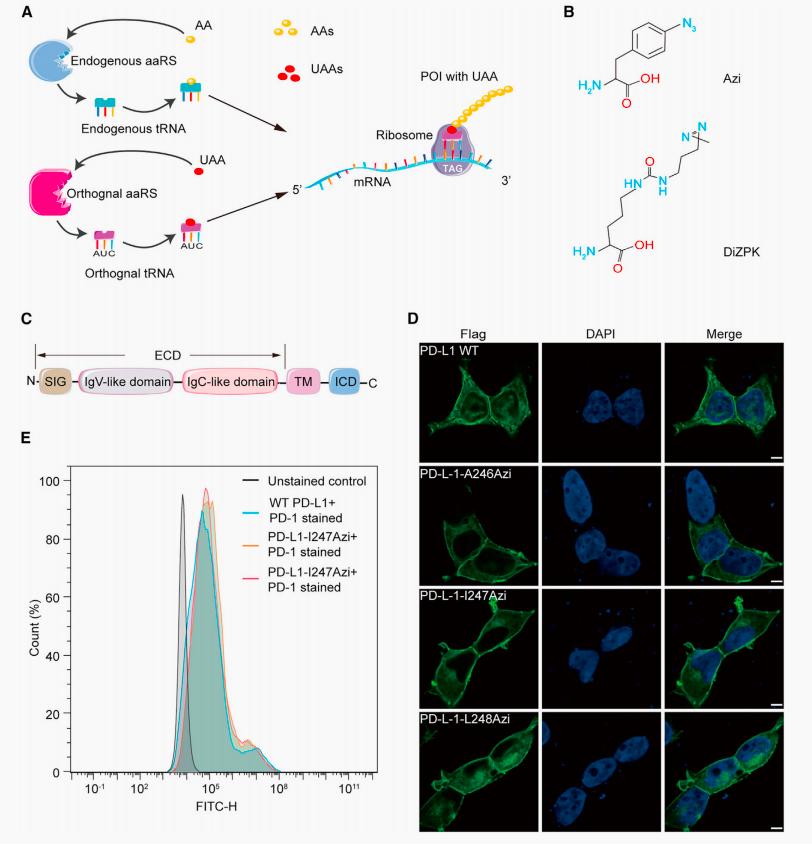
图2 活细胞中引入非天然氨基酸Azi的PD-L1突变体的表达与定位。(A)遗传密码子扩展技术示意图;(B)非天然氨基酸Azi和DiZPK结构示意图;(C)PD-L1结构示意图;(D)Azi不影响PD-L1细胞膜定位;(E)Azi不影响PD-L1与PD-1结合。
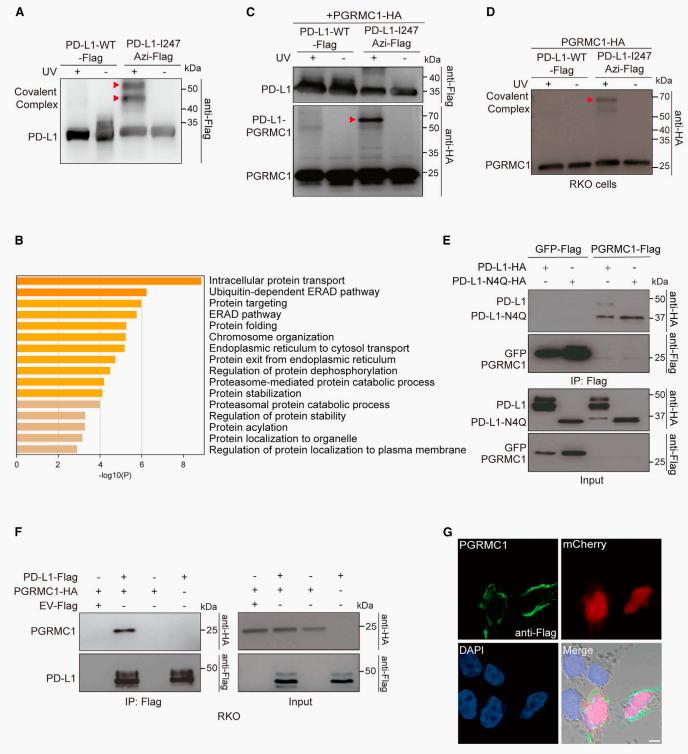
图3 蛋白质组学分析与PD-L1互作蛋白的鉴定。(A)PD-L1-I247Azi 共价复合物的捕获;(B)GO富集分析PD-L1 WT vs PD-L1-I247Azi互作差异蛋白;(C-D)紫外交联验证PD-L1-I247Azi与PGRMC1共价复合物;(E-F)免疫共沉淀实验验证PD-L1-Flag与PGRMC1-HA存在互作;(G)免疫荧光显示Flag-PGRMC1定位于细胞质膜。
接下来,研究者利用shRNA敲低了RKO细胞和MDA-MB-231细胞的PGRMC1,蛋白免疫印迹及免疫荧光显示PD-L1总蛋白表达以及细胞膜表达水平均下降。在PGRMC1敲低细胞中回补PGRMC1后,PD-L1蛋白表达水平恢复。同时,敲低PGRMC1也降低了肿瘤细胞与PD-1的结合能力,提高了T细胞介导的杀伤力。另外,PGRMC1 敲低后并不会影响肿瘤细胞中蛋白MHC-I的表达(图4)。总而言之,研究者证实了PGRMC1特异地正调节癌症细胞中PD-L1的表达以减轻T细胞毒性。
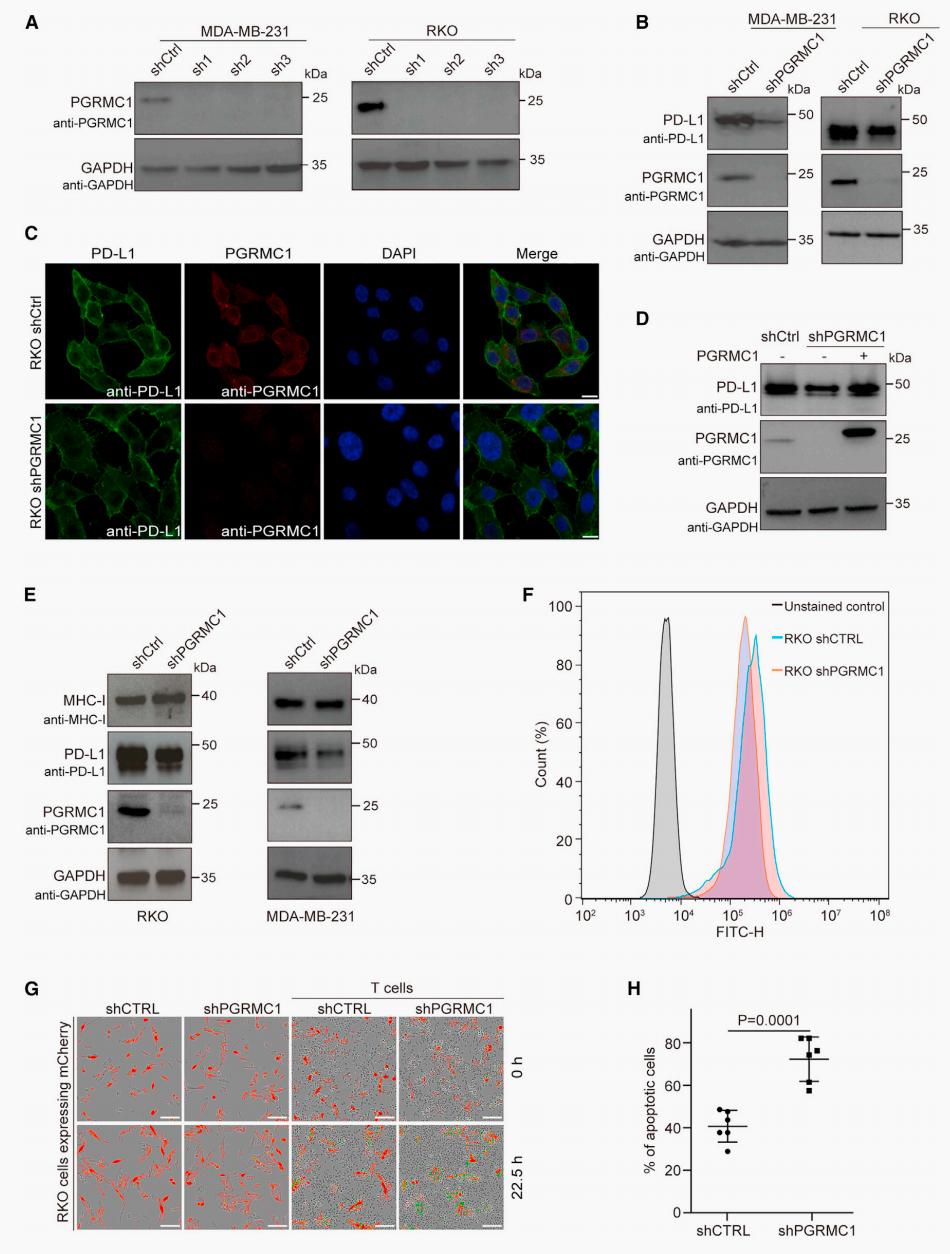
图4 PGRMC1是PD-L1的正调控蛋白。(A)RKO细胞和MDA-MB-231细胞敲低PGRMC1;(B-C)PGRMC1在肿瘤细胞中正调控PD-L1的表达;(D)PGRMC1 KD导致的PD-L1表达下调可被PGRMC1回补恢复;(E)PGRMC1 KD不会影响肿瘤细胞MHC-I表达;(F)PGRMC1 KD后肿瘤PD-1结合能力降低;(G-H)PGRMC1 KD提高T细胞对肿瘤细胞的杀伤率。
值得注意的是,研究者发现PGRMC1偏向与非糖基化PD-L1结合。随后的实验也证实在PGRMC1敲低的细胞中,非糖基化PD-L1-N4Q与GSK3β 的相互作用增强。蛋白酶体抑制剂可以有效抑制PGRMC1敲低导致的PD-L1表达水平降低,但自噬溶酶体抑制剂CQ不能达到相同的效果。并且, PGRMC1敲低同样导致GSK3β 的下游调控蛋白β-TrCP与PD-L1-N4Q的相互作用增强。除此之外,在PGRMC1敲低细胞中,PD-L1的泛素水平也显著增加(图5)。以上结果表明,PGRMC1通过调节GSK3ß介导PD-L1降解来发挥作用。
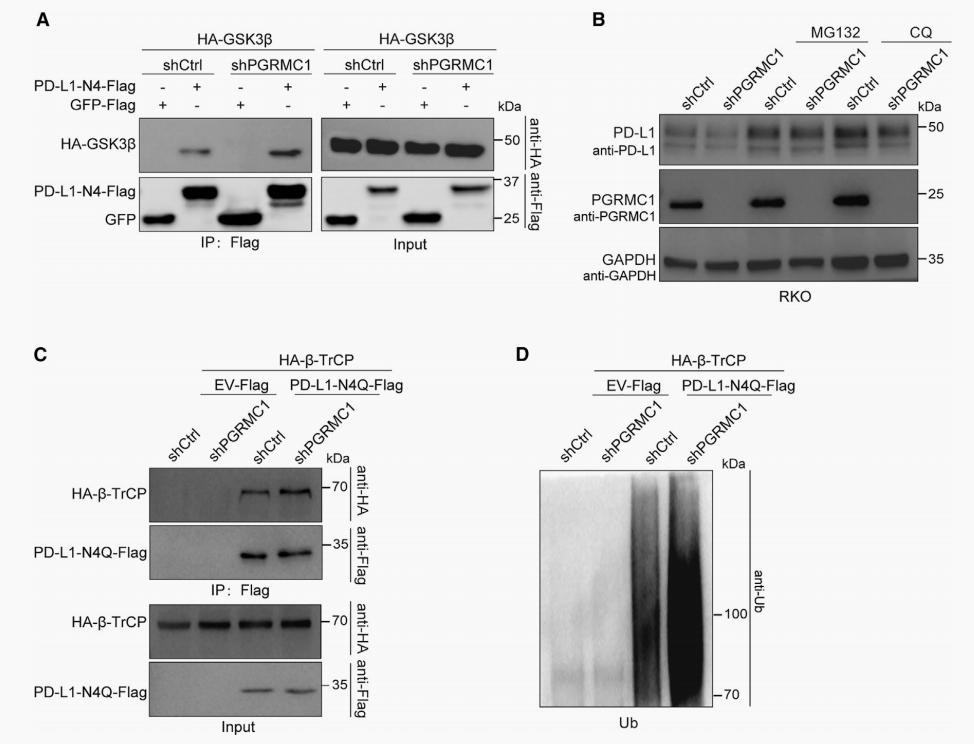
图5 PGRMC1通过GSK3β通路介导PD-L1降解。(A)PRMC1 KD细胞中GSK3β与PD-L1-N4Q互作增强;(B)MG132抑制了PGRMC1介导的PD-L1蛋白降解;(C)PRMC1 KD细胞中β-Trcp与PD-L1-N4Q互作增强;(D)PGRMC1 KD细胞中PD-L1的泛素水平增加。
综上所述,该研究利用遗传密码子拓展技术编码交联分子,捕捉了PD-L1-I247Azi的相互作用蛋白组,鉴定并阐释了PGRMC1通过GSK3β-β-Trcp调控PD-L1表达,从而影响了肿瘤细胞与PD-1的结合能力和T细胞介导的免疫逃逸的机制。此外,遗传编码扩展介导共价交联方法也可用于其他跨膜蛋白相互作用伙伴的发现与鉴定,拓展遗传编码光交联分子的巨大潜力。
作者专访
Cell Press细胞出版社特别邀请任海燕研究员进行了专访,请她为大家进一步详细解读。
CellPress:
首先,请您简要介绍下为什么会选择膜蛋白PD-L1作为研究对象?
任海燕研究员:
蛋白质组中跨膜和膜连接蛋白占30%以上,其在细胞中发挥着关键作用。使用传统方法鉴定膜蛋白的相互作用伴侣是极具挑战性的。最近被广泛应用的邻近标记系统为传统方法提供了强有力的补充。尽管功能强大,但邻近标记系统的标记效率是靶氨基酸依赖和酶位置依赖的。邻近标记酶和靶氨基酸在复合物内的取向和拓扑结构可能会阻碍它们的性能。对于一些蛋白来说,邻近标记酶可能会影响它们的定位和功能。比如我们发现直接在PD-L1 N端引入邻近标记酶阻碍其细胞膜定位。癌细胞表面的PD-L1与T细胞表面程序性细胞死亡1蛋白(PD-1)相互作用,协助癌细胞逃避T细胞介导的免疫监测。PD-1/PD-L1靶向免疫疗法在临床实践中取得了显著成功。然而,对PD-1/PD-L1疗法的耐药性在患者中很常见。深入了解PD-L1的调节机制可能为癌症提供新的治疗策略,因此我们课题组便以PD-L1为切入点开展了相关研究。
CellPress:
您认为此研究的亮点是什么?
任海燕研究员:
膜蛋白跨膜结构域的疏水性和苛刻的提取条件极可能破坏蛋白质-蛋白质相互作用。将蛋白互作转化为共价键,如利用小分子交联剂,将有助于蛋白复合物经历苛刻的提取条件。常规小分子交联剂通常在细胞裂解后发挥作用,主要局限应用于具有稳定相互作用的大蛋白复合物。此外,常规加入的小分子交联剂不能实现在感兴趣目的蛋白质及其互作伴侣之间特异性形成共价键。遗传编码的光交联剂来捕获PD-L1的互作伴侣,克服了上述困难为PD-L1添加了新的调控因子,并证明PGRMC1通过调节癌细胞中GSK3ß介导的泛素降解途径来积极调控PD-L1表达。
CellPress:
您的团队有何进一步的研究计划?
任海燕研究员:
PD-L1-I247Azi其实捕捉到大小为46 KDa及55 KDa的两个共价复合物。除了本研究中提到的PGRMC1作为PD-L1的正调控因子,我们也注意到了其它一些可能的PD-L1调控蛋白,目前相关研究正在进行中。此外,在PD-L1其他的位点引入Azi或者更长侧链/其他官能团的共价交联分子将进一步扩充我们对PD-L1互作伙伴网络的认知。另外,尝试在癌症细胞系中或在其他条件下(如与T细胞共培养或在不同的微环境中)捕捉PD-L1复合物也非常有意义。
作者介绍
任海燕研究员
任海燕,四川大学/华西医院生物治疗国家重点实验室研究员。以通讯作者/第一作者发表研究成果于Cell, Nature Methods, Elife, Cell Reports, Cell Chem Bio等国际知名期刊。
相关论文信息
▌论文标题:
Genetically incorporated crosslinkers identify regulators of membrane protein PD-L1 in mammalian cells
▌论文网址:
https://www.cell.com/cell-chemical-biology/fulltext/S2451-9456(23)00232-5
▌DOI:
https://doi.org/10.1016/j.chembiol.2023.07.004

2021年,Cell Press推出了“集体审稿”(Community Review)模式,作者可以选择多本Cell Press旗下期刊同时提交稿件。“集体审稿”模式可以增加您的文稿在Cell Press得到正式同行评审的可能性,同时避免一轮又一轮的评审,缩短从投稿到正式出版所需的时间。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




