- +1
Nature:首次实现大规模评估蛋白质折叠稳定性,推动蛋白质设计及相关疾病研究
原创 生物世界 生物世界

撰文丨王聪
编辑丨王多鱼
排版丨水成文
众所周知,“结构决定功能”,不能正确折叠或保持其三维结构,会破坏蛋白质功能并导致疾病发生。深入了解蛋白质折叠稳定性是如何维持的,将进一步阐明与蛋白质错误折叠有关的疾病。然而,目前仍然缺少有效和大规模的方法来评估蛋白质折叠稳定性。
2023年7月19日,西北大学、华盛顿大学、哈佛大学、索邦大学、魏茨曼研究所以及东京大学的研究人员合作,在国际顶尖学术期刊 Nature 上发表了题为:Mega-scale experimental analysis of protein folding stability in biology and design 的研究论文。
该研究开发了一种新的高通量方法来评估蛋白质折叠稳定性——cDNA显示蛋白水解(cDNA display proteolysis),可以在一次实验中评估近100万种蛋白质的折叠稳定性。
该研究提供前所未有的关于蛋白质稳定性的信息,帮助分析蛋白质序列中特定突变的影响,确定设计蛋白质稳定性的决定因素,推进未来蛋白质设计方法的开发。该研究还可能会促进蛋白质折叠新预测模型的发展,进一步加深我们对蛋白质错误折叠相关疾病的理解。

DNA测序技术,以及人工智能(AI)技术的进步,正在大规模地提供对蛋白质序列和结构的见解,让我们能够仅从编码蛋白质的DNA序列预测出蛋白质的三维结构。然而,在这些结构中,蛋白质折叠的热力学驱动力是不可见的,并且在很大程度上仍然是未知的。
这些不可见的驱动蛋白质折叠的热力学可以导致疾病、塑造蛋白质进化、直到蛋白质工程。因此,我们需要开发新的方法来揭示每个序列和结构背后的这些热力学。
在这项研究中,研究团队提出了cDNA显示蛋白水解(cDNA display proteolysis),研究团队将蛋白质附着在它们自己对应的cDNA上。利用DNA文库,生成了大量这些蛋白质-DNA复合物,并用破坏未折叠蛋白质的酶对它们进行处理。这些完整的蛋白质在酶处理期间能够保持其折叠结构,然后通过DNA测序进行鉴定。这种方法使得研究团队能够在单个试管中评估多达900000个蛋白质序列的稳定性。
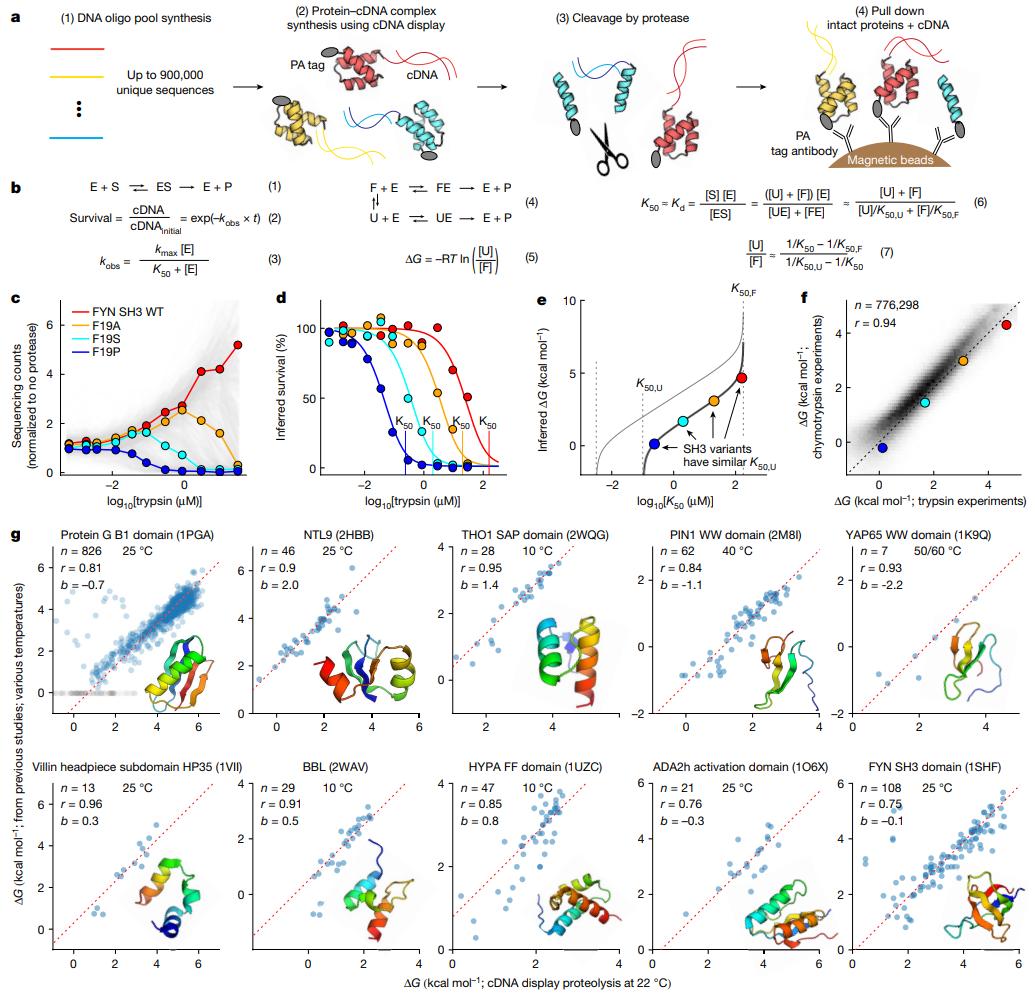
为了研究蛋白质序列中的单个元素如何影响折叠稳定性,研究团队使用这种方法分析了一系列天然和设计的蛋白质结构域。从总共180万次测量中,研究团队展示了一套大约77.6万个高质量的折叠稳定性,涵盖了331个天然和148个从头设计的长度为44-72个氨基酸的蛋白质结构域的所有单氨基酸突变和选定的双氨基酸突变。
使用这个大型数据集,研究团队量化了:1)影响氨基酸功能值的环境因素;2)蛋白质位点之间的热力学耦合(包括意料之外的相互作用);3)进化氨基酸偏好与蛋白质折叠稳定性之间的全局分化。
研究团队还探索了这种方法如何识别设计蛋白质中的稳定性决定因素并评估设计方法。cDNA显示蛋白水解的方法具有快速、准确,且有独特的可扩展性,有望揭示氨基酸序列如何编码折叠稳定性的定量规则。
以前评估蛋白质稳定性的方法仅限于评估单个蛋白质序列,而该研究开发的cDNA显示蛋白水解方法允许在单个实验中评估大量蛋白质,提供前所未有的关于蛋白质稳定性的信息,帮助分析蛋白质序列中特定突变的影响,确定设计蛋白质稳定性的决定因素,推进未来蛋白质设计方法的开发。该方法还可能会促进蛋白质折叠新预测模型的发展,进一步加深我们对蛋白质错误折叠相关疾病的理解。
论文链接:
https://www.nature.com/articles/s41586-023-06328-6
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




