- +1
【科技前沿】PNAS丨娄继忠/许琛琦/陈伟合作揭示T细胞抗原刺激信号放大与衰减机制
T细胞免疫应答具有超高灵敏性,能够从海量的“自身抗原”中区分“非自身抗原”,并迅速做出充分又可控的免疫应答反应。因此抗原刺激信号必然存在快速放大以及衰减的过程,形成闭环。TCR复合体是T细胞膜表面的抗原受体,抗原刺激后TCR快速地从nanocluster(纳米簇)变成microcluster(微簇),TCR在微簇中高度磷酸化并往下传递活化信号,形成集聚效应来放大抗原刺激信号;随后,TCR自外周向中心区域聚集组装成免疫突触的中心部分(cSMAC),TCR磷酸化变弱,进入信号衰减期。TCR的成簇以及免疫突触的组装对抗原免疫应答十分关键,然而其机制仍不够清楚【1】。
TCR复合体是一个八聚体结构,由TCRα/TCRβ、CD3ε/CD3δ、CD3ε/CD3γ以及CD3ζ/CD3ζ四个二聚体组装而成,一般认为TCRα和TCRβ亚基的胞内域较短不具备信号传递能力,TCR复合体主要通过CD3ζ向下游传递激活信号,而其他亚基的具体功能则不清楚。许琛琦团队前期研究发现CD3ε能通过其碱性氨基酸富集序列(Basic Rich Sequence,BRS)和酪氨酸激酶Lck的N端的一段无序结构的独特区(Unique Domain,UD)发生静电相互作用,从而促进Lck对整个TCR复合体的磷酸化过程【2】。此外,CD3ε在磷酸化之后可以招募Csk激酶来抑制Lck活性,进而对TCR信号进行负调控【3】。这些结果提示CD3ε具有关键的信号调控功能。
2023年7月4日,中国科学院生物物理研究所娄继忠团队、中国科学院分子细胞卓越创新中心许琛琦团队以及浙江大学医学院/良渚实验室陈伟团队合作在PNAS上发表了题为 Self-programmed dynamics of T cell receptor condensation的研究文章,发现TCR复合体中CD3ε的胞内域可以与下游的酪氨酸激酶Lck发生相分离,相分离不仅增强了TCR的磷酸化,而且进一步促进了Lck的激活,这种自我促进的相分离系统可以帮助T细胞仅需要结合少量的特异性抗原即可快速的活化;同时发现了磷酸化CD3ε对Csk的招募可以破坏TCR/Lck的相分离进而抑制T细胞的过度活化。因此通过CD3ε介导的相分离-解聚这个过程,TCR完成了信号的放大和衰减这一闭环。

研究首先利用体外的重组二维膜系统(Supporting Lipid Bilayer,SLB)对TCR的四种CD3亚基的胞内域进行了筛选,发现只有CD3ε亚基的胞内域与Lck可以在二维膜上发生相分离,其驱动机制是CD3ε-BRS与Lck的静电相互作用力。为了研究CD3ε/Lck相分离的生理功能,研究者们通过体外重组液滴以及细胞激活实验检测了相分离对CD3ε、CD3ζ以及Lck的磷酸化影响。结果显示相分离极大的增强了CD3ε以及CD3ζ的磷酸化以及Lck的激活水平,而且CD3ε/Lck相分离的液滴更倾向于招募激活型的Lck。细胞实验表明,突变CD3ε-BRS区使得TCR微簇形成明显削弱,从而影响TCR活化。这些结果显示CD3ε/Lck相分离是TCR微簇形成的分子基础,促进了抗原刺激信号的放大。
与微簇区不同的是,TCR进入cSMAC后不再与活化态Lck有明显的共定位,提示相分离机制在这个阶段被终止。体外重组以及免疫荧光的实验结果显示,磷酸化后的CD3ε可以招募Csk,通过分子间竞争来破坏CD3ε/Lck的相互作用以及相分离。同时,Csk还可以通过磷酸化Lck的抑制性位点使其失去活性。突变CD3ε的酪氨酸位点不影响CD3ε/Lck的相分离,但是会阻止Csk的招募,从而使得相分离得以维持,在细胞水平体现为TCR信号的增强。这些结果表明Csk介导的解聚过程是cSMAC中TCR信号终止的分子基础,对抗原刺激信号形成有效的控制。
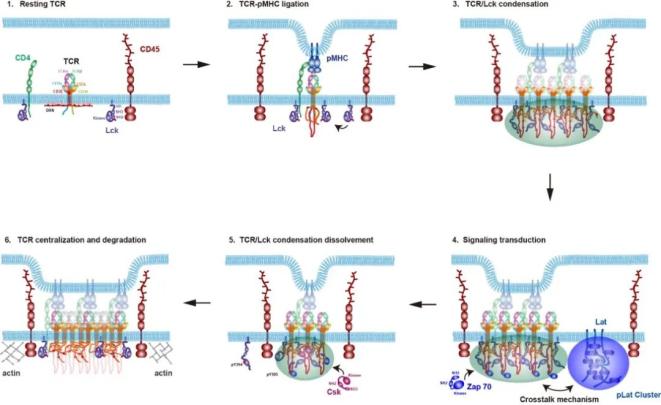
图1:TCR自编程调控机制。
综上,该研究发现了TCR通过CD3ε与Lck/Csk顺序相互作用形成一套自编程的聚集以及解聚的机制来调控T细胞激活:即CD3ε通过与Lck的相分离促进TCR成簇以及磷酸化,随着TCR微簇向细胞中心聚集,再通过招募Csk来破坏CD3ε/Lck的相分离进而终止TCR的磷酸化,防止T细胞的过度激活。这种自编程的相分离调控机制可能也适用于其他膜受体的信号传导以及调控。
生物物理所陈辉博士,分子细胞卓越创新中心博士研究生徐心怡,以及浙大医学院第一附属医院肾脏病中心特聘研究员胡炜博士为本文的共同第一作者;娄继忠研究员、许琛琦研究员以及陈伟教授为共同通讯作者;哈尔滨医科大学肿瘤医院娄长杰主任、清华大学刘万里教授以及美国宾夕法尼亚大学姜宁教授也在本项研究中做出了重要贡献。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2217301120
原文链接:
https://doi.org/10.1073/pnas.2217301120
参考文献
1. Lee KH, et al. (2002) T cell receptor signaling precedes immunological synapse formation. Science 295(5559):1539-1542.
2. Li L, et al. (2017) Ionic CD3-Lck interaction regulates the initiation of T-cell receptor signaling. Proc Natl Acad Sci U S A 114(29):E5891-E5899.
3. Wu W, et al. (2020) Multiple Signaling Roles of CD3epsilon and Its Application in CAR-T Cell Therapy. Cell 182(4):855-871 e823.
本文转载自公众号“BioArt”
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【科技前沿】PNAS丨娄继忠/许琛琦/陈伟合作揭示T细胞抗原刺激信号放大与衰减机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




