- +1
Adv Sci:华中科技大学刘钢团队开发肿瘤标志物快速早筛新平台
编辑丨王多鱼
排版丨水成文
随着社会的发展和人们生活水平的不断提高,癌症已发展成为严重危害人们生命的常见病、多发病。世界卫生组织(WHO)指出,如果能早期诊断并及时治疗,大部分的恶性肿瘤是可以治愈的,而早发现是解决癌症防与治的关键中的关键。
生物标志物已被广泛用于早期癌症诊断,以降低发病率和癌症相关死亡。然而,目前的方法可能表现出灵敏度低或非特异性严重,急需开发一种有临床应用前景的超灵敏、高特异性和便携式的肿瘤标志物筛选技术。
近日,华中科技大学生命科学与技术学院刘钢教授团队与量准(武汉)生命科技有限公司黄丽萍博士合作,在 Advanced Science 期刊发表了题为:Nanozyme-Catalyzed Metasurface Plasmon Sensor-Based Portable Ultrasensitive Optical Quantification Platform for Cancer Biomarker Screening 的研究论文。
该研究利用一种低成本、便携的超表面等离子体生物传感器(MetaSPR)与人工纳米酶联用,构建了一种新型超表面等离子体刻蚀免疫传感器,即纳米酶联免疫吸附表面等离子体共振生物传感器(Nano-ELISPR),实现超灵敏和特异性的早期筛查血清中的癌症生物标志物。

在该论文中,研究团队利用金银复合纳米杯阵列MetaSPR生物芯片,成功联用人工纳米酶标记的抗体,通过纳米酶催化TMB显色剂产生oxTMB离子,继而与金银MetaSPR芯片的Ag离子发生可逆的刻蚀反应,从而可通过检测芯片表面蚀刻前后吸收光谱的变化,准确定量肿瘤标志物蛋白的浓度。该检测平台的AFP检测下限<21.74 fM,比市售酶联免疫吸附测定试剂盒低3个数量级。
为了验证平台的通用性,采用AFP、CEA和CA125三种标志物进行定量检测。更重要的是,使用临床样本验证了平台的准确性;与医院结果相比,3种生物标志物均达到较高的敏感性和特异性进行分析。由于其具有快速、易操作和高通量的特点,该平台可促进生物传感在癌症筛查或早期诊断的潜力。
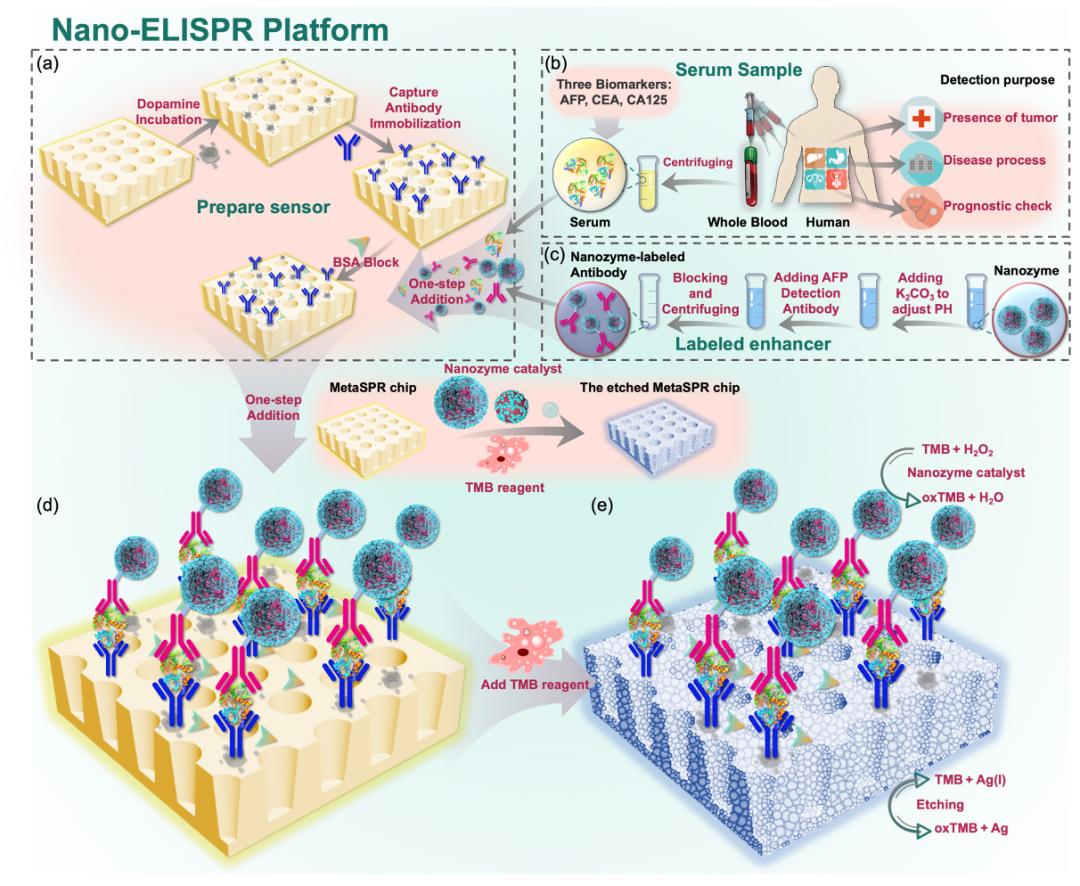
图1:用于检测生物标志物指标的快速、超灵敏Nano-ELISPR平台示意图
为了简化操作流程,研究团队将MetaSPR光学芯片与高通量的96孔板集成,并使用多功能分子分析仪(XLement,WeSPR 100)进行光学信号检测。为了验证MetaSPR芯片的蚀刻效果,研究者将酶标抗体稀释不同浓度梯度后与MetaSPR芯片进行孵育,再加入显色试剂。结果证明了芯片表面的蚀刻效果与酶标抗体浓度正相关。
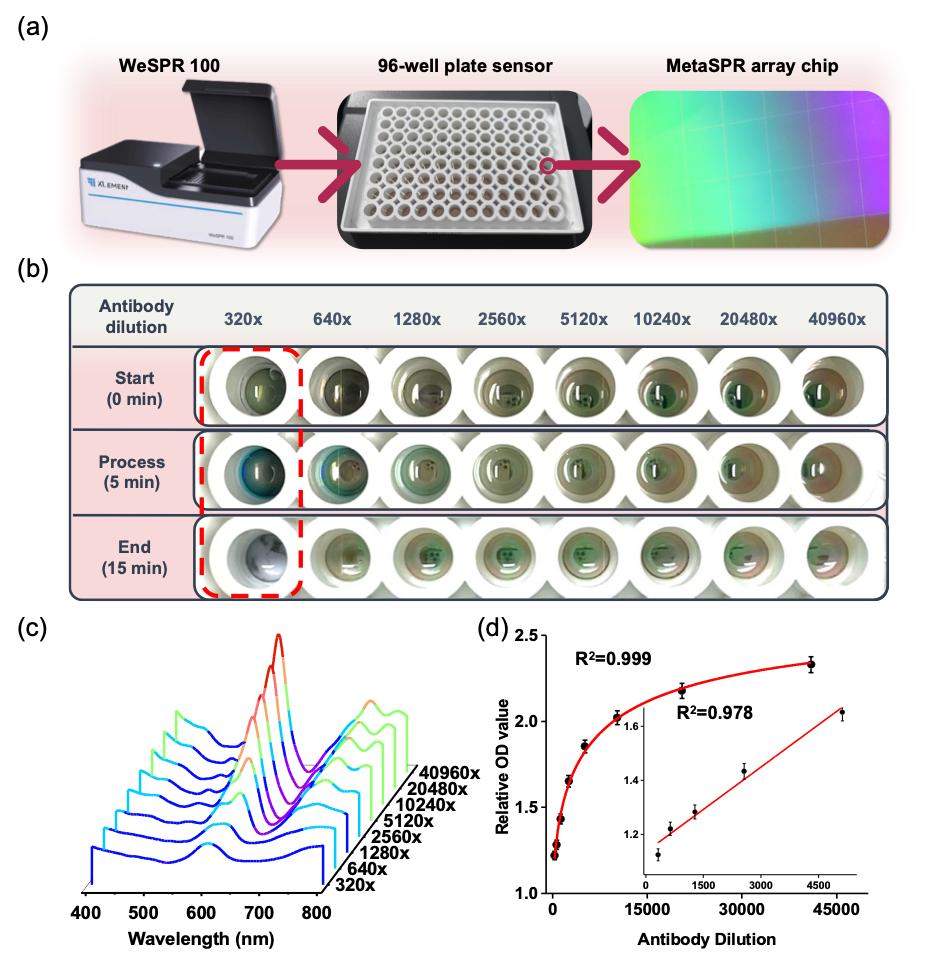
图2:Nano-ELISPR生物传感器检测平台及oxTMB与传感器蚀刻反应的验证
纳米酶的催化性能受外界环境条件的影响较小,化学性质稳定,表面易于修饰,生产成本低于蛋白酶。因此,纳米酶与MetaSPR芯片的联用满足了简单、低成本诊断肿瘤标志物的需求。
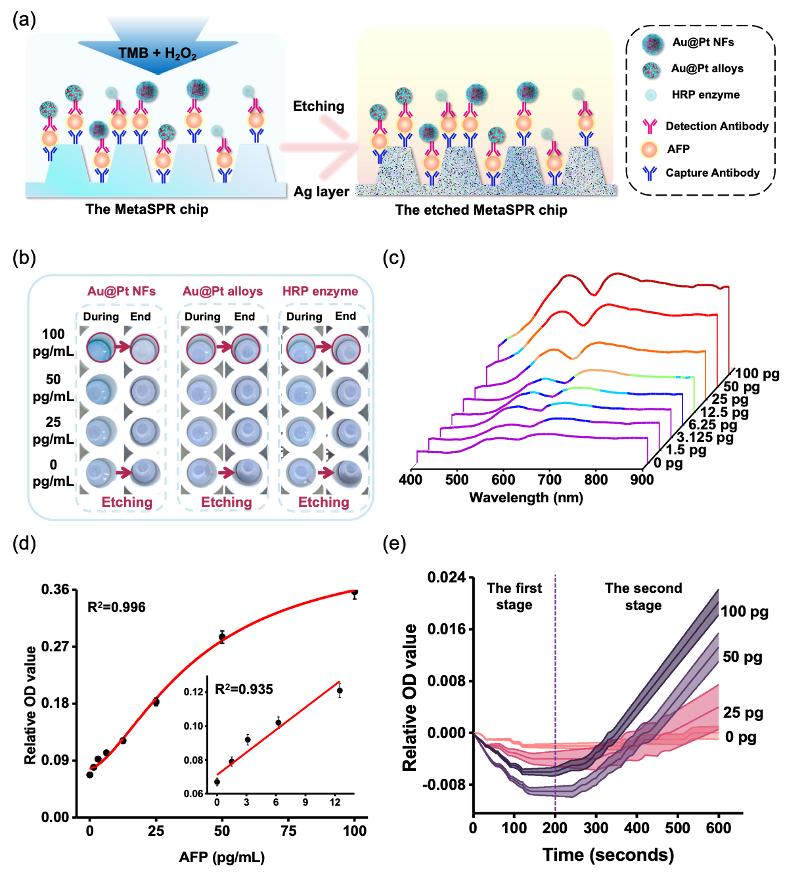
图3:Nano-ELISPR生物传感器检测平台的优化与验证
另外,研究团队比较了商用ELISA和高灵敏度快速nano-ELISPR生物传感器的整个检测过程。在传统的ELISA检测中,目标分子被微孔板上的特异性抗体捕获,然后与标记了D-Ab的酶进行夹心反应。检测信号通过酶底物转化为有色分子而产生,并使用酶标仪测量吸光度来定量。反应时间至少需要3h。然而,nano-ELISPR生物传感器平台将加样量减少至~20μL、反应时间缩短至40min、同时提高了检测灵敏度。与一步式快速ELISA相比,nano-ELISPR采用的纳米酶催化剂减少了HRP不稳定引起的非特异性结合,提高了生物标志物检测的灵敏度和稳定性。通过临床人血清样本进行不同肿瘤标志物指标定量检测验证,进一步证明所建立的检测真实样本策略的可行性和实用性。
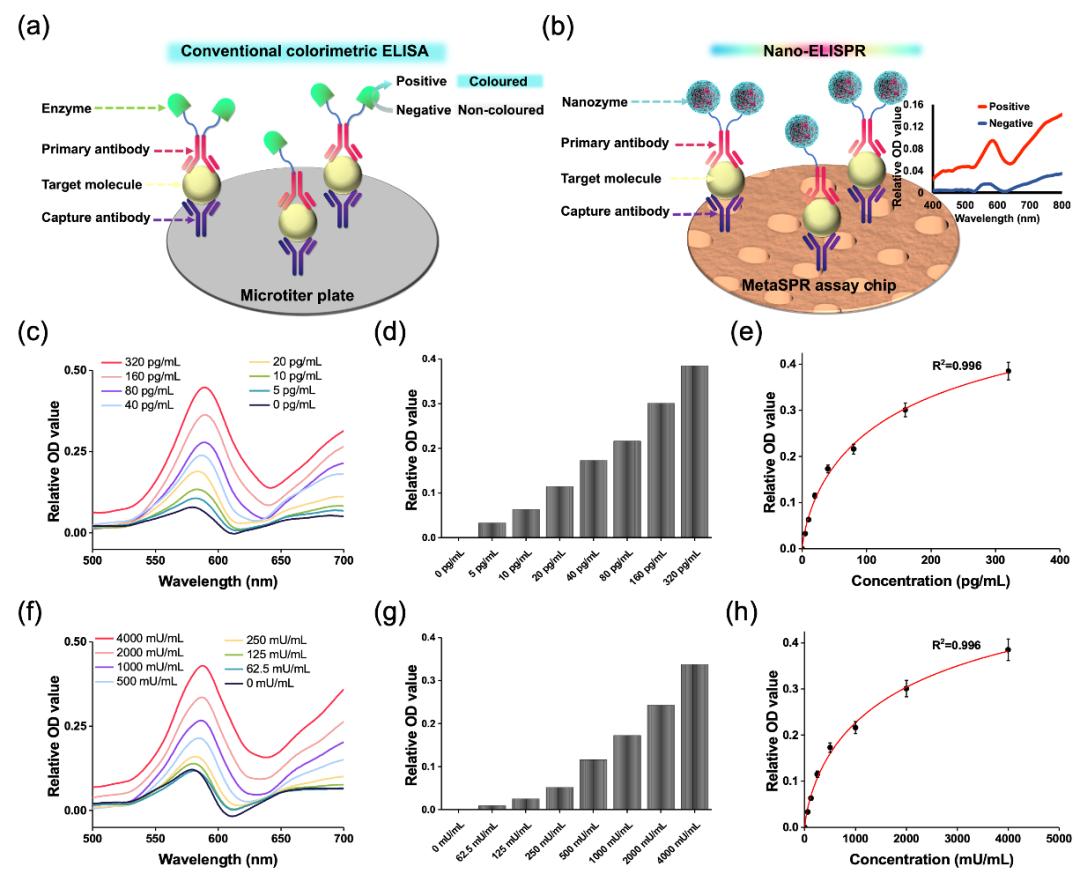
图4:验证Nano-ELISPR生物传感器检测平台准确性
这项研究表明,这种小型化、高灵敏度、高特异性的nano-ELISPR生物传感器可以作为一种潜在的早期检测方法,用于监测身体健康状况,特别是那些与临床诊断应用和即使检测相关的应用。不仅适用于癌症生物标志物,还适用于其他化学和生物过程。
华中科技大学生命科学与技术学院刘钢教授和量准(武汉)生命科技有限公司黄丽萍博士为论文共同通讯作者,华中科技大学生命科学与技术学院2020级博士研究生李睿和2021级博士研究生樊洪利为论文共同第一作者。该研究得到了中国国家自然科学基金(NSFC)、国家重点研发计划和中央高校基础科研项目资助。
论文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202301658
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




