- +1
Nature:发现衰老细胞的积极一面,华人学者为脱发带来全新治疗方法
原创 生物世界 生物世界 收录于合集 #抗衰老 129个

撰文丨王聪
编辑丨王多鱼
排版丨水成文
目前全世界有数以亿计的男性,女性甚至是儿童饱受脱发困扰,遗传、衰老、分娩、癌症治疗、烧伤以及压力等都可能导致脱发。脱发虽然不会造成严重的健康问题,但是因为影响美观,会导致个人形象问题,并因此带来情绪创伤甚至抑郁。
脱发的原因众多,其中最主要的是雄激素源性脱发(雄脱),占比超过90%,尽管受脱发困扰的群体如此之大,但治疗脱发的方法却十分有限。药物治疗(米诺地尔、非那雄胺)、手术治疗(植发)、物理疗法(中医针灸、低频激光疗法)等方法,并不能长期阻止脱发,更不能实现毛囊再生。而FDA 最近批准的由礼来/Incyte开发的口服脱发药物巴瑞替尼(baricitinib),只能治疗斑秃,斑秃在脱发中的占比不到2%。
2023年6月21日,加州大学欧文分校 Maksim Plikus、Wang Xiaojie 等人在 Nature 期刊发表了题为:Signalling by senescent melanocytes hyperactivates hair growth 的研究论文【1】。
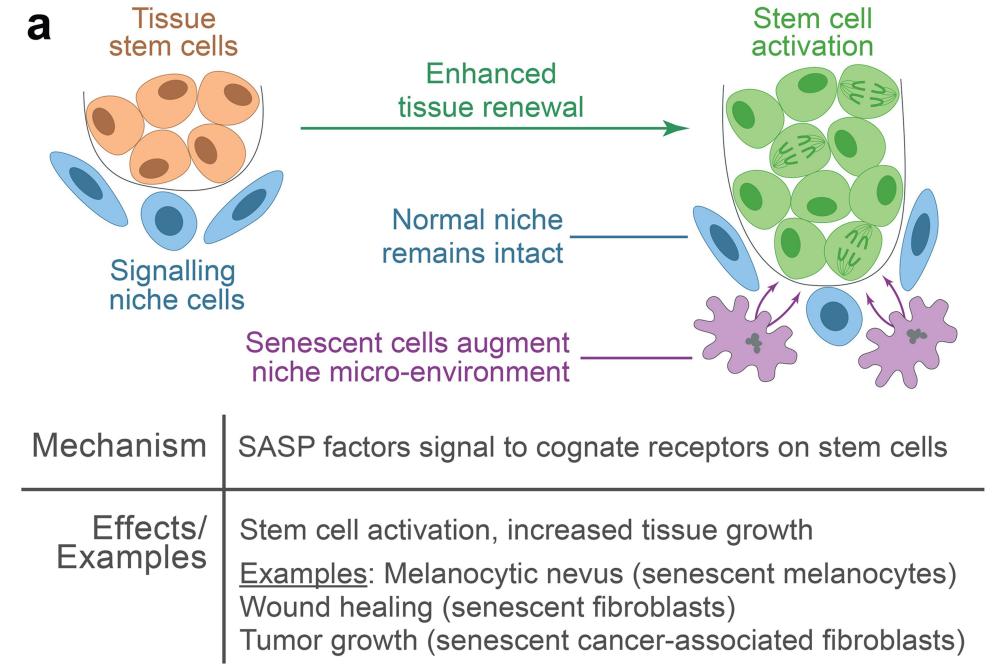
该研究发现,皮肤痣中聚集了大量的衰老色素细胞,但却显示出非常强劲的毛发生长能力,而这种能力依赖于骨桥蛋白(Osteopontin)及其受体CD44之间的相互作用。这一发现可能会为最常见的脱发雄激素性脱发带来全新的疗法,也确定了衰老细胞及其分泌组可作为再生疾病的一个有吸引力的治疗靶点。

论文通讯作者 Maksim Plikus 教授表示,这项研究发现,衰老的色素细胞会产生大量叫做骨桥蛋白(Osteopontin)的特殊信号分子,这种分子会导致通常处于休眠状态和小型的毛囊激活其中的干细胞,从而长出又长又粗的毛发。衰老细胞通常被认为不利于再生,并被认为是推动衰老过程的原因,因为它们在全身组织中积累,但这项研究清楚地表明,细胞衰老也有积极的一面。
毛囊是毛发的基本单位,毛囊的生长受干细胞激活的良好调控,这些细胞的分裂,使毛囊以周期性的方式产生新的毛发。在每一轮毛发生长之后,都有一段休眠期,在此期间毛囊干细胞(HFSC)保持休眠状态,直到下一个周期开始。
我们很多人都见到过,人类的黑色细胞性皮肤痣经常表现出毛发过度生长。这提示了这些皮肤痣中的毛发干细胞过度活跃。
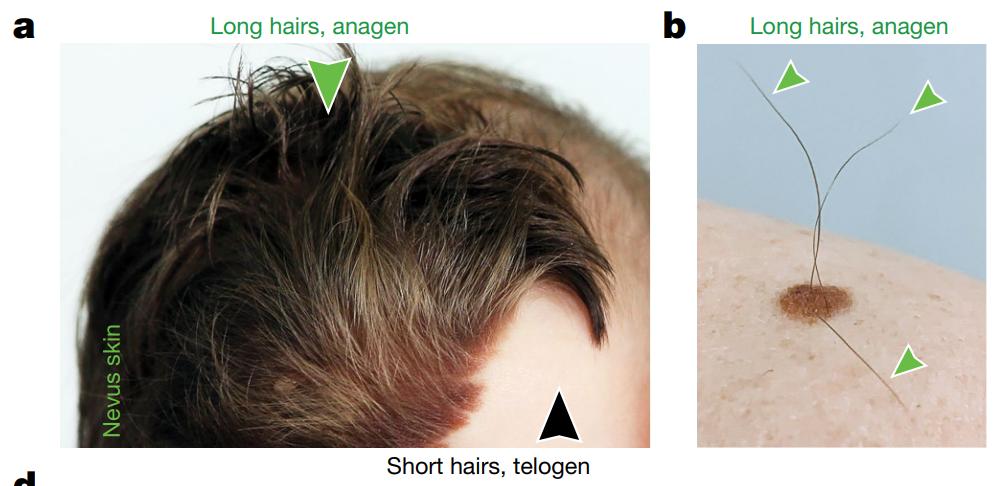
这一现象背后的机制是什么?能够为开发脱发治疗方法带来哪些新的见解?
研究团队对皮肤痣小鼠模型进行了研究,这些小鼠皮肤痣具有过度激活的毛发干细胞,并显示出毛发生长加速,与人类毛发皮肤痣的临床观察结果非常相似。对衰老色素细胞和附近的毛囊干细胞的进一步详细分析表明,前者产生了高水平的骨桥蛋白信号分子,在骨桥蛋白和其受体CD44之间的相互作用下,毛囊干细胞被激活,导致毛发健壮生长。
为了证实骨桥蛋白和CD44在这一过程中的主导作用,研究了敲除这两个基因中的任何一个的小鼠模型,结果显示,它们的毛发生长明显变慢。此外,研究团队还证实了骨桥蛋白在人类的毛发皮肤痣中过度表达,并刺激人类毛囊新生。
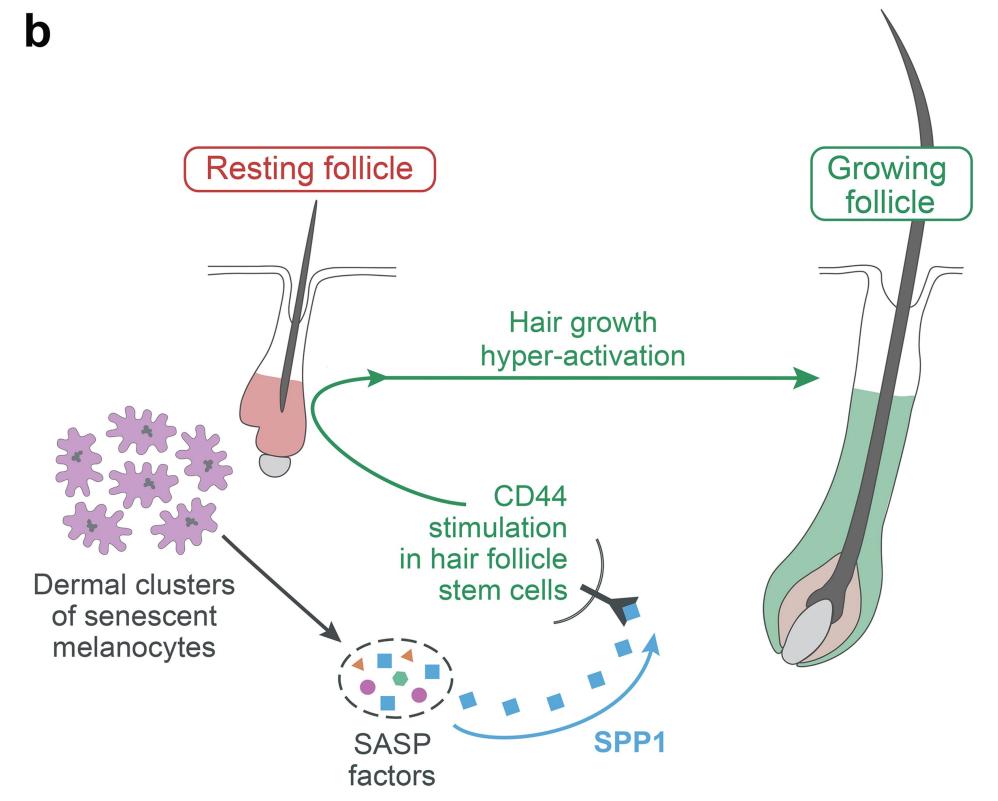
衰老细胞诱导皮肤痣毛发生长的模型,SPP1是衰老细胞分泌组中的核心因子
论文第一和共同通讯作者 Wang Xiaojie 博士表示,这些发现为衰老细胞和自身干细胞之间的关系提供了定性的新见解,并揭示了衰老细胞对毛囊干细胞的积极作用,随着我们了解的越来越多,这些信息可能被用来开发针对衰老细胞特性的新疗法,并治疗各种再生疾病,包括常见的脱发。
最后,研究团队表示,除了骨桥蛋白和CD44,团队还在深入研究毛发皮肤痣中存在的其他分子及其诱导毛发生长的能力。这些持续研究很可能会发现更多有效的毛发生长的激活剂。
总的来说,这项对毛发皮肤痣这种特殊皮肤状况的研究确定了组织驻留衰老细胞对成年人干细胞的独特调控机制。这些发现对帮助理解干细胞生态位调控机制和开发再生疾病的新疗法具有深远意义。
值得一提的是,2022年6月30日,加州大学欧文分校 Maksim Plikus 教授团队与中南大学湘雅医院李吉教授团队合作,在 Cell 子刊 Developmental Cell 上发表了题为:Hedgehog signaling reprograms hair follicle niche fibroblasts to a hyper-activated state 的研究论文【2】。
该研究发现了一种与毛发生长相关的Hedgehog信号通路的下游分泌因子——SCUBE3。在正常小鼠皮肤中,SCUBE3 只在生长的真皮乳头(dermal papilla)中表达,而在休眠期的毛囊中不表达,微量注射SCUBE3蛋白足以激活新的毛发生长,这为雄性激素源性脱发找到一个潜在解决方法。

论文链接:
1. https://www.nature.com/articles/s41586-023-06172-8
2. https://doi.org/10.1016/j.devcel.2022.06.005
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




