- +1
Nature子刊:雷群英团队发现BCAT1一个功能获得性突变促进肿瘤发生发展
编辑丨王多鱼
排版丨水成文
研究表明,肿瘤发生发展导致代谢重塑来适应体内营养/代谢应激,促进细胞恶性转化和肿瘤演进,例如氨基酸代谢在许多肿瘤中失调。支链氨基酸(BCAA)包括亮氨酸、异亮氨酸和缬氨酸,BCAA代谢的变化特异性地影响肿瘤细胞状态以及罹患恶性肿瘤个体的全身代谢,如支链氨基酸转氨酶1或2(BCAT1、BCAT2)催化BCAA和其分解代谢产物支链α-酮酸(BCKA)的可逆反应,BCAT1和BCAT2的表达增加与不同肿瘤的生长和侵袭等恶性表型有关。
支链氨基酸不能在人体中合成,但它们既可以被高度可逆的BCAT1和2分解代谢,为肿瘤细胞提供能量,也可以逆向由BCKA转化为亮氨酸激活mTOR信号通路,从而造成体内不同的细胞或组织器官间的代谢串话,促进肿瘤生长。
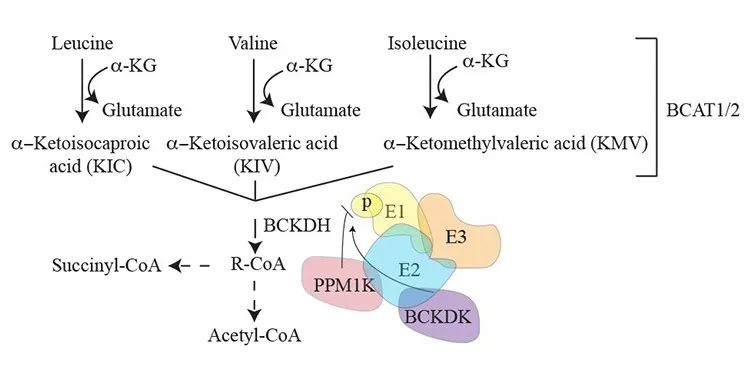
图片来自:Emerging Roles for Branched-Chain Amino Acid Metabolism in Cancer. Cancer cell, 37(2), 147–156
2023年6月19日,复旦大学上海医学院雷群英团队在 Nature 子刊 Nature Metabolism上发表了题为:Enhanced BCAT1 activity and BCAA metabolism promotes RhoC activity in cancer progression的研究论文。
该研究发现并鉴定了肿瘤细胞中BCAT1的一个功能获得性突变,进而揭示了BCAA通过细胞内代谢的区室化调控和代谢感知,作用于下游RhoC介导的小G蛋白信号通路,影响细胞迁移和增殖,对靶向依赖BCAA的肿瘤诊疗具有潜在的转化意义。

该研究团队此前的研究发现了BCAA-BCAT2代谢轴在肥胖和KRAS突变驱动的胰腺导管腺癌发生中的重要作用,阐明了BCAT2介导的分解代谢不依赖于mTOR信号通路在肥胖和胰腺癌发生发展的分子机制,并提出了靶向干预的新策略(Nature Cell Biology 2020;National Science Review 2021,Nature Metabolism 2022)。基于此,团队进一步探索BCAA代谢在肿瘤发生发展过程中的功能。
该研究分析肿瘤细胞系百科全书(CCLE)数据库中BCAA代谢通路关键代谢酶的突变频率时发现,BCAT1在密码子61处发生谷氨酸(Glu,E)转变为丙氨酸(Ala,A)的高频率突变——BCAT1E61A,突变细胞系主要集中于白血病和胃癌细胞。对临床胃癌样本中进行测序确认,该突变的发生率约为2.8%,病理分析结果显示携带BCAT1E61A突变的肿瘤组织弥散性胃癌。
通过体外酶活,代谢组学及代谢流等分析,发现BCAT1E61A增强酶活性和BCAA分解代谢,促进细胞生长和迁移,并有助于肿瘤的发展。进一步蛋白组学研究发现,BCAT1直接与小G蛋白RhoC相互作用,导致RhoC活性升高。值得注意的是,体外数据及分子模拟显示,BCAA下游代谢产物BCKA直接与RhoC结合并促进其活性。
随后,研究发现BCAT1敲除抑制的细胞迁移可以通过表达BCAT1/BCAT1E61A或添加BCKA来回补。利用已获美国食品药品监督管理局(FDA)批准的药物库, 筛选发现血管紧张素II受体拮抗剂坎地沙坦可作为BCAT1E61A的抑制剂,在体外抑制RhoC活性和肿瘤细胞迁移,并在体内阻止肿瘤细胞的小鼠腹膜转移。有意思的是,研究团队使用CRSPR-Cas9系统进行基因编辑,建立了敲入点突变Bcat1KI/KI 转基因小鼠。在胃癌、肝癌及肺癌模型中,BCAT1E61A都显著促进肿瘤发生发展。更为重要的是,有6只在15月龄的Bcat1KI/KI转基因小鼠自发形成肝癌。
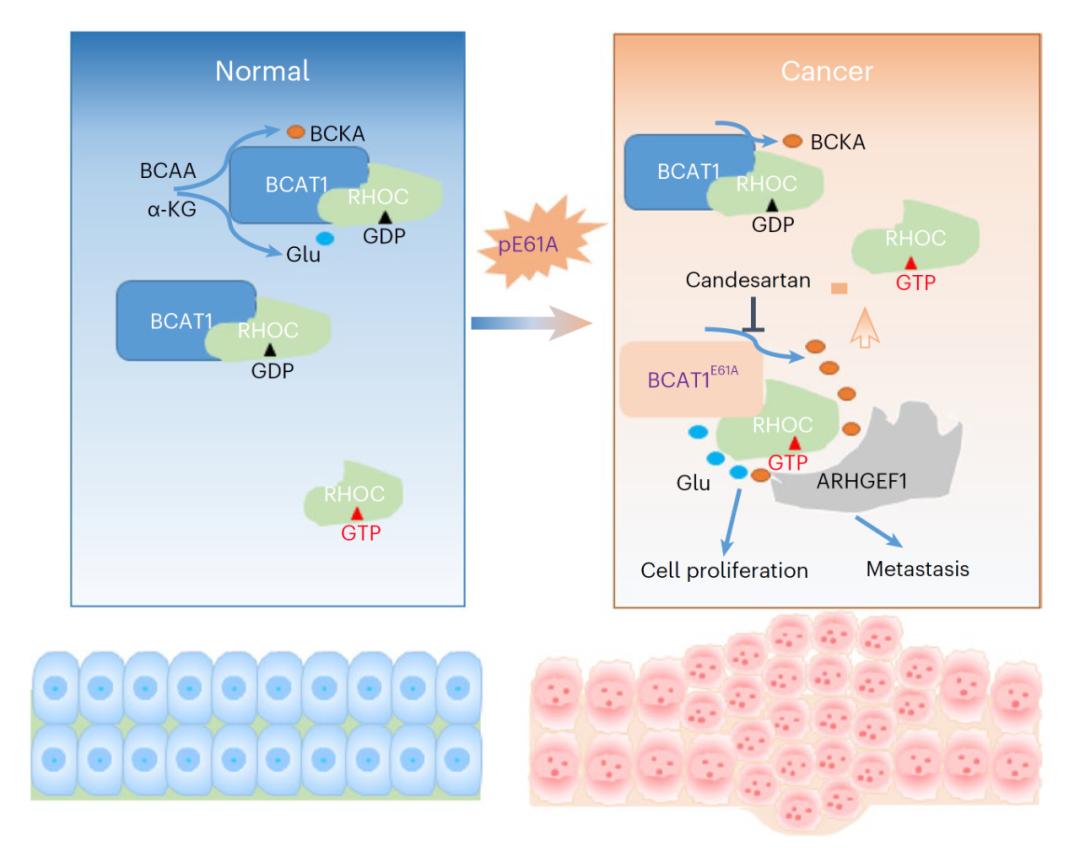
总的来说,该研究发现并鉴定了肿瘤细胞中BCAT1的一个功能获得性突变,进而揭示了BCAA通过细胞内代谢的区室化调控和代谢感知,作用于下游RhoC介导的小G蛋白信号通路,影响细胞迁移和增殖,对靶向依赖BCAA的肿瘤诊疗具有潜在的转化意义。
复旦大学附属肿瘤医院/生物医学院研究院钱林博士、李娜博士、陆孝晨博士研究生和许蜜蝶副研究员为论文共同第一作者,复旦大学上海医学院雷群英教授为论文通讯作者。此外,论文合作作者还包括复旦大学上海医学院的多位教授和上海交通大学基础医学院吴英理教授、中国科学院分子细胞科学卓越创新中心陈正军研究员等。该研究受到了国家自然科学基金、科技部重点基础研发项目和上海市教委科创项目的支持。
论文链接:
https://www.nature.com/articles/s42255-023-00818-7
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




