- +1
如何做好CTU?
原创 赵喜同学 XI区
CT尿路造影(CTU)是一种腹部多期CT检查,专门针对肾脏、输尿管和膀胱成像而优化,包括增强后排泄期成像。
在过去十年中,CTU已成为评估尿路的主要成像技术,并被广泛接受为血尿患者常规评估的一部分。
根据2019年美国放射学会适当性标准,CTU被推荐为微血尿和泌尿系统恶性肿瘤风险因素患者的一线成像方法。美国泌尿外科协会建议在治疗后仍有无症状的微血尿的患者中执行,并排除任何良性病因。这些适应症也得到了美国内科医师协会的确认。表1中列出了CTU的主要适应症。
表1 CT尿路造影(CTU)的临床适应症
CTU的临床适应症
怀疑为泌尿系统恶性肿瘤的微量和/或大量血尿
泌尿系恶性肿瘤的分期和随访
医源性或创伤性损伤
先天性畸形
尿路梗阻
盆腔和腹腔肿瘤浸润
肾脏捐献者术前评估
术后尿路解剖学评估
CTU能够作为诊断工具,与它的优化采集技术密切有关。主要目标是在排泄期实现上尿路收集系统、输尿管和膀胱的最佳扩张和强化;另一个目的是符合 "ALARA "原则,在限制辐射的同时获得足够诊断的图像质量。
目前还没有关于标准方案或国家和机构指南的共识,CTU的采集和造影剂的使用方案仍有很大不同。
最广泛使用的技术包括三个造影后期相,包括皮髓质期(CMP)、肾实质期和排泄期。
平扫可以进行结石检测,并有助于肾脏肿块的定性,它可以区分没有强化和有强化的病变(从平扫到增强增加<10 HU,被视为无强化,增加10-20 HU为不确定,增加>20 HU代表明显强化)。
CMP通常在腹主动脉感兴趣区域达到200HU后25秒获得,对膀胱癌(图1)和肾细胞癌(图2)具有最高的敏感性(95%)和阴性预测值(99%)。
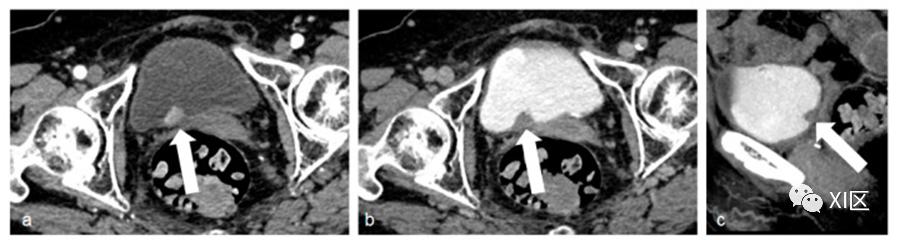
图1 膀胱癌图像。(a) 皮髓质期采集,有一个起源于膀胱后壁的息肉状病变,其特点是高强化(白色箭头)。在排泄期(b)及其矢状面重建(c)中,病变在碘化尿液填充的膀胱中清晰可见(白色箭头),是一个充盈缺陷。
图2 平扫期(a)和动脉期(b)显示右侧透明细胞癌(白色箭头),在平扫期(a)与肾实质期比呈等密度,而在动脉期(b)则以明显增强为特征。
肾实质期和排泄期可分别设定为注射造影剂后100秒和10-15分钟。
一些研究表明,与排泄期相比,肾实质期在鉴别尿路上皮癌方面具有优势,而排泄期历来被认为是鉴别尿路上皮癌的最有价值的阶段。
本文旨在提供所有CTU采集协议、检查实施的辅助技术和重建算法的概述。本文还讨论了主要的可用新技术,如双能量CT采集和人工智能应用。对基本的和先进的采集和后处理技术的充分了解,可以帮助放射科医生确定最佳的采集方案和可用的技术。
采集技术
表2中列出了不同的造影剂使用方案。
表2CTU的不同造影剂使用方案
技术
扫描方案
三期扫描(常规单能量CT)
平扫阶段
单次静脉注射造影剂
皮髓质期(可选)(注射后30-40秒)
肾实质期(注射后80-120秒)
排泄期(注射后5-15分钟)
双期团注双期扫描(常规单能量CT)
平扫阶段
第一次静脉注射造影剂(第一次团注)
5-15分钟后,第二次静脉注射造影剂(第二次团注)
肾实质期和排泄期结合(第二次团注后2-5分钟)
三期团注单期扫描(常规单能CT)
第一次静脉注射造影剂(第一次团注)
5-15分钟后,第二次静脉注射造影剂(第二次团注)
100秒后,第三次静脉注射造影剂(第三次团注)
皮髓质、肾实质和排泄的联合期相(第三次团注后25秒)
单期团注双能CT
单次注射(或分次注射)造影剂
单一排泄期(通常为80和140 kVp)
后期处理以产生虚拟平扫图像
单次注射
传统的扫描技术包括采集平扫,然后注入全剂量的造影剂,并采集肾实质期(80至120秒)和延迟排泄期(5至15分钟);也可以采集CMP(30至40秒)(可选)(表2)(图3)。
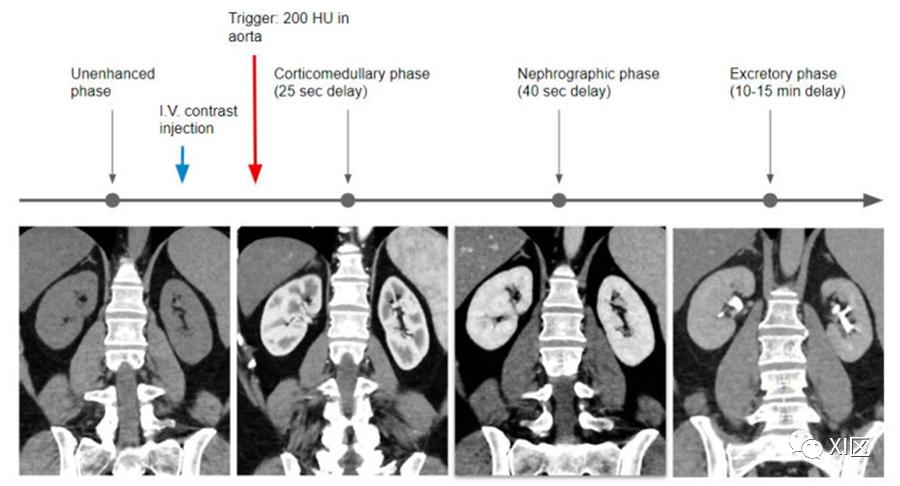
图3 单次注射采集技术的流程图
第一个获取期相是CMP,通常用团注追踪技术获取,将感兴趣区域置于腹主动脉,阈值为200HU,延迟时间设置为25s,在此阶段,肾脏增强与动脉流入有关。然后,当肾脏实质的密度几乎均匀时,获取肾实质期(延迟大约40s)。
在排泄期,肾实质强化均匀,但与前几期相比,其特点是密度明显降低,肾盏和肾盂充满了碘化尿液。
这种单次注射技术可以最大限度地提高尿路的增强和充盈度,因为整个造影剂量都有助于肾实质和排泄期显示 。该方案为对肾细胞癌和移行细胞癌最敏感。此外,包括平扫图像使其在检测肾脏和输尿管结石方面的敏感性最大化。然而,由于要进行三或四次不同的采集,这种技术会导致最高的辐射剂量。
由于辐射量的增加,目前对是否需要进行CMP采集还没有达成共识。CMP的优点是精确的血管和灌注信息,能更好地描述肾皮质肿块的特征,并能发现富转移。CMP的特点还在于检测膀胱肿瘤的灵敏度和阴性预测值都高于单纯的肾实质期或排泄期。然而,许多放射科医生省略了这一阶段,因为增加的少量益处并不能证明增加的剂量是合理的。
每个采集阶段的采集时间可以不同,尤其是肾实质期和延迟排泄期。肾实质造影阶段通常在造影剂注射后80-120s之间进行。在皮质和髓质均匀强化之前,过早获得的图像会限制图像解释,而过晚获得的图像可以检测到早期排泄到收集系统的造影剂,隐藏肾盂内的粘膜增强。
排泄期从造影剂给药后3分钟开始,文献报道时间延迟做多达15分钟。
对于肾功能受损和已知排泄系统扩张的患者,应考虑时间延迟:在这些情况下,以俯卧位进行排泄期有助于尿路的扩张和强化。
为避免过早获取图像,一些作者提出在输尿管中段水平使用单层低剂量监测图像,以验证强化并确认排泄期成像的时间,但这增加了方案的复杂性。
过度延迟会增加收集系统内造影剂的密度,导致难以通过密集的造影剂识别细微的充盈缺损,并导致膀胱内出现线束硬化伪影。
一些作者提出在注射造影剂后60-70s时,采集介于CMP和肾实质期之间的阶段,称为尿道期,该阶段对上尿道病变的检出率很高,敏感性和特异性分别为95%和97%,对膀胱肿瘤的检出敏感性高于单纯排泄期(89.3% vs. 70.5%)。然而,这一阶段尚未被证明优于肾实质期或单独使用肾实质期和排泄期的组合,在没有支持证据表明有明显的额外好处的情况下,将其加入现有期相会导致辐射剂量不合理的增加。
单次注射技术对技术员来说最简单,因为只需要单次注射造影剂,至少可以部分说明这种技术的普及性。
双期团注
为了降低辐射暴露,推荐采用双期团注方案。
在双期团注技术中,肾实质期(用于检测肾脏肿块)和排泄期(用于检测尿路上皮肿瘤)同时采集,避免了一次采集,从而减少了约三分之一的辐射剂量(图4)。
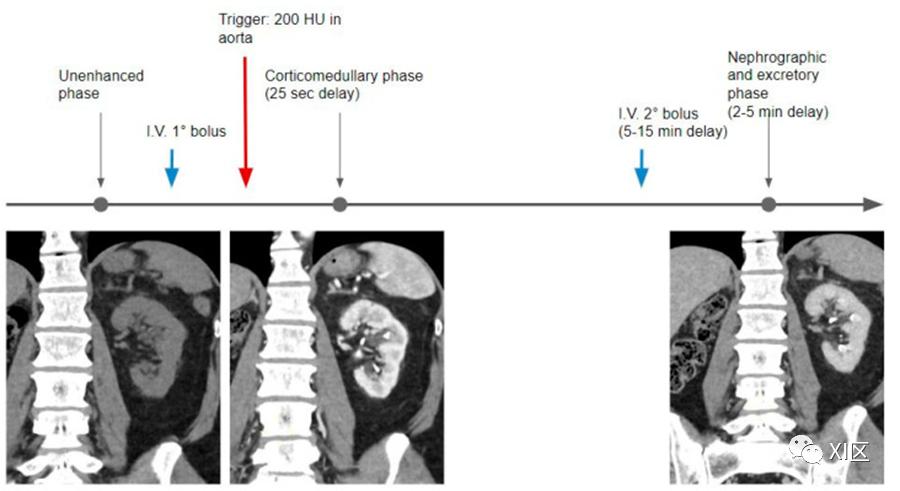
图4 在双期团注技术中,在平扫阶段后,先注射全部造影剂总量的第一部分(通常是三分之一或一半);然后,利用团注跟踪技术和25秒的延迟,获取皮髓质期。在一个可变的时间(延迟5-10分钟)注入第二次造影剂,然后进行第三次CT采集,此时肾脏处于肾实质期,肾盏和骨盆充满碘化尿液。
在这一方案中,造影剂分两次注射给药。在平扫阶段后,注入第一部分(通常是三分之一或一半)的造影剂,获得可选的CMP,然后在大约5-10分钟后注入第二部分造影剂(通常是大于或等于第一部分的剂量),当肾脏显示肾实质增强和收集系统发生强化时,在2-5分钟获得肾实质-排泄期联合图像(表2)。
在不同的研究中,造影剂的使用有很大差异,分次注射的第一和第二部分的比例不同,最佳延迟时间也不同。
一些作者建议使用较大的剂量作为第二次注射,以改善肾脏实质的强化,并将第一次注射的延迟时间定为8分钟,以使输尿管扩张和强化最大化。还有人倾向于在第一次注射后10分钟进行第二次剂量注射,在第一次注射造影剂开始后700秒进行肾实质和排泄期的联合采集。
这种技术的优点是将两个独立的造影期相(肾实质期和排泄期)合并为一次采集,从而减少了采集的图像总数,并相应地减少了总的辐射量,这对年轻患者很重要。
主要缺点是造影剂对肾脏增强的贡献较小,对尿液收集系统的扩张和强化的贡献较小,这可能会降低图像质量和检测小肾细胞癌和细小的移行细胞癌的敏感性。
三次团注
三次团注技术仅在少数机构进行,它是基于将总的造影剂量分成三次注射。可以获得一个可选的平扫阶段,然后注射第一部分团注,接着是延迟时间,然后注射第二部分团注,延迟时间过后,然后注射第三部分团注,最后获得增强后图像。所得的采集结果结合了CMP、肾实质期和排泄期,可以同时进行动脉、实质和收集系统的增强(图5)。
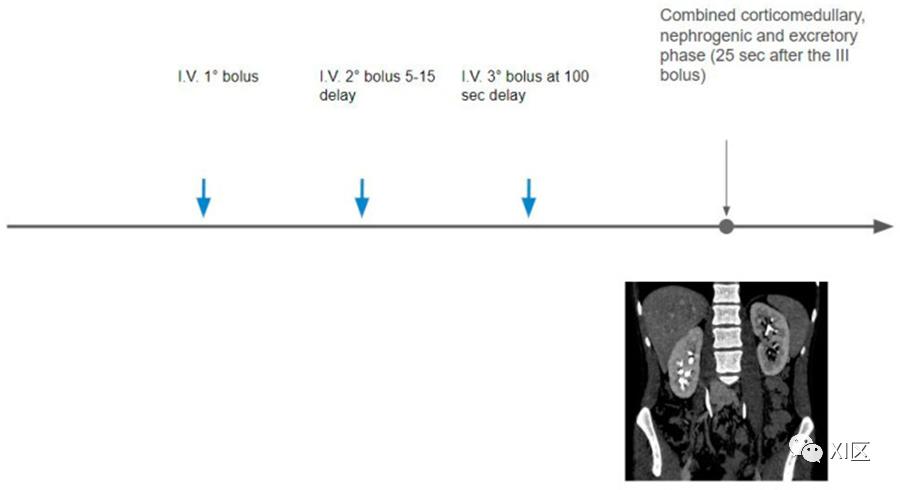
图5 造影剂总量分为三部分:第一部分在平扫采集后进行;第二部分在不同的时间延迟(5-15分钟)后注入;然后在延迟100秒时注入第三部分,接着采集皮髓质和排泄混合期。
这个方案大大降低了总辐射剂量,因为获得的造影剂期相的总数减少;然而,由于造影剂团的分割,只有总造影剂量的一部分有助于排泄物成像,因此导致潜在的有限扩张和输尿管强化。
由于缺乏对透明细胞肾细胞癌最敏感的专用动脉期图像采集,该方案在肾细胞癌检测方面的准确性也有限。
优化排泄期的尝试
为了在单一排泄期实现尿路的充分扩张和整体强化,有人提出了辅助技术,但在实践中都没有被普遍采用。
这些技术包括采集前口服或静脉补液;在静脉注射造影剂前静脉注射呋塞米;使用腹部加压装置(腹带);病人俯卧位;如果排泄期的图像不理想,还可以增加延迟期成像。
水化在改善排泄系统扩张和造影剂稀释方面有一定作用,通常在检查前静脉注射100-250 mL盐水,或在检查前口服400 mL水。
有报道称,给予利尿剂,通常是静脉注射呋塞米,也能增加尿流率,增强尿路的强化和扩张。此外,利尿剂可促进造影剂在收集系统中的稀释,从而可以通过密集的造影剂检测到细微的尿路上皮增厚。
最近的一项研究支持在CTU中使用5mg呋塞米以达到最佳的膀胱充盈度,以提高肿瘤的识别率。然而,由于需要额外的时间和人员来管理和调查患者的药物过敏和禁忌症,利尿剂的使用并不普遍,导致工作流程更加困难。
其他辅助技术的使用不太受文献支持;特别是没有证据支持使用压迫带或俯卧位采集来改善输尿管扩张和强化,这些技术有可能导致技术的复杂性增加,延长检查时间,以及增加辐射照射的额外采集。
一些机构还修改了造影剂的总量和盐水的使用,以最大限度地提高输尿管扩张;例如,有人提出使用更多的更稀薄的造影剂来增加排泄到收集系统中。
对于这些优化排泄阶段的尝试,目前还没有达成共识。
图像重建和后期处理
迭代重建(IR)
CTU采集阶段的数量在2到4个之间,有效剂量可以达到25-35 mSv,特别是在使用过时的设备时,取决于所执行的阶段和采集参数。由于CTU的多期特性,患者一生中与辐射照射有关的癌症风险会更高,尤其是年轻患者;因此,已经做出了大量努力来减少辐射照射。降低管电压可以显著减少辐射剂量,同时增加排泄期强化的泌尿系统的可视化;过去十年中,CTU排泄期使用了降低的管电压(80kV)。
为了在较低的管电压下产生诊断上的最佳图像,应采用不同于滤波反投影的重建算法。
IR在从原始图像数据进行的图像重建中应用了一个校正回路,由于减少了图像噪声,显示了在不降低图像质量的情况下减少辐射的有效性,同时仍然保持最佳的图像质量。CT扫描仪制造商提供了不同的IR算法(更多内容参见XI区:)。这些算法主要在其重建方法上有所不同。
采用IR的低管电压CT方案可以减少图像噪声,有助于识别增强的尿路细胞,并减少肾脏病变内脂肪的衰减,如血管肌脂瘤。
深度学习图像重建
基于深度卷积神经网络的模型已被应用于低剂量CT检查,以模仿标准剂量滤波反投影(FBP)图像纹理,同时确保低图像噪声、条纹伪影抑制、提高低对比度病变可探测性和高分辨率。
实例研究表明,这些新的重建算法既能降低图像噪声,又能在不增加噪声水平的情况下提高空间分辨率(图6)。
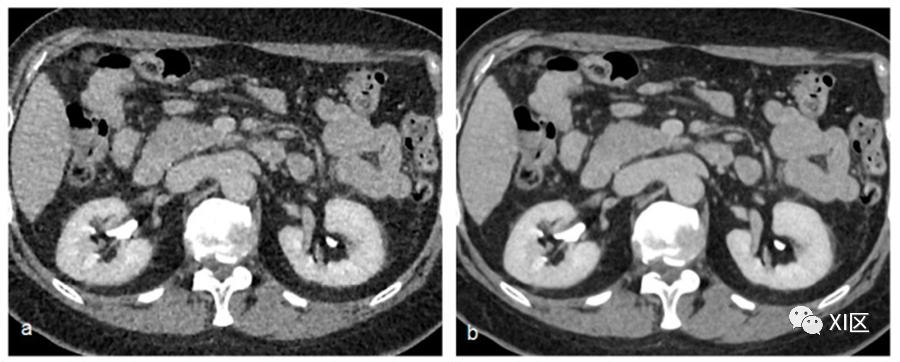
图6 排泄期的标准滤波反投影重建(a)与基于人工智能的重建算法(b)(AiCE-Advanced intelligent Clear-IQ Engine, Canon Medical Solutions)的比较。注意基于人工智能的重建算法(b)的噪声明显减少。
后处理
虽然标准的轴位图像分析可能足以检查腹部和盆腔的其他器官,但应用后处理图像技术有利于评估收集系统和检测细微的尿路肿瘤。
可以进行多平面、最大密度投影(MIP)和三维容积渲染重建,以提高肾脏和尿路上皮的敏感性和可视化。
原始的薄型(0.5-0.75毫米)轴位图像通常提交给冠状和矢状重建,然后进一步进行MIP和三维重建(图7)。
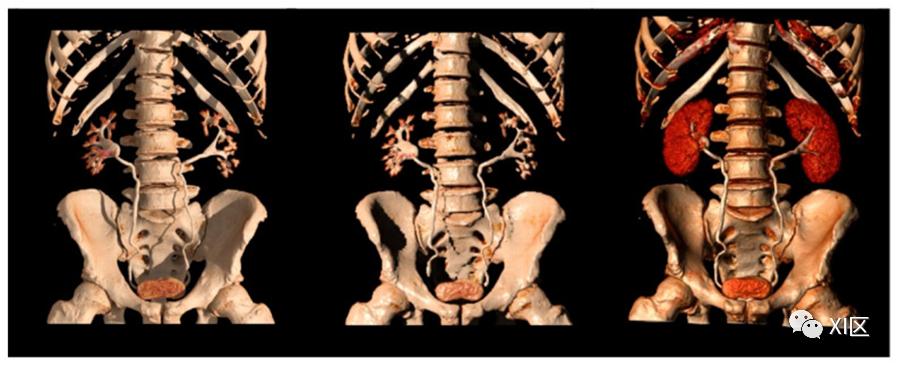
图7 排泄期的不同三维重建
MIP是由数据集中的最高衰减体素构建,并投射到三维格式。这些重建对评估收集系统和输尿管特别有帮助,可以完整而快速地了解收集系统内的高密度对比,并突出细微的充盈缺陷、排泄系统壁的局域增厚、管腔狭窄、肾盏异常、肾积水和输尿管积水。
三维重建根据数据集中每个体素的衰减和与其他相邻体素的关系为其提供特定的颜色,使整个强化的排泄系统得以可视化。一些作者支持他们在识别轻微的尿路上皮增厚方面的作用,特别是在造影剂排泄到收集系统中减少的情况下,此时MIP重建的作用有限。
双能量CT(DECT)
DECT的基本概念
DECT技术是基于对材料在不同能量下的衰减光谱的分析,从而实现材料的表征。
有不同的DECT技术,参见XI区:通过检查同一解剖区在多种能量下的衰减光谱,DECT提供了结构的衰减特征。X射线和被扫描材料之间的相互作用,与材料的物理特征如密度和原子序数有关,决定了低能和高能光谱之间的衰减变化程度。
高衰减的低能量光子和低衰减的高能量光子是X射线束强度的特征。衰减随着材料的密度和原子数的增加而增加,而X射线束的能量则减少。
因此,不同的材料有不同的衰减曲线,这与材料的固有特性和所使用的光束能量有关。
由于低能量水平的碘衰减系数较大,低能量图片通常表现出更强的对比度,并在对比后的采集中增强病变检测;但是,它们的特点是图像噪声较高。
低能量图像强调的是碘,当光束电压下降时,碘的密度增加,导致与背景组织的对比度更大,提高了增强病变的检测。
DECT协议的主要目的是通过单能量成像将低kV较强的碘衰减与高kV较低的图像噪声相结合,通过后处理噪声优化算法实现高对比低噪声的图像。
DECT采集的高能和低能数据可用于创建类似CT的单能图像,包括衰减值和结构信息,或进行其他特定材料的重建。
DECT虚拟平扫图像
DECT有大量的好处。首先,由于分解分析和虚拟平扫CT图像的生成,即从软组织和水中分离出碘,DECT减少了辐射暴露。
虚拟平扫图像(图8)能够省略真正的平扫扫描,当应用于分次给药的造影剂技术时,可减少高达50%的剂量,同时保持检查的诊断价值。
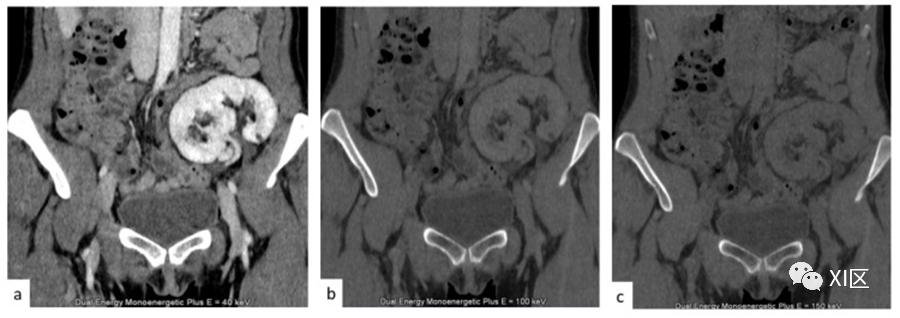
图8 (a) 移植肾脏的肾实质阶段。(b,c) 在100(b)和150(c)KeV下的两个虚拟平扫图像。
虚拟平扫图像可以识别结石和出血性改变,并有助于肾脏肿块的定性,但不需要获取平扫期图像,从而降低了辐射剂量。
虚拟平扫图像的结石检测灵敏度达到95%;假阴性是被密集对比度尿液包围的小的、低衰减的结石被意外减去的结果。
假阳性的产生可能是由于尿路内积聚的密集造影剂尿液病灶,在虚拟平扫重建中被错误地识别为尿路结石。通过口服水合剂、呋塞米稀释造影剂尿液,并在第一次注射时降低造影剂量,以及使用100-140 kV而不是80-140 kV对,可以提高虚拟平扫图像上碘去除的准确性。
DECT造影剂的减少
DECT还可以通过使用低能量的单能谱图来减少造影剂的剂量。这对于原先就有肾功能损伤、有较高的造影剂诱发肾病风险的患者,以及老年患者和接受常规随访的患者尤其有用。DECT允许在更接近碘的K边界的单能量水平上进行合成图像重建,与传统的120 kV的采集相比,碘的衰减要高得多;与标准的单能量技术相比,这种较高的衰减使得DECT尿路造影的给药碘剂量减少了30%,而不会影响衰减和图像质量。事实证明,50keV的DECT平均衰减量与120kV的标准采集方法获得的肾脏血管和尿路衰减量相似或更高,图像质量也相似。
DECT结石成分分析
结石的治疗策略不仅取决于梗阻的大小和程度,还取决于其化学成分;例如,尿酸结石可以在较高的pH值下溶解于尿液中,因此尿液碱化发挥了重要作用,而体外冲击波碎石等非侵入性治疗在处理草酸结石方面效果较差。因此,对输尿管结石的化学成分进行定性有助于其管理。在这方面,DECT的准确性不仅有助于形态学和解剖学的评估,也有助于化学成分的评估。
衰减模式和低、高能级有助于光谱分离,从而了解材料的化学成分,因为较轻的材料在低、高能级之间的衰减差异很小。相反,那些较重的材料在低能级和高能级之间显示出较大的衰减差异。
DECT在区分尿酸性结石和非尿酸性结石方面表现出很高的准确性,并为评估结石的脆弱性提供了信息(图9)。
更多内容参见XI区:;。
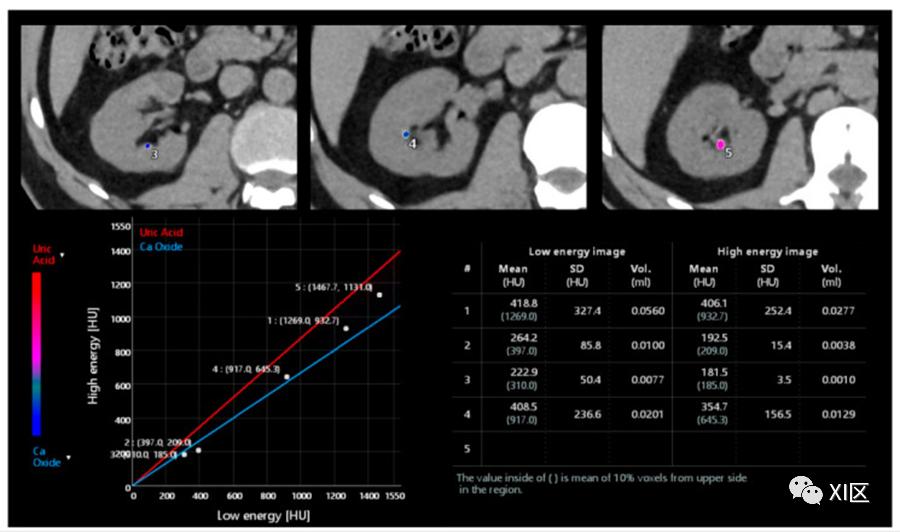
图9 双能量平扫肾脏采集的后处理分析。根据与两种材料的直线相关的点的位置,可以分析出不同结石的特征,即尿酸、氧化钙或混合成分。此外,还可以自动计算体积和平均HU单位。
根据衰减水平,结石的组成也可以分为羟基磷灰石、尿酸、半胱氨酸、草酸和混合结石。由于难以获得准确的衰减值,评估<3-5mm的结石时,结石定性的准确性会下降。
DECT 碘图
DECT图像也可以进行后处理,以创建显示不同成分浓度的图,包括碘、脂肪和钙。构建碘图有助于识别碘浓度较高或较低的组织(图10、图11和图12)。
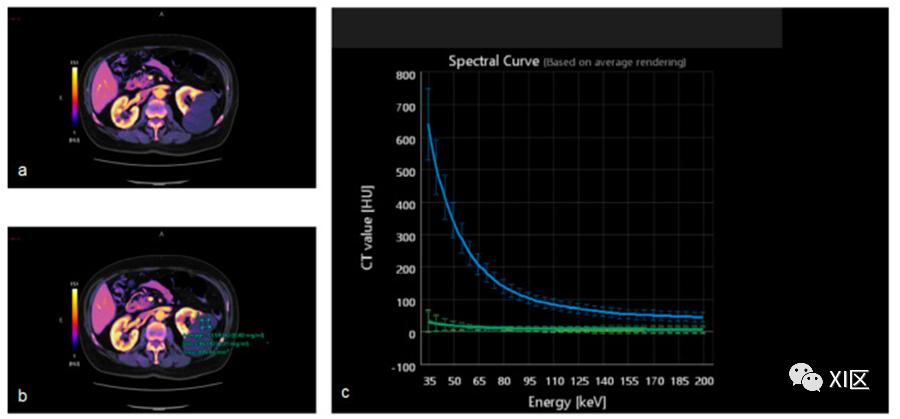
图10 皮髓质期的双能量采集。在(a)中,碘图显示左肾囊肿内没有碘。为了证实这一点,可以在囊肿(b)和主动脉内放置一个感兴趣区域,以获得能谱曲线。(c)绿色曲线证实了肾囊肿内没有增强,而蓝色曲线显示了主动脉腔内的增强。
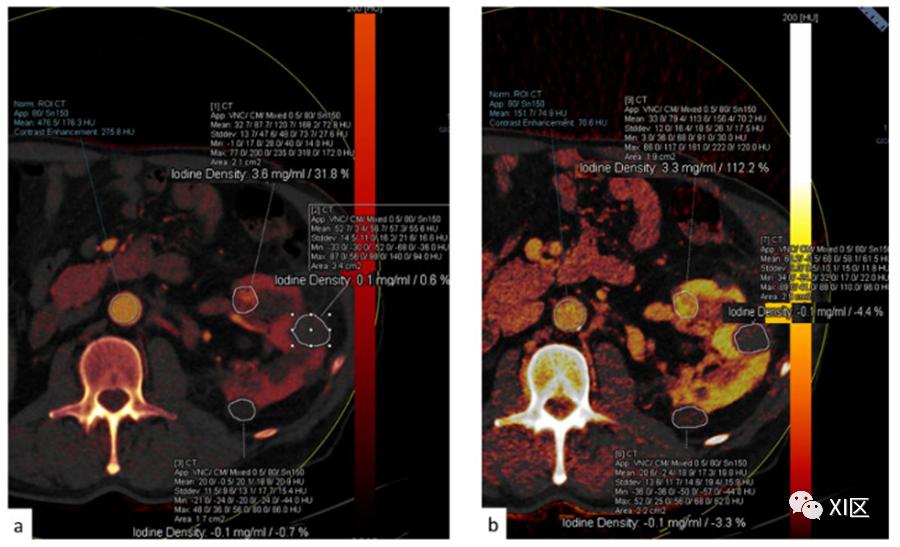
图11 (a) 双能量采集的皮髓质期,碘图的可视化。(b)后部和外部的肾脏成分不显示碘含量,而前部结节显示清晰的碘含量。
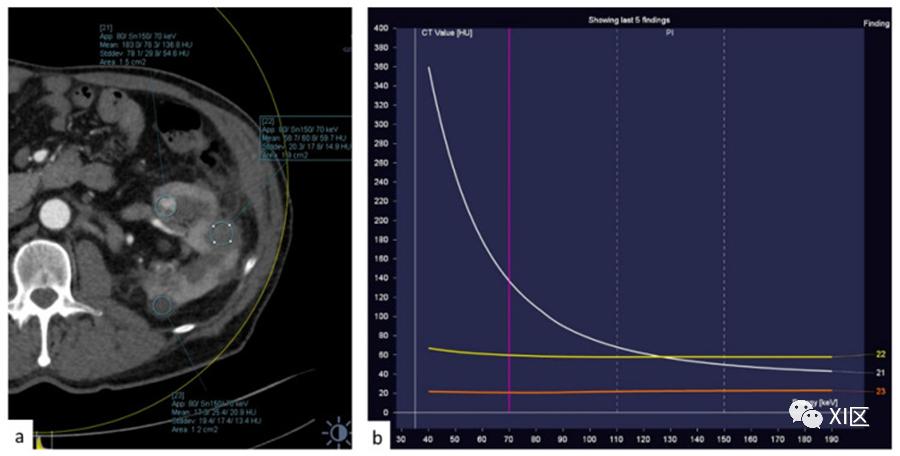
图12 (a) 图中强调的肾结节的能谱曲线。(b) 黄色和橙色的线条对应于两个囊肿。
碘密度测量有不同的应用。首先,它们能够对偶然发现的肾脏肿块进行管理,允许通过一次检查对其进行定性,避免了额外的成像和诊断时间的延误。虚拟单能谱图像显示,与标准CT采集相比,它能更好地校正线束硬化伪影,降低实质内肾囊肿的假增强程度,使诊断更有把握。
碘密度测量和碘叠加图像提供了直观的增强描述,有助于区分明显增强的透明细胞肾细胞癌和低增强的乳头状肾细胞癌,在使用靶向抗血管生成药物治疗透明细胞肾细胞癌和消融治疗患者时,也特别有助于评估治疗反应。
人工智能
人工智能模型在图像分析方面已显示出巨大的进步,在放射学领域有不同的应用。它可用于病理的自动检测、异常的分割及其特征(良性与恶性,以及肿瘤的类型)、疾病的分期、风险分层,以及预测患者的结果和对特定治疗的反应,以提供量身定做的管理方法。
计算机辅助检测
计算机辅助检测(CAD)是癌症检测中的一项有用技术。开发CAD系统的一个关键步骤是对异常情况进行分割,因为它决定了后续步骤的搜索区域。
由于尿道癌的分割,特别是在膀胱区域的分割非常困难,所以研究人员的注意力现在都集中在这个问题上,据我们所知,目前还没有自动识别排泄系统肿瘤的计算机辅助检测方法。
已经开发并测试了一个计算机辅助检测系统,用于识别CT结肠造影上的外生性肾脏病变,其灵敏度为95%;另一项研究发现,对肾脏进行灰度阈值分割,然后进行纹理分析,其检测肾脏肿瘤的灵敏度为85%,且没有假阳性发现。
分割
对CTU中的膀胱病变进行准确分割是一项挑战:在排泄期,膀胱可能不均匀地充满造影剂,膀胱形状随扩张程度变化很大,而且膀胱病变的边缘很难与周围软组织区分。此外,肥大的前列腺突入膀胱可能是一个混杂因素。显微超声在未来可能会在泌尿外科领域获得一定的作用,特别是在膀胱癌和前列腺癌的检测和浸润估计方面,尽管目前的证据仍然有限。
当用大量的数据进行训练时,卷积神经网络表现出对医学图像进行分类的能力,并被用于识别和分类医学图像中的病理模式。它们可以被训练来识别膀胱内部和外部的模式,并构建膀胱概率图来协助水平集分割,在膀胱病变自动分割方面取得了令人鼓舞的结果。
纹理分析和放射组学
纹理和放射组学分析作为评估肿瘤和非肿瘤疾病的非侵入性工具的兴趣越来越大。
图像纹理分析可以识别感兴趣区域所包含的灰度差异:与光滑纹理的材料相比,粗糙纹理的材料的图像会有更高的灰度值变化率,在处理恶性肿瘤时,创建图像的灰度值和这些值的空间关系与组织特征、遗传和其他分子变异有关。
放射组学是基于利用基于数据特征学习的算法,从医学图像中提取许多定量特征。通过放射组学分析确定的特征不能由人眼识别。
识别恶性肿瘤的组织学变异在治疗计划中具有核心作用;然而,视觉上区分不同类型的膀胱恶性肿瘤比较困难。纹理特征和放射组学分析显示了癌症分型的良好准确性,与尿毒症相比,微乳头状癌的纹理异质性更强,而且在区分代表重要预后因素的组织学变异方面具有潜力。
这个工具可以帮助临床医生在常规影像学上对膀胱癌进行进一步的亚分类,并对治疗和病人护理进行调整。
不同组织学的肾脏肿瘤有不同的基因表达模式、预后和对分子靶向治疗的反应,特别是在晚期和转移性疾病中。经皮肾活检仍然是肾脏肿块组织病理学评估的金标准,但它是一种侵入性的程序,老年患者最好避免使用。
为了区分不同的恶性病变,需要非侵入性的生物标志物。放射组学在区分透明细胞肾细胞癌和非透明细胞肾细胞癌(乳头状和嗜铬细胞肾细胞癌),以及上皮样血管肌脂瘤和肾脏肿瘤细胞瘤方面取得了可喜的成果;在最后一种情况下,这种方法避免了因误诊而进行良性病变的手术切除。特别是,CT放射组学在病理肾脏肿瘤的分类方面具有良好的性能。建立不同的模型,包括用分割法提取的纹理特征,以及非纹理特征,如病变衰减值和绝对增强值,使我们在肾脏病变的分化中取得了较高的敏感性和特异性。
肿瘤分期和分级
治疗计划的另一个决定因素是肿瘤分期。
非肌层浸润性和肌层浸润性膀胱癌在预后和治疗管理方面有明显的差异。膀胱癌T2至T4期的患者,建议采用新辅助化疗进行治疗。
膀胱癌的局部分期和肌肉侵犯的定义是基于膀胱镜检查和对活检组织的组织学评估。然而,这是一种侵入性检查,活检既取决于操作者的经验,也取决于肿瘤的取样部分,导致高达25%的病例出现错误分期。重复的手术可以提高准确性,但代价是增加侵袭性。开发准确的非侵入性方法来评估局部分期非常可取。
人工智能算法已被应用于预测膀胱癌的肌体浸润状态。有不同的模型可用。近年来,深度学习获得了极大的关注;深度学习模型可以自动学习从放射学图像中提取的特征,而不需要人类专家事先进行标记,减少了人工预处理任务的时间。它们可以自动分割病理组织,并提供组织的表型特征,以实现准确的特征分析。
一个基于CT图像的深度学习模型在术前确定膀胱癌的肌肉浸润状态方面表现出良好的准确性。
从尿道癌分割中提取的纹理参数证明了在平扫、动脉期和静脉期CT上区分低级尿道癌与高级尿道癌以及非肌层浸润性癌症与肌层浸润性的重要作用。由自动分割系统提取的形态学特征和机器学习模型中的纹理特征相结合,在区分大于或等于T2期和低于T2期的阶段方面显示出有希望的结果。
透明细胞肾癌的分级通常是通过应用世界卫生组织和国际泌尿科病理学会的分级系统,涉及nucleolar特征的评估或使用Fuhrman分级系统进行。这些系统需要进行有创的组织活检,容易出现取样和观察者之间的误差,与传统的组织取样相比,仍然需要一个非侵入性的客观工具来评估整个肿瘤的等级,以准确描述肿瘤的异质性。在三期造影剂增强CT和不同的单能谱DECT图像中,利用放射学特征提取和建立机器学习模型进行肿瘤分割,证明了透明肾细胞癌和嗜铬肾细胞癌分级分层的高准确性。
预测治疗反应
人工智能模型的主要应用之一是对肿瘤患者的治疗反应进行预测。
对于肌肉受累的膀胱癌患者,根治性膀胱切除术前的新辅助化疗可以提高根治性膀胱切除术前较大肿瘤的切除率和患者的生存率,并减少转移性疾病的发生率。然而,新辅助化疗有很大的副作用,包括中性粒细胞减少、败血症、粘膜炎、恶心和呕吐。因此,选择对这些治疗有反应的患者至关重要,以避免潜在的无反应患者的毒性,并为无反应的患者提供替代疗法;此外,如果可以可靠地确定患者对治疗有完全的反应,可以考虑选择保留器官治疗而不是切除膀胱。
目前还没有可靠的方法来预测个别病例的反应;因此,人们对开发基于计算机人工智能的预测模型和决策支持系统越来越感兴趣,以帮助医生对治疗方案进行最适当的选择。
深度学习卷积神经网络系统可以通过将治疗前和治疗后CT中的影像特征与膀胱切除术后的组织学相关联,来训练预测对新辅助治疗有反应的患者。在治疗前和治疗后的CT图像上发现了多种特征,包括形状、大小和纹理特征,这些特征通过病灶分割提取出来并纳入分析。
免疫疗法是癌症治疗中最重要的进展之一,尽管它只对少数病人有效。因为目前还没有生物标志物可以用来识别适合这种治疗的个体,所以研究人员转向了人工智能模型。因此,卷积神经网络和放射组学已被用于调查接受一线铂类化疗后出现进展的免疫治疗患者,以从那些可能表现出疾病进展的患者中识别出那些有很大可能的反应(完全、部分反应或疾病稳定);所提出的模型在区分这两类患者方面表现出92%的准确性。
这些新开发的工具可以帮助肿瘤学专家选择符合不同治疗方法的患者,以提供个性化的医疗方案。
局限性
尽管CTU是评估泌尿系统病变的有效和金标准方法,但它有一些局限性。
首先,三期采集方案,包括平扫期、皮髓质期、肾实质期和排泄期,与大量辐射暴露有关。使用替代方案或虚拟平扫扫描重建的DECT可减少辐射暴露。
由于识别尿道上皮病变有赖于排泄系统的最佳扩张和强化,CTU可能会受到输尿管蠕动收缩的限制,从而阻碍输尿管的完全扩张。延迟或不理想的强化也可能与排泄系统阻塞或肾功能改变有关,导致无强化段的潜在尿路上皮病变被遗漏。俯卧位采集可能会改善排泄系统的扩张和强化,但会增加辐射剂量。
此外,CTU是基于碘造影剂的使用,这一事实对于肾功能受损的病人来说是一个限制。推广DECT,减少所需的造影剂,可能是解决这一问题的部分办法。
结 论
CTU是放射学的基础检查之一。对不同的采集方案以及重建算法、双能量应用和人工智能工具提供的新视角有很好的了解,可能有助于放射科医生优化日常工作。
更多干货,关注XI区!
文献原文:Cellina M, Cè M, Rossini N, Cacioppa LM, Ascenti V, Carrafiello G, Floridi C. Computed Tomography Urography: State of the Art and Beyond. Tomography. 2023 Jun; 9(3): 909–930.. doi: 10.3390/tomography9030075.仅供专业人士交流目的,不用于商业用途。
2023年6月12日
如果你觉得写得还不错,请分享、在看和打赏!
原标题:《如何做好CTU?》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




