- +1
林木-固氮微生物共生固氮体系植物修复的意义
原创 Cell Press CellPress细胞科学

生命科学 Life science
植物修复是低经济成本、污染小,且优于物理、化学修复的土壤修复方式。固氮林木能通过保持表层土养分有效性、重金属解毒、增强碳固存及保护生物多样性等,从而达到恢复土壤肥力的目的[1,2]。其中具有共生固氮功能的林木,常被用于营造大面积人工林进行土壤修复,例如刺槐常被用来修复养分枯竭的土壤,因此利用共生固氮林木进行土壤修复具有极高的农业生态价值。但关于非豆科具有共生固氮功能的林木,例如:放线菌-林木共生固氮体系,此方面的研究较少报道,且对林木-微生物互作过程中涉及到生理、分子和生态学相关机制缺乏认识。因此了解林木-放线菌共生体系固氮特性及抗逆机制对土壤修复具有重要的研究意义和潜力。目前对放线菌-林木共生固氮体系在土壤修复过程中可以起到何种关键作用?同时在其进行土壤修复的同时,林木-放线菌体系的逆境生理、分子响应机制等方面的理解均不十分清楚。近日,西南大学资环学院分子生理生态学研究中心(Center of Molecular Ecophysiology, CMEP)胡斌教授和海恩斯-莱恩伯格(Heinz Rennenberg)院士团队应邀在Cell Press细胞出版社旗下期刊Trends in Plant Science发表了题为 “Significance of nitrogen-fixing actinorhizal symbioses for restoration of depleted, degraded, and contaminated soil”观点性综述文章。该论文系统总结了该团队及国内外同行在放线菌固氮体系对养分贫瘠、退化及污染土壤生态系统修复领域的最新进展,提出在实际应用前提下,固氮放线菌-植物共生体系对于恢复土壤生态系统的重要潜力和意义,并着重提出了未来的研究重点。
固氮木本植物用于植物修复的潜力
与传统的物理、化学修复技术相比,植物修复是具有低成本、污染小的有效土壤生物修复方式。通过种植具有修复特性的林木种类可有效保持和改善退化和受污染土壤的养分有效性、重金属解毒、增强碳固存和保护生物多样性等[1,2],尤其以微生物-植物共生体系为代表[3]。之前研究表明,豆科固氮林木刺槐(Robinia pseudoacacia L.)-菌根真菌-根瘤菌的三级响应体系,能在有效缓解重金属毒害的同时,显著提高土壤中氮、磷的养分含量[3]。
林木-固氮微生物共生固氮体系植物修复的意义
共生固氮(BNF)在陆地生态系统的氮输入中占超过97%的比重[4,5],其中细菌共生固氮量占全球陆地共生固氮总量的四分之一,是森林和边缘陆地生态系统非常重要的氮来源[8]。固氮细菌与植物形成共生关系后,将大气中的氮气转化为植物生长所需要的固态氮形式,促进根部对氮素吸收及木质部和韧皮部对碳、氮的运输及分配过程(图1)。能与固氮微生物形成共生关系的植物种类较多,主要为豆科类,且共生过程中需要固氮细菌(主要为:根瘤菌Rhizobia和弗兰克氏放线菌Frankia)在对应的植物根系中定植,进行复杂的分子信号交换、传导过程,最终形成根瘤[6,7],该过程中涉及到很多基因在不同通路条件下的相互协调作用。其中比较典型的林木-固氮微生物共生体系为:豆科刺槐-根瘤菌和林木(如桤木)-放线菌共生体系。
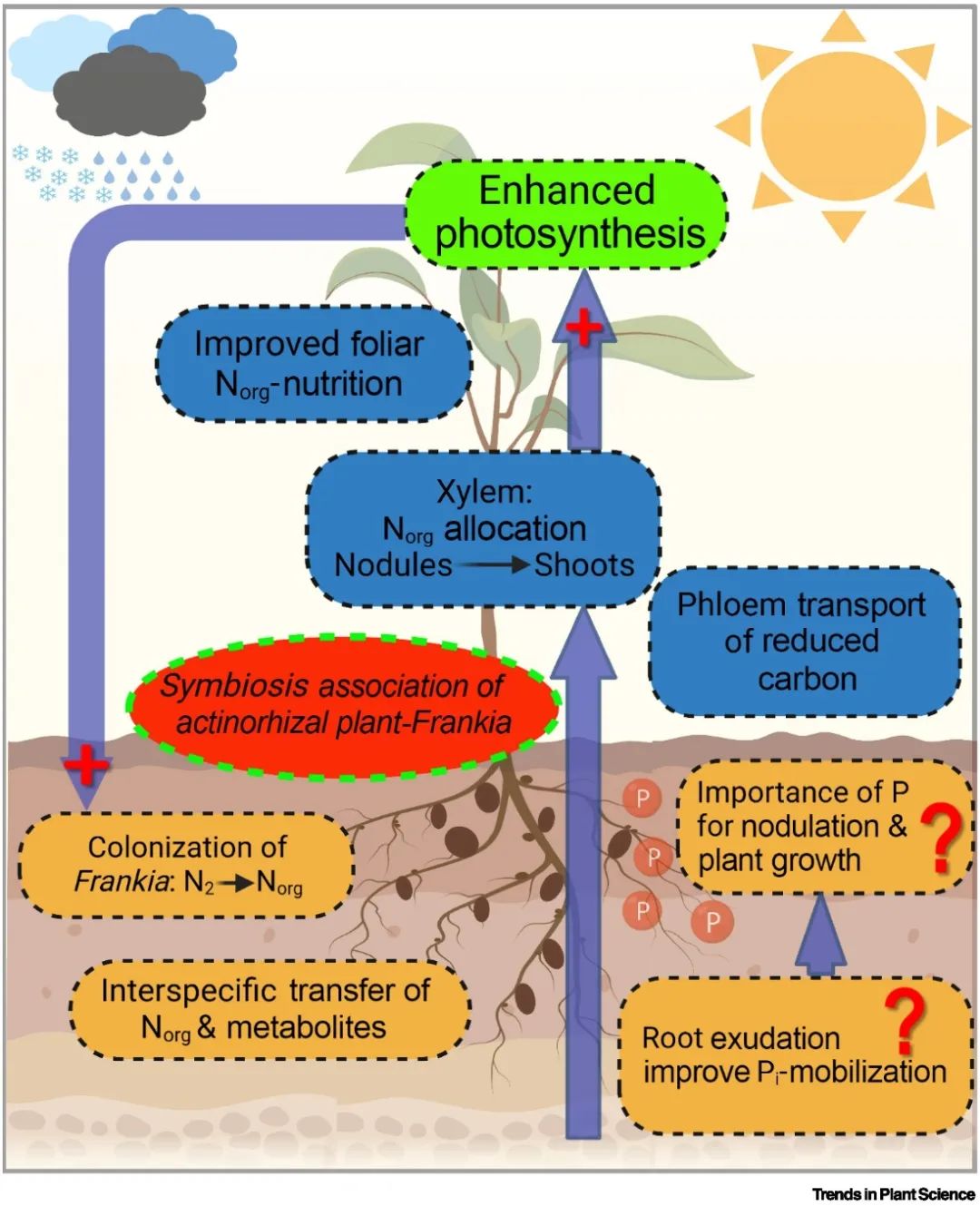
▲图1 放线菌固氮对共生植物生长、发育的重要意义和未来研究展望。
放线菌-植物共生体系的固氮效率及对混生非固氮植物混栽的庇护效应
据报道,放线菌植物共生体平均固氮效率比豆科植物-根瘤菌体系低,且具有种内高变异的可能。但在实际的野外生态系统中,放线菌植物的固氮效率还少有报道。目前通过先进同位素标记技术手段预测,放线菌植物能与非固氮植物之间通过混栽似乎可以产生相同于豆科植物与非豆科植物混栽之间产生的庇护效应,能将其所固定的氮转移到周围非固氮植物,从而促进整体生态系统养分循环、发展和演替,但尚缺乏此类研究的具体报道。
放线菌-植物共生固氮体系的抗逆性
前期研究表明,放线菌植物共生固氮体系能有效耐受一系列非生物逆境条件,例如pH、重金属、盐、极端低温等[9,10],所以可以被用作有效的恢复土壤肥力的植物修复措施。其共生体系植物和菌种具有高度的环境胁迫耐受力以及其植物-放线菌互作机制,是达到耐受各种非生物胁迫的重要驱动因素。其共生体系之间的兼容性越高,越能体现出共生的胁迫耐受累加效应,达到对逆境的最大适应性。例如:对极端pH耐受程度主要取决于放线菌株的类型及培养条件;菌株与不同重金属污染物在分子层面的结合能起到对其不同的抗性机制,如铜、砷、铅、铬等。在高浓度盐胁迫条件下,耐盐性主要通过耐盐性高的菌株类型调节其生理生化及分子机制实现,其中涉及到一系列转录、翻译、代谢等交汇过程。另外,虽然大多数弗兰克氏放线菌适宜生长的温度在25~37℃,但它能与西伯利亚桤木共生,使其能在南北极、高海拔等永久冻土地区生长良好,这与菌体内可产生的冷休克蛋白的根瘤菌抗寒机制不同,但关于弗兰克放线菌如何适应极低温的生理、分子机制还需进一步研究。以上的抗逆过程几乎都涉及到分子生物学层面的复杂机制,因此再次提示未来开展关于放线菌植物固氮共生体系分子生物学、多组学研究的重要性。
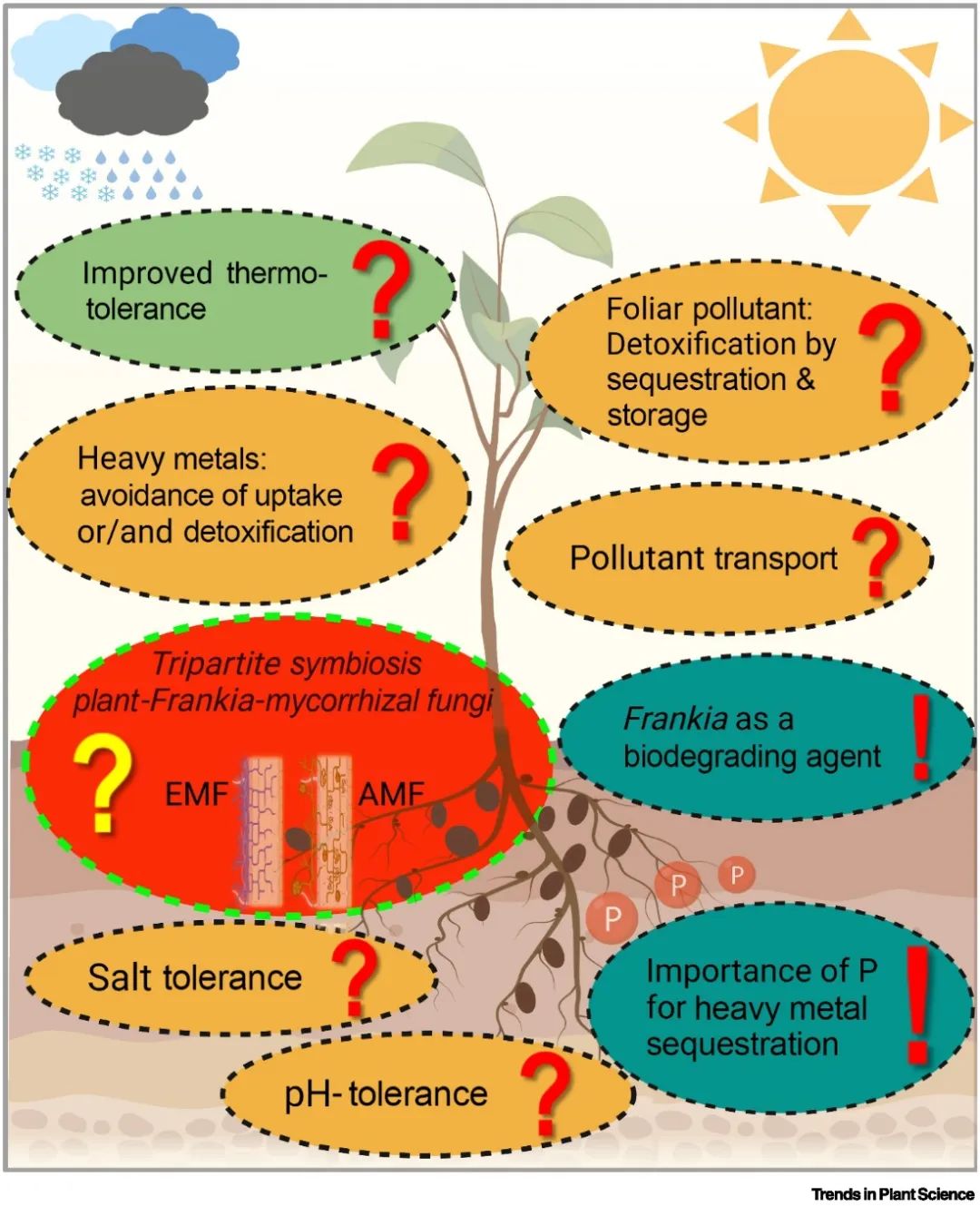
▲图2 关于放线菌植物共生固氮体系对多种非生物逆境环境条件的耐受机制研究背景和未来展望。
放线菌植物共生固氮体系对未来退化、污染土壤修复的意义
虽然放线菌植物的固氮效率不如豆科植物,但是对于极端逆境条件下,放线菌植物特别是林木类型体现出的优势是豆科植物无法达到的。因此,放线菌林木对极端逆境环境下的土壤修复是具有较强的优势,不仅能有效促进退化、受污染土壤生态系统恢复,还能通过自身生长发育为人类活动提供优质木材和食物,具有较强的生态、社会综合提升效益。
结论与未来展望
由于人类活动而导致的全球生态环境污染和气候变化问题日益严重,陆地生态系统也因此遭受负面影响而导致严重的土壤退化、污染等生态问题。在此背景下放线菌植物共生体系具有为土壤退化提供合理、有效的植物修复的意义和潜力。在促进土壤养分的固持和循环的基础上,可有效适应不同逆境环境,同时还能修复重金属污染。因此放线菌与植物共生固氮过程中涉及的抗逆响应的生理、分子机制对于深入理解其未来植物修复潜力至关重要,但之前关于此方面的研究较少报道。因此未来新的研究方向应着重聚焦于该共生体系对不同逆境环境条件的抗性和适应性分子生理生态机制方面,以期后续为退化、污染土壤生态系统的植物修复提出更清晰并有针对性的理论依据和解决方案。
本文参考文献
[1]He, Y. et al. (2013) Carbon storage capacity of monoculture and mixed-species plantations in subtropical China. For. Ecol. Manag. 295, 193–198
[2]Luo, Z.-B. et al. (2016) Heavy metal accumulation, signalling transduction and microRNA regulation in plants: paving the way for enhancing phytoremediation efficiency. Biotechnol. Adv. 34, 1131-1148.
[3]Liu, Z. et al. (2020) Significance of mycorrhizal associations for the performance of N2-fixing Black Locust (Robinia pseudoacacia L.). Soil Biol. Biochem. 145, 107776.
[4]Shi, W. et al. (2019) Physiological and molecular mechanisms of heavy metal accumulation in non-mycorrhizal versus mycorrhizal plants. Plant Cell Environ. 42, 1087–1103
[5]Vitousek, P.M. et al. (2002) Towards an ecological understanding of biological nitrogen fixation. Biogeochemistry 58, 1–45
[6]Galloway, J.N. et al. (2004) Nitrogen cycles: past, present and future. Biogeochemistry 70, 153–226
[7]Rai, A.N. et al., eds (2002) Cyanobacterial–Plant Symbiosis, Kluwer
[8]Pawlowski, K. and Bisseling, T. (1996) Rhizobial and actinorhizal symbioses: what are the shared features? Plant Cell 8, 1899–1913
[9]Schwencke, J. and Carú, M. (2001) Advances in actinorhizal symbiosis: host plant–Frankia interactions, biology, and applications in arid land reclamation. A review. Arid Land Res. Manag. 15, 285–327
[10]Alskog, G. and Huss-Danell, K. (1997) Superoxide dismutase, catalase and nitrogenase activities of symbiotic Frankia (Alnus incana) in response to different oxygen tensions. Physiol. Plant. 99, 286–292
[11]Ribeiro-Barros, A.I. et al. (2019) Actinorhizal trees and shrubs from Africa: distribution, conservation and uses. Antonie Van Leeuwenhoek 112, 31–46

论文作者介绍

胡斌
教授
论文第一及通讯作者:胡斌,于2008年获得芬兰东芬兰大学和德国佛莱堡大学的双硕士学位,并于2013年,获得德国弗莱堡大学森林生态学博士学位,此后作为博士后及科研人员就职于德国弗莱堡大学。从2020年至今,成为西南大学资环学院分子生理生态学中心教授,主要研究领域为植物生理生态学、森林生态学、植物生物学。主持过多个国内及国际科研项目,目前担任中国林学会森林生态分会理事。第一与通讯作者在Trends in Plant Science, Plant, Cell & Environment, Soil Biology & Biochemistry, Plant and Soil, Tree Physiology, Environmental Pollution, Science of The Total Environment等植物、农林和环境科学等期刊上发表论文合计超过30篇。

海恩斯-莱恩伯格
Heinz Rennenberg
教授
论文资深作者:海恩斯-莱恩伯格(Heinz Rennenberg)教授, 德国科学院院士,西南大学资环学院分子生理生态学中心教授兼主任。曾担任德国弗莱堡大学和科隆大学教授、院长;欧洲植物生物学联合会主席 President of the Federation of European Societies of Plant Biology(FESPB)等职位。近40多年来主要研究涉及林木生理生化、微生物、土壤、气候变化生态学等方面的研究,主编或合著各类教材、学术书籍共14部,在Annual Review of Plant Physiology and Plant Molecular Biology、PNAS、Plant Cell、New Phytologist、Plant Physiology、Plant Cell and Environment和Journal of Experimental Botany等国际顶级生态学、林学和植物学期刊发表SCI收录论文538篇,所有论著超过600篇(册),在ISI网站上总检索次数累计超过23000次,个人H-Index指数达81。2019年获得德国植物学会终身荣誉会员称号并入选重庆市级人才项目,2021年入选教育部国家级人才计划。
相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Plant Science点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Significance of nitrogen-fixing actinorhizal symbioses for restoration of depleted, degraded, and contaminated soil
▌论文网址:
https://www.cell.com/trends/plant-science/fulltext/S1360-1385(23)00085-7
▌DOI:
https://doi.org/10.1016/j.tplants.2023.03.005
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




