- +1
自私的基因,清华大学刘俊杰团队揭示逆转座子在基因组上跳跃的分子机制

编辑丨王多鱼
排版丨水成文
逆转座子(Retrotransposon)是一类可以通过“复制-粘贴”的方式在基因组上发生跳跃的DNA元件。R2是低等真核生物中广泛存在的一种逆转座子。它们专一性地“寄生”在宿主基因组的28S核糖体DNA中,借助宿主基因的启动子,合成自身的mRNA和蛋白质并组装形成R2复合物(“复制”过程);R2复合物可再次识别宿主28S核糖体DNA上的专一性位点,通过核酸酶(endonuclease,EN)结构域切开DNA双链,再通过逆转录酶(reverse transcriptase,RT)结构域逆转录合成cDNA,将R2基因序列重新整合到宿主基因组上(“粘贴”过程),完成“增殖”。
有趣的是,逆转座子等可移动的DNA元件在基因组上跳跃的过程中,极大地丰富了基因组的组成,被认为在基因组进化的过程中扮演着重要的作用。因此,理解逆转座子在基因组上跳跃的分子机制将有助于思考“我们的基因组从哪里来、如何来”的问题。此外,利用逆转座子在基因组上跳跃的性质,开发新的核酸操纵工具,将具有巨大的应用前景。
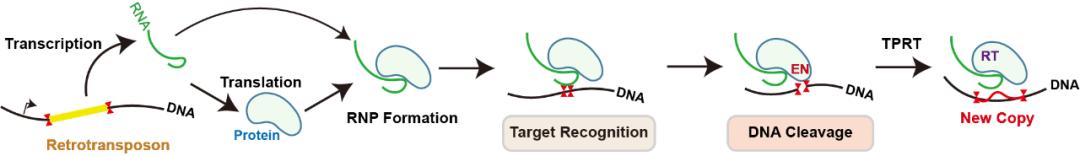
图1. 逆转座子通过“复制-粘贴”在基因组上跳跃的示意图
2023年6月9日,清华大学生命学院刘俊杰(Jun-Jie Gogo Liu)课题组在 Cell 期刊发表了题为:Structural RNA components supervise the sequential DNA cleavage in R2 retrotransposon(R2逆转座子中结构性RNA组分监督顺序性DNA切割)的研究论文【1】。
该研究报道了R2逆转座子的mRNA中存在两段结构性的RNA,共同调控DNA双链的顺序性切割,从而保证逆转座的准确进行。此外,该研究还将第二类内含子(Group II intron)、LINE-1逆转座子与R2逆转座子进行了比较,总结了生物大分子进化过程中,以RNA为主导逐渐过渡到以蛋白质为主导的进化趋势,提出了新颖的见解。

该研究发现,位于R2 mRNA 3'端非翻译区的RNA(3'-RNA)在R2蛋白质切割DNA双链的过程中,表现出促进第一条链切割、抑制第二条链切割的作用;位于5'端翻译区的RNA(5'-RNA)则表现出降低第一条链切割、激活第二条链切割的作用;而当5'-RNA与3'-RNA同时存在时,总是表现出3'-RNA的调控作用,并且完全抑制第二条链的切割。
为了进一步理解其中的分子机制,研究团队解析了R2逆转座子在3'-RNA结合状态和5'-RNA结合状态的高分辨结构。在3'-RNA结合状态中,DNA底物被蛋白质特异性识别,3'-RNA核心区域结合在蛋白质的RNA结合(RNA binding,RB)结构域上。在5'-RNA结合状态中,5'-RNA呈现出复杂的“三爪(three-claw)”结构,紧密包裹住蛋白质核心。值得注意的是,5'-RNA的其中一个爪(Claw3)同样结合在RB结构域上,且生化分析表明,Claw3对激活第二条链切割是必要的。
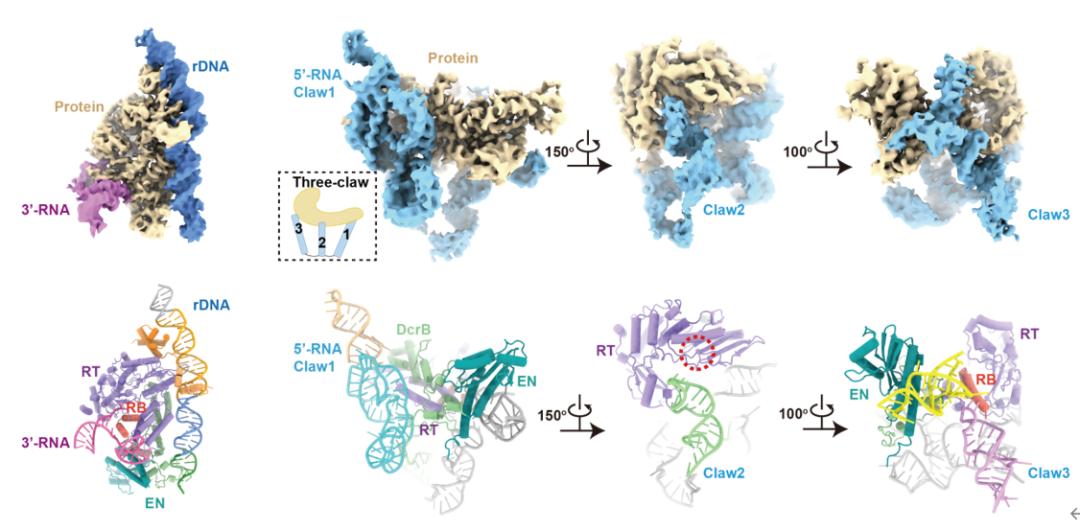
图2. 3'-RNA结合状态(左)和5'-RNA结合状态(右)的复合物结构
此外,研究团队用一段连接序列将5'-RNA与3'-RNA连接成一条RNA,设计了R2全长mRNA的模拟物(L-RNA),并获得了R2逆转座子在L-RNA结合状态的结构。在这个结构中,5'-RNA同样以“三爪”的形式与蛋白质核心紧密结合,但由于3'-RNA的挤占,起激活第二条链切割作用的Claw3未能与RB结构域结合。研究团队发现,L-RNA中3'-RNA与蛋白质RB结构域的结合将抑制第二条链的切割,但当提供dNTP作为原料,使逆转录可以发生后,3'-RNA在作为逆转录模板的过程中逐渐从RB结构域上解离下来,5'-RNA得以与RB结构域结合,从而激活第二条链的切割。
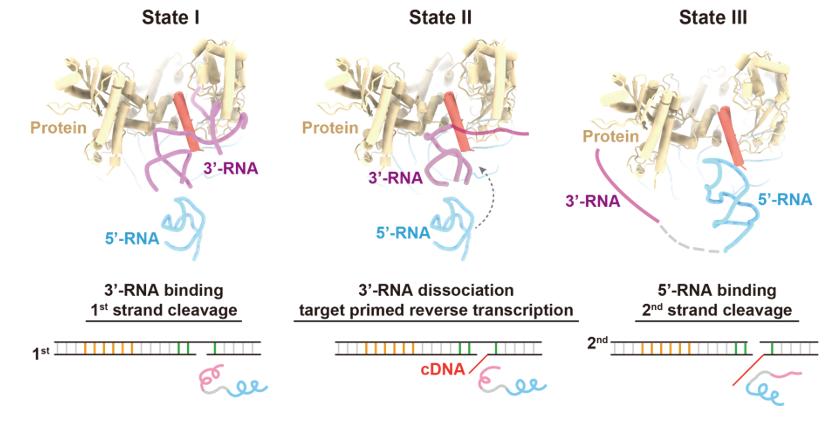
图3. L-RNA结合状态的复合物结构与RNA监督DNA双链顺序性切割的示意图
综合以上分析,课题组总结得出了R2逆转座子在基因组上跳跃的分子机制:R2蛋白质特异性识别28S核糖体DNA序列后,蛋白质RB结构域首先结合R2 mRNA上的3'-RNA,促进第一条DNA链的切割,同时抑制第二条链的切割,仅暴露出第一条链的3'-OH作为引物,从mRNA的3'端起始逆转录过程(Target-primed reverse transcription, TPRT),随着逆转录的进行,位于mRNA 3'端的3'-RNA逐渐从蛋白质RB结构域解离,对第二条链切割的抑制作用得以释放,R2 mRNA上的5'-RNA与RB结构域的结合进一步激活了第二条链的切割。
由此,位于mRNA两端的结构性RNA共同监督了DNA双链的顺序性切割。这种严密的顺序性切割保障了依赖宿主基因表达元件的R2逆转座子进行“有效的增殖”,从而在28S核糖体DNA中不断产生有活性的拷贝。
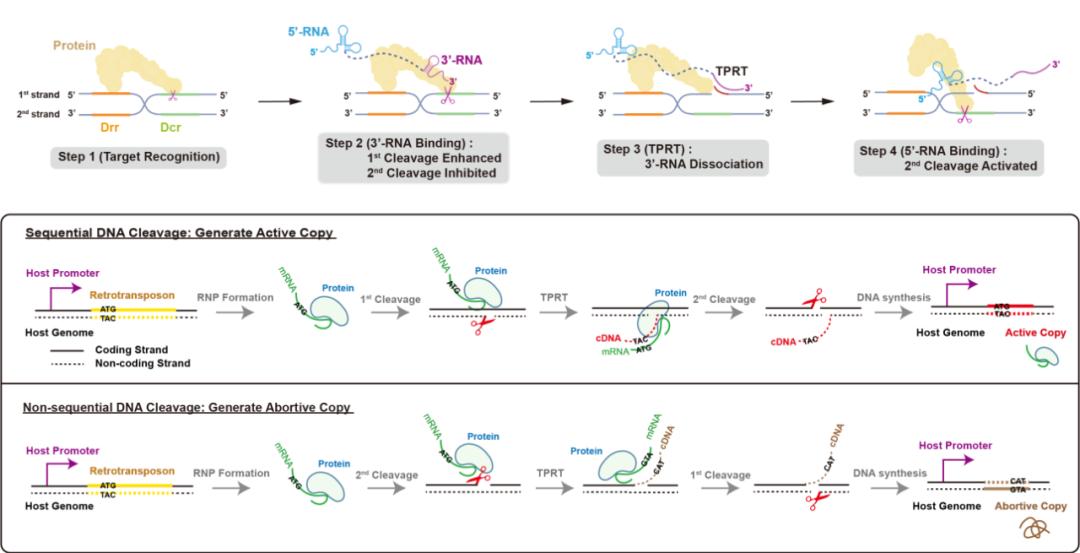
图4. R2逆转座子在基因组上发生跳跃的分子机制与意义
有趣的是,研究团队将低等真核生物的R2逆转座子与其祖先(原核生物第二类内含子,Group II intron)和哺乳动物中的LINE-1逆转座子进行了比较,发现在Group II intron向R2逆转座子及进一步向LINE-1逆转座子进化的过程中,RNA的结构性组分逐渐减少并被编码区域所取代,并且催化功能逐渐从以RNA为主导过渡到以蛋白质为主导,为理解生物大分子进化提供了新的视角。
此外,LINE-1逆转座子在哺乳动物基因组中广泛存在且具有逆转座活性,为基因组提供进化驱动力的同时,也为基因组稳定性和基因表达带来了重大的影响。对R2逆转座子在基因组上跳跃的分子机制的研究,将启发我们思考LINE-1逆转座子这类“自私的基因”与基因组之间精彩的博弈过程。
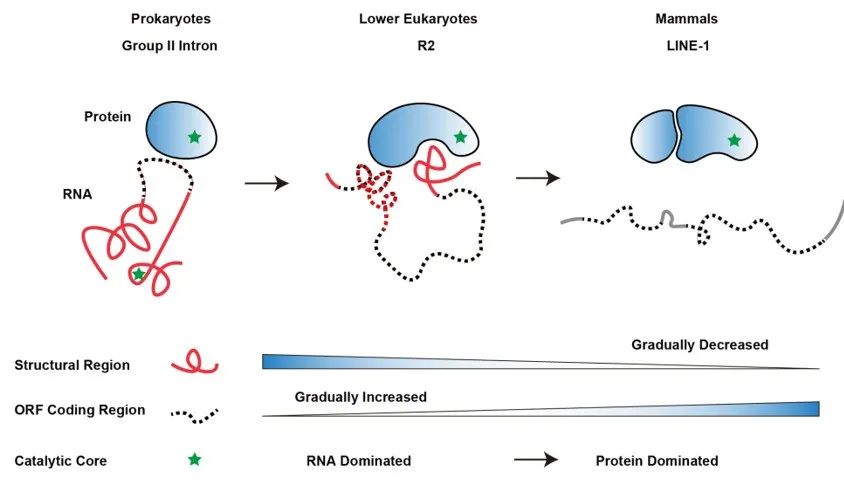
图5. 逆转座子中RNA与蛋白质共进化趋势的示意图
值得一提的是,就在4月份,张锋团队在 Science 期刊发表了题为:Structure of the R2 non-LTR retrotransposon initiating target-primed reverse transcription 的研究论文【2】。
该研究解析了家蚕R2非LTR逆转座子的冷冻电镜结构,并解析了R2基于逆转录酶活性在基因组中插入DNA序列的具体过程,还使用Cas9在体外将R2重定向到非原生序列,证明了R2未来可以作为一种新型RNA引导的基因插入工具。

张锋实验室和刘俊杰实验室的这两项研究成果解析了R2逆转座子在基因组上跳跃和切割DNA的分子机制,为开发基于逆转座子的新型基因编辑工具奠定了基础。
清华大学生命学院刘俊杰助理教授和副研究员王家为论文共同通讯作者;清华大学生命学院博士后邓谱涓和博士生谭顺青为该文共同第一作者;此外,该研究工作得到了中国科学院动物研究所王皓毅研究员、清华大学生命学院张强锋副教授、吝易助理教授等合作者的大力支持。美国Broad研究所张锋教授和Max E. Wilkinson博士在原子模型搭建中提供了宝贵的建议。
清华大学刘俊杰课题组长期关注DNA和RNA核酸酶研究及相关核酸操纵工具的开发和应用。综合运用生物信息学、结构生物学、生物化学和细胞生物学手段,刘俊杰课题组及合作者已鉴定并开发了多种新型基因编辑工具(Nature, 2019;Mol. Cell, 2022;Cell Res., 2023),欢迎对基因编辑或RNA生物学感兴趣,尤其是有细胞生物学或生物信息学等学科背景的同学加入刘俊杰课题组(实验室网页http://gogolab.life.tsinghua.edu.cn)。
论文链接:
https://doi.org/10.1016/j.cell.2023.05.032
参考文献:
Wilkinson, M.E., Frangieh, C.J., Macrae, R.K., and Zhang, F. (2023). Structure of the R2 non-LTR retrotransposon initiating target-primed reverse transcription. Science 380, 301-308.
Liu, J.J., Orlova, N., Oakes, B.L., Ma, E., Spinner, H.B., Baney, K.L., Chuck, J., Tan, D., Knott, G.J., Harrington, L.B., Basem, A.S., Wagner, A., Brotzmann, J., Staahl, B.T., Taylor, K.L., Desmarais, J., Nogales, E., and Doudna, J.A. (2019). CasX enzymes comprise a distinct family of RNA-guided genome editors.Nature 566, 218-223.
Tsuchida, C.A., Zhang, S., Doost, M.S., Zhao, Y., Wang, J., O’Brien, E., Fang, H., Li, C.P., Li, D., Hai, Z.Y., Chuck, J., Brotzmann, J., Vartoumian, A., Burstein, D., Chen, X.W., Nogales, E., Doudna, J.A., and Liu, J.J.G. (2022). Chimeric CRISPR-CasX enzymes and guide RNAs for improved genome editing activity. Molecular Cell 82, 1199-1209. e1196.
Sun, A., Li, C.P., Chen, Z., Zhang, S., Li, D.Y., Yang, Y., Li, L.Q., Zhao, Y., Wang, K., Li, Z., Liu, J., Liu, S., Wang, J., and Liu, J.J.G. (2023). The compact Casπ (Cas12l) 'bracelet' provides a unique structural platform for DNA manipulation. Cell Research 33, 229-244.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




