- +1
药物研发的全新领域:靶向RNA,驶向新蓝海
原创 生物世界 生物世界
编译丨王聪
编辑丨王多鱼
排版丨水成文
根据“中心法则”,DNA转录为RNA,RNA再翻译为蛋白质,DNA负责储存遗传信息,而蛋白质负责执行功能。
2003年,人类基因组计划完成,成功绘制了人类基因组草图,这让我们知道了只有不到3%的基因组编码蛋白质(大约20000种蛋白质),其余的DNA序列大多转录为非编码RNA,而且它们的功能绝大多数是未知的。
实际上,人类约20000种蛋白中有85%-90%基本上是不可成药的,到目前为止,FDA批准的几乎所有药物都是靶向这20000种蛋白中的700多种疾病相关蛋白。
如果我们将药物靶点从蛋白质转向RNA,那么从理论上来说,药物靶点范围将扩大两个数量级。因此,近年来,越来越多的研究人员和医药公司开始关注通过小分子靶向RNA来治疗疾病。
然而,到目前为止,该领域仍没有取得真正意义上的成功。
今年1月份,一家名为 Atomic AI 的初创公司获得了3500万美元A轮融资,该公司的目标是通过人工智能(AI)预测RNA三维结构进而开发靶向RNA的药物。目前这一领域的公司虽然不多,但正在不断增加中。
风险投资人并不是唯一对RNA靶向小分子感兴趣的人,最近不少制药巨头也已开始与这一领域的生物技术公司展开合作,包括罗氏、默沙东、赛诺菲、安进、新基、基因泰克、强生等等。
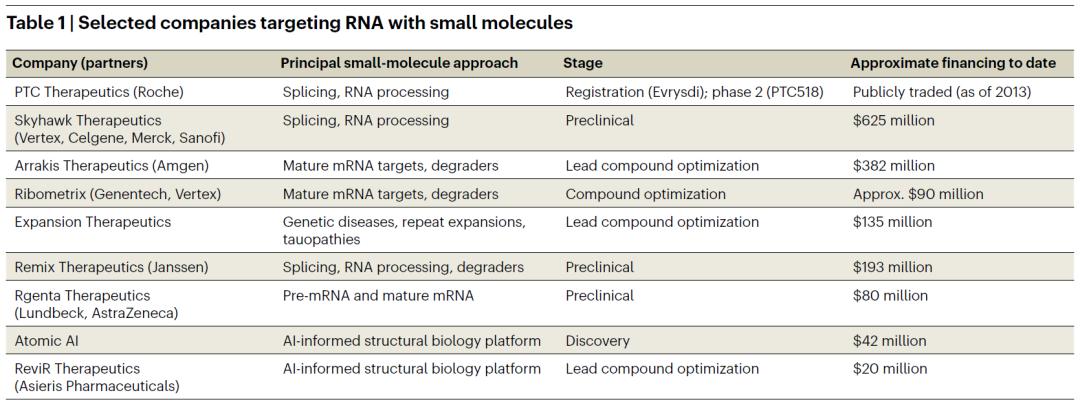
RNA靶向小分子药物开发公司
研究人员希望能够靶向任何RNA,但到目前为止,这一目标还遥不可及。几十年来,制药公司认为RNA的极性太强,它们暴露在细胞质溶液中,小分子化合物难以克服水屏障到达RNA的表面并与其结合。
现在很清楚的是,RNA包含了小分子可以结合且确实能够结合的结构,但目前仅报道了少数几个具有明确功能的RNA结合化合物。
开发靶向RNA的小分子药物,这是一个全新的领域,从发现平台、先导化合物到疾病适应症都受到了严格保密,各家公司都攥紧了自己的底牌,押下了截然不同的赌注,以至于外界甚至难以判断谁会最终胜出。
这些公司押注的方向也反映了该领域存在的重大分歧:
1、是靶向细胞核中的前体mRNA(pre-mRNA),还是靶向细胞质中的成熟mRNA?
2、是进行表型筛选以鉴定功能活性分子,还是针对已知靶标筛选结合物?
3、是优先考虑与某些高复杂性RNA结构结合的分子,还是专注于具有更大治疗潜力的简单RNA序列?
靶向RNA剪接过程
理论上,RNA生命周期的任何阶段都可以被小分子靶向。
许多公司都在靶向前体mRNA(pre-mRNA),但随着PTC Therapeutics和罗氏合作开发的脊髓性肌萎缩症(SMA)治疗药物Evrysdi的成功,证明了RNA加工过程是可被药物干预的。
在真核生物中,DNA会先转录出前体mRNA(pre-mRNA),pre-mRNA中还含有内含子序列,细胞的RNA剪接机制会将其中的内含子移除并将外显子重新连接在一起,经过进一步修饰后输出到细胞质中并翻译成蛋白质。
脊髓性肌萎缩症(SMA)患者的SMN1基因发生了突变或缺失,但他们都还有SMN2基因。与SMN1基因相比,SMN2基因的外显子7的第6位核苷酸出现C•G-to-T•A替代,这导致其mRNA跳过外显子7,表达的SMN蛋白会被截短并迅速降解。
而Evrysdi能够pre-mRNA-snRNP结合,驱动pre-mRNA在RNA剪接过程中保留外显子7,从而产生功能正常的SMN蛋白,弥补SMN1基因的突变或缺失,恢复患者的部分运动能力。这种作用机制开辟了通过靶向RNA剪接过程调控基因表达的全新治疗领域。
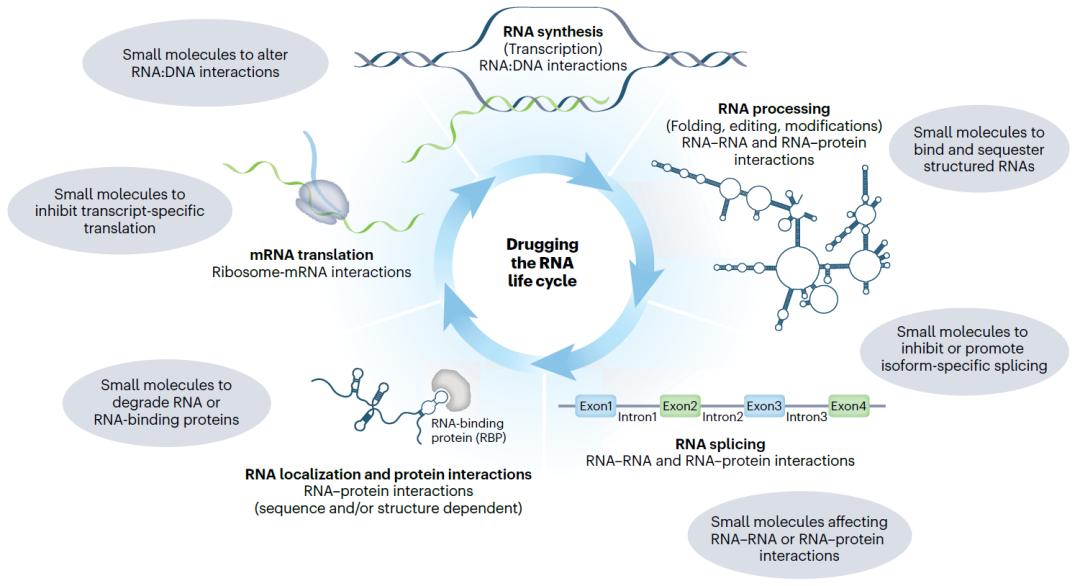
对RNA生命周期进行药物靶向,图片来自ReviR Therapeutics
Remix Therapeutics是一家靶向RNA加工过程的药物开放公司,他们主要聚焦于癌症和神经退行性疾病。RNA剪接因子的突变影响了大约20%的急性髓系白血病、10%-15%的慢性淋巴细胞白血病,以及较小比例的几种实体瘤。Remix正在寻找能够纠正或补偿这些剪接缺陷的RNA结合小分子。
和Remix一样,Skyhawk Therapeutics也在研究癌症和神经退行性疾病。DNA和mRNA核苷酸重复扩增是亨廷顿症(HD)的标志,也是渐冻症(ALS)的常见形式。Skyhawk开发的RNA结合化合物通过降低或增加RNA水平,改变蛋白质的功能。
靶向RNA剪接的先驱PTC Therapeutics除了已获批上市的治疗脊髓性肌萎缩症(SMA)药物Evrysdi外,还有10-15个项目正在研发中,它们能够选择性靶向调控RNA剪接过程中的不同方面。
另外一种靶向RNA剪接的策略是在mRNA中插入假外显子(毒性外显子),将编码了提前终止密码子的序列拼接到编码区,从而让mRNA编码提前终止并降解。
诺华公司开发的小分子药物branaplam在临床研究中显示,其能够改变亨廷顿基因的mRNA剪接,在其成熟mRNA中引入一个假外显子,诱导mRNA的降解,从而降低致病亨廷顿蛋白的表达。但在去年8月,诺华公司暂停了该药物治疗亨廷顿症的临床试验,原因是其可能会导致周围神经病变,并在之后直接停止了该项目的研发。PTC Therapeutics也在开发用于治疗亨廷顿症的小分子假外显子诱导剂,并推进到了全球2期临床试验阶段,但在去年10月份,FDA暂停了该临床试验的美国部分。
小分子对RNA的这些调节方式的治疗潜力超过由异常剪接引起的一系列罕见疾病,因此研究人员也希望将这种方法应用到常见疾病(例如癌症)的治疗。但这种靶向RNA剪接的药物在具有剪接突变的常见疾病中的最终效果,仍然存在疑问。有观点认为,这些剪接突变不是疾病的单一驱动因素,而是异常剪接产物的积累导致了一种“剪接疾病”状态,如果是这样的话,那么针对单个剪接缺陷的药物可能就没那么有效。
超越剪接
靶向前体mRNA或前体mRNA的剪接加工过程,已有一些临床试验甚至已上市药物。但靶向成熟mRNA还没有经过临床验证,甚至很少有项目披露。
据悉,Skyhawk Therapeutics、Ribometrix 都在开发靶向成熟mRNA的小分子药物,但它们并未披露更多信息。Arrakis Therapeutics 则披露了部分信息,他们正在开发靶向癌症中编码MYC转录因子的成熟mRNA的小分子化合物,目前该化合物处于先导优化阶段,它能够结合并稳定mRNA的5'UTR中的一个结构,从而影响核糖体扫描过程。
而 Expansion Therapeutics 则通过其创始人 Matthew Disney 开发的RIBOTAC技术,来靶向消除致病RNA,例如肌强直性营养不良、遗传性渐冻症、额颞叶痴呆等疾病中的序列异常扩增。
克服瓶颈
小分子靶向RNA的药物研发领域第二大分歧是药物发现策略。目前主要有两种药物发现策略,一种是进行表型筛选以鉴定功能活性分子,一种是针对已知RNA靶标筛选可结合的化合物。这两种方法都各有优点和缺点。
PTC Therapeutics早期通过表型筛选产生了一些化合物,并最终开发出了治疗脊髓性肌萎缩症(SMA)的药物Evrysdi。他们将SMN2基因的截短基因序列(缺少外显子7)融合到荧光素酶报告基因中,该序列只有在包含外显子的SMN2全长表达时才会发荧光。将其转染到永生化细胞系中,对大约20万种化合物进行筛选,进而发现了候选化合物。
这种表型筛选方法在实际操作过程中,可能完全筛选不到,也可能产生大量假阳性结果,工作量堪比大海捞针。因此,一些公司开始通过人工智能(AI)来加快这一筛选过程。
然而,针对已知的RNA靶标进行筛选,也有一个不容忽视的大问题——非特异性结合。很多化合物可与RNA非特异结合,这意味着这些化合物具有脱靶效应,可能导致潜在副作用。
Remix公司表示,他们通过使用具有功能性的高通量筛选平台,大大加快了药物发现的速度,从而消除了RNA靶向小分子药物发现的瓶颈。Ribometrix公司则表示,他们在去年已经基本解决这一瓶颈,现在可以很快锁定筛选结果中真正可操作的化合物。但这两家公司都没有进一步透露如何做到这一点的细节。
RNA靶向小分子药物发现的另一个瓶颈是,搞清楚一种结合RNA并改变其生物学的化合物究竟是如何发挥作用的。它们会直接干扰翻译过程吗?会影响mRNA半衰期吗?会激活mRNA降解吗?其作用机制甚至可能与结合事件本身无关。
归根结底,我们对RNA结构-功能关系的了解还远远不够,我们知道RNA有结构、知道RNA有功能,但RNA结构是如何决定其功能的?我们还不清楚。
靶点之争
该选择什么靶点,这可能是该领域最具争议的分歧,药物开发公司是应该追求RNA中的复杂结构靶点,还是有明确治疗效果的简单靶点?
双链DNA转录成单链RNA,这些单链RNA会先折叠成各种二级结构(螺旋),然后这些二级结构相互作用形成复杂的三级结构,其中包括假结(pseudoknots)。
北卡罗来纳大学化学生物学家 Kevin Weeks 教授表示,当选择一个RNA结构元件为靶点时,复杂性或者局部复杂性是重要的,三级结构中的假结可能是不错的选择,因为这种复杂的基序很容易包含或毗邻RNA中的药物结合口袋。RNA的三级结构越复杂,就越独特,结合化合物就越有可能具有特异性。主要有二级结构组成的RNA基序,包括miRNA,它们只具有小的或浅的药物结合口袋,它们或许能够被靶向,但很有挑战性。
而 Expansion Therapeutics 公司并不这么认为,他们正在开发靶向肌强直性营养不良的mRNA中的CUG三核酸重复的药物。该公司创始人 Matthew Disney 教授表示,大量数据表明,可以使用具有高亲和力和特异性的小分子靶向重复扩增或致癌性RNA序列。除了直接靶向重复序列外,Matthew Disney 实验室还在通过靶向mRNA调控序列来破坏蛋白质翻译。在他看来,该领域应该优先考虑经过遗传验证的靶点,而不是局限于某些复杂的RNA结构基序。这一领域目前已经投入了巨大的资金,所以我们现在更大的问题不是去讨论出一种完美的方案,而是应该实际一些,追求一些能够帮助病患的东西。
进入AI时代
人工智能(AI)已经开始通过预测小分子结合的最佳RNA三级结构来为这场争论提供信息。
在核苷酸水平分辨率下工作的化学方法只能提示或排除潜在的结合位点。核磁共振结构研究提供了原子水平的信息,但其在小RNA上效果最好,因为小RNA不太可能有药物结合口袋。RNA的X射线晶体结构很少,因为RNA不稳定,比蛋白质更不容易形成晶体。
受到AI预测蛋白结构工具AlphaFold和RoseTTAFold的巨大成功的启发,2022年8月26日,斯坦福大学的研究团队在 Science 期刊发表了题为:Geometric deep learning of RNA structure 的研究论文,该论文还被选为当期封面论文。
该研究利用机器学习技术开发了一种新型RNA三维结构预测模型,能够以前所未有的准确度预测RNA三维结构,为以RNA为靶点的药物研发奠定了基础。

2021年5月,该团队成立了初创公司 Atomic AI,进一步完善该AI预测RNA结构的模型并将其用于药物发现,目前该公司已完成两轮融资,共计4100万美元。
Atomic AI 创始人 Raphael Townshend 博士,仅仅模仿AlphaFold的方法对RNA结构预测来说是不够的,因为用于训练和验证的RNA结构数据要远远少于蛋白质结构数据。Atomic AI 的模型通过从少量数据中进行的有效学习,克服了标准深度神经网络的主要限制,只需输入RNA分子的原子坐标,无需其特定的空间信息,通过调整参数,能够了解每个原子的功能和空间排列、识别碱基配对规则、RNA螺旋最佳几何形状,从而预测RNA三维空间结构。
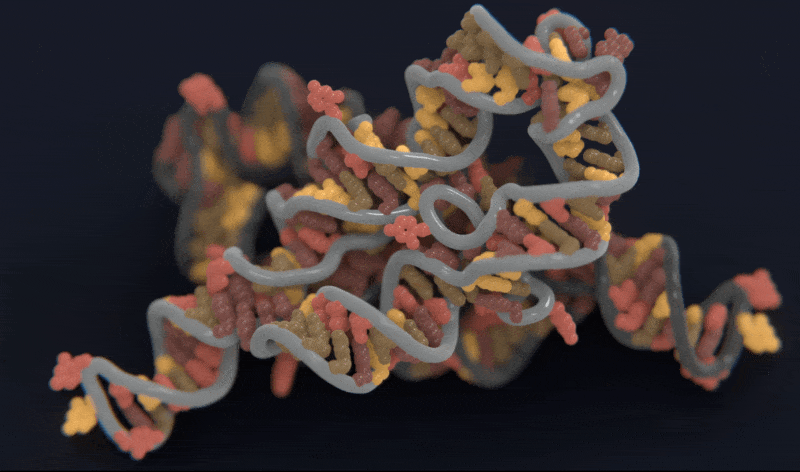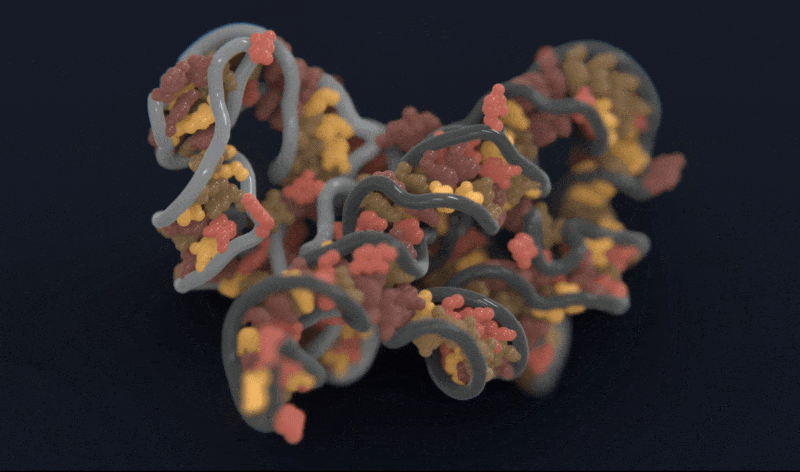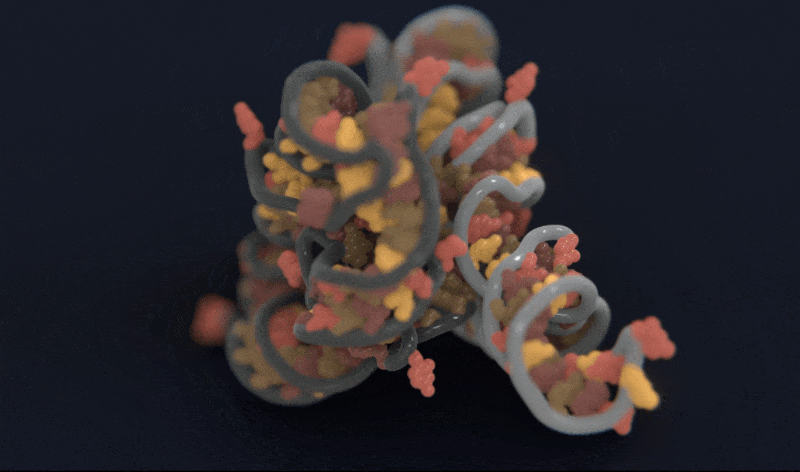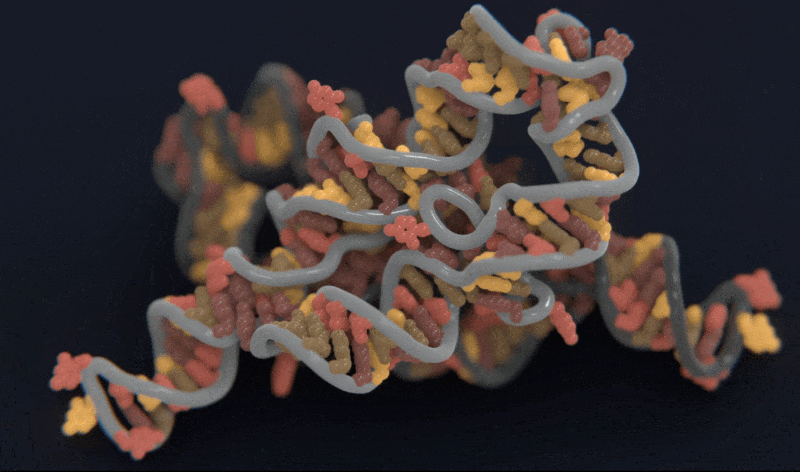
Atomic AI 预测的RNA链的三维结构模型
但到目前为止,小分子靶向RNA领域的大多数还没有开始应用人工智能(AI),Atomic AI 也尚未公布其算法。也有其他公司认为,AI技术希望无限,但目前的炒作太多,我们必须要看到AI真正能够带来什么帮助。
据悉,Atomic AI 正在通过AI预测来构建一个“口袋组”图谱,即转录组中每一个RNA三级结构的图谱,从而帮助靶向那些看起来最有希望的基因,将它们作为首要靶点,而不是只关注单一的转录本。
RNA降解剂
围绕在小分子靶向RNA周围的诸多争论,还有一个解决方案,那就是开发出一种小分子RNA降解剂,通过招募细胞中的效应蛋白来降解目标RNA。PROTAC技术就是利用类似的想法来降解细胞中的目标蛋白。
Arrakis Therapeutics 正在开发一种名为NUTAC(核酸靶向嵌合体)的小分子降解剂,像PROTAC一样,NUTAC是一种小分子,将RNA粘合剂连接到触发降解的宿主效应分子上,具体细节尚不清楚。
而 Expansion Therapeutics 的创始人 Matthew Disney 教授开发了第一个靶向RNA降解剂——RIBOTAC(靶向核糖核酸酶嵌合体),他的实验室发表的一系列研究显示,RIBOTAC可以降解渐冻症(ALS)和额颞叶痴呆(FTD)的mRNA中的序列重复扩增。他们上个月在 Nature 发表的论文显示,基于RIBOTAC的小分子能够特异性降解癌症相关的miR-155、JUN、MYC基因的pre-mRNA。
从理论上来说,RNA降解剂可以破坏它们结合的任何RNA,因此需要更加慎重,以防止脱靶效应,但好在RNA测序可以观察候选的降解剂对细胞中每种RNA的影响,从而排除那些非特性结合的降解剂。虽然如此,脱靶性任然令人担忧,这也是有些公司选择在致命癌症首先进行测试的原因,这些患者对副作用的接受度更高。
与PROTAC一样,劫持细胞内的RNA降解机制也会干扰细胞中的正常生物学,此外,还需要考虑到基因的反馈调节,降解一个基因的mRNA后,细胞可能会通过上调该基因的转录来维持平衡。RNA靶向小分子领域正在吸引越来越多的关注和资金投入,上述这些问题最终都应该得到解答。
近年来,RNA药物的出现,例如siRNA、ASO,以及mRNA药物,颠覆了传统药物研发逻辑。相比寥寥数百种蛋白质药物靶点,RNA可以说是一片蓝海,以RNA为靶点,将会极大地扩展药物靶点选择,为新药研发开辟广阔天地。
参考资料:
https://www.nature.com/articles/s41587-023-01790-z
https://www.science.org/doi/10.1126/science.abe5650
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




