- +1
文献精读 | 睡眠特异性中脑核团参与七氟烷麻醉进程
原创 邱越 山中麻署

背 景
BACKGROUND
七氟烷是目前应用广泛、苏醒良好的吸入麻醉药,但其麻醉作用的确切机制仍未完全阐明。既往研究提示七氟烷通过广泛抑制新皮质区实现全身麻醉,这种广泛抑制的神经基础可能是GABAA受体的激活和抑制性输入的增强。尽管睡眠和全身麻醉有许多不同之处,但许多证据表明它们有一些共同的特征,如二者均存在不同程度的意识丧失和遗忘现象,且麻醉药物也可以通过影响促进睡眠/觉醒的核团发挥作用。近期报道开始强调全身麻醉剂对促进睡眠相关核团的兴奋作用,然而尚不清楚七氟烷是否也如此。
在本研究中,作者发现七氟烷激活了中脑动眼神经副核(Edinger-Westphal,EW)内的神经元簇。EW核分为前区(EWpg)和中央区(EWcp)。其中EWpg是动眼神经核复合体的一部分,控制睫状反射。包含多种类型的神经元,包括尿皮质素1(UCN1+)/可卡因和苯丙胺调节转录物(CART+)肽能神经元、多巴胺能神经元和谷氨酸能神经元。行为学证据表明,EWcp与成瘾、注意力、母体预备筑巢、应激反应和恐惧调节有关,但这些不同细胞类型的确切作用仍不清楚。此外,EWcp细胞的部分下游脑区,如下丘脑、中缝背侧和腹外侧导水管周围灰质,参与睡眠/觉醒控制。
本文中,作者发现七氟烷激活了一簇尿皮质素1 (urocortin 1, UCN1+)/可卡因和苯丙胺调节转录物(cocaine- and amphetamine-regulated transcript, CART+)神经元。此外,促生长激素分泌激素受体(GHSR)在七氟烷激活的UCN1+/CART+细胞中高度富集,同时其是睡眠诱导所必需的。阻断GHSR可消除七氟烷对UCN1+/CART+神经元的兴奋作用,减弱其麻醉作用。综上所述,作者表明中脑UCN1+/CART+神经元的GHSR参与了七氟烷诱导的麻醉作用,为麻醉机制提供了新靶点。
结 果
RESULTS
七氟烷可激活与睡眠相关的中脑神经元
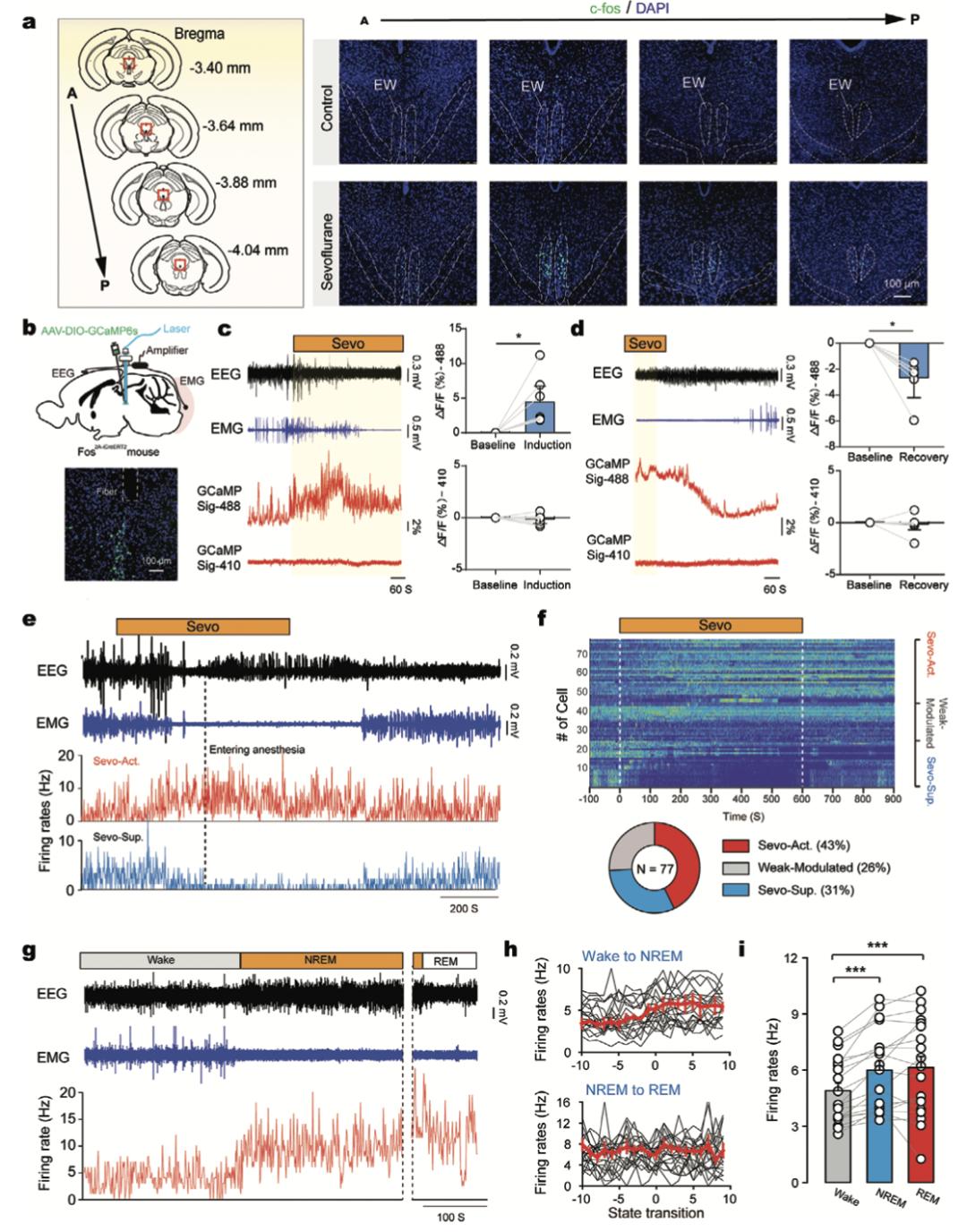
给予C57/BL6小鼠2%七氟烷或纯氧暴露2h,观察全脑c-fos表达情况。结果发现中脑EWcp区有一簇明显的c-fos+神经元集群(图1a, 矢状缝后−2.80 ~ −4.2 mm)。为观察七氟烷所激活的神经元的动态活动,作者利用活性类群靶向重组(targeted recombination in active populations, TRAP)技术特异标记七氟烷激活的神经元,将AAV2/9-Ef1a-DIO-jGCaMP6s注射到Fos2A-iCreERT2小鼠的EWcp区域,从病毒注射后1周开始连续5天腹腔内注射他莫昔芬以诱导重组酶表达。随后将这些小鼠进行七氟醚暴露,使被激活的神经元特异性表达GCaMP6s(图1b),并采用光纤记录七氟烷激活神经元中的Ca2+活动,同时进行脑电图(EEG)和肌电图(EMG)监测。以EEG中观察到慢波功率升高且EMG活动达到最小定义为进入麻醉状态。给药后七氟烷激活的神经元Ca2+活动逐渐升高;进入麻醉状态后,七氟烷激活的神经元Ca2+活性达到较高水平(图1c)。此外,由于也有研究报道利用EEG的爆发抑制来评估受试者是否进入无意识和深麻醉状态,作者也以该标准分析了数据。与基线相比,深麻醉状态下七氟烷激活的神经元活性显著增加。相反,停止七氟烷给药后,Ca2+活性开始下降(图1d)。这些结果进一步表明,七氟烷可激活EWcp区的某群神经元。
此外,作者在七氟烷激活的EWcp脑区利用多通道电极阵列记录了单个神经元活动。共记录了77个细胞(n=16只小鼠),有43%的神经元在2%七氟烷麻醉下放电率升高(图1e、f)。几乎所有神经元(30/33,91%)的放电率均在七氟烷给药后逐渐升高,而在达到麻醉状态后放电率达到峰值。这一动力学特征提示,七氟烷激活的细胞是在进入麻醉的同时便开始工作,而不是在达到麻醉状态后才发生间接的活动改变。
作者进一步观察到,这群七氟烷激活的细胞(19个细胞,n = 10只小鼠)放电率在NREM发生过程中也逐渐增加(图1g),而在从NREM向REM过渡期间并无显著差异(图1h)。统计结果表明,这些细胞在NREM和REM睡眠期间表现出最高水平的放电率,在觉醒期间表现出最低水平的放电率(图1i)。以上结果均提示,七氟烷激活了睡眠相关的中脑神经元。
▲ 图 1
七氟烷激活的中脑神经元参与了其麻醉效应
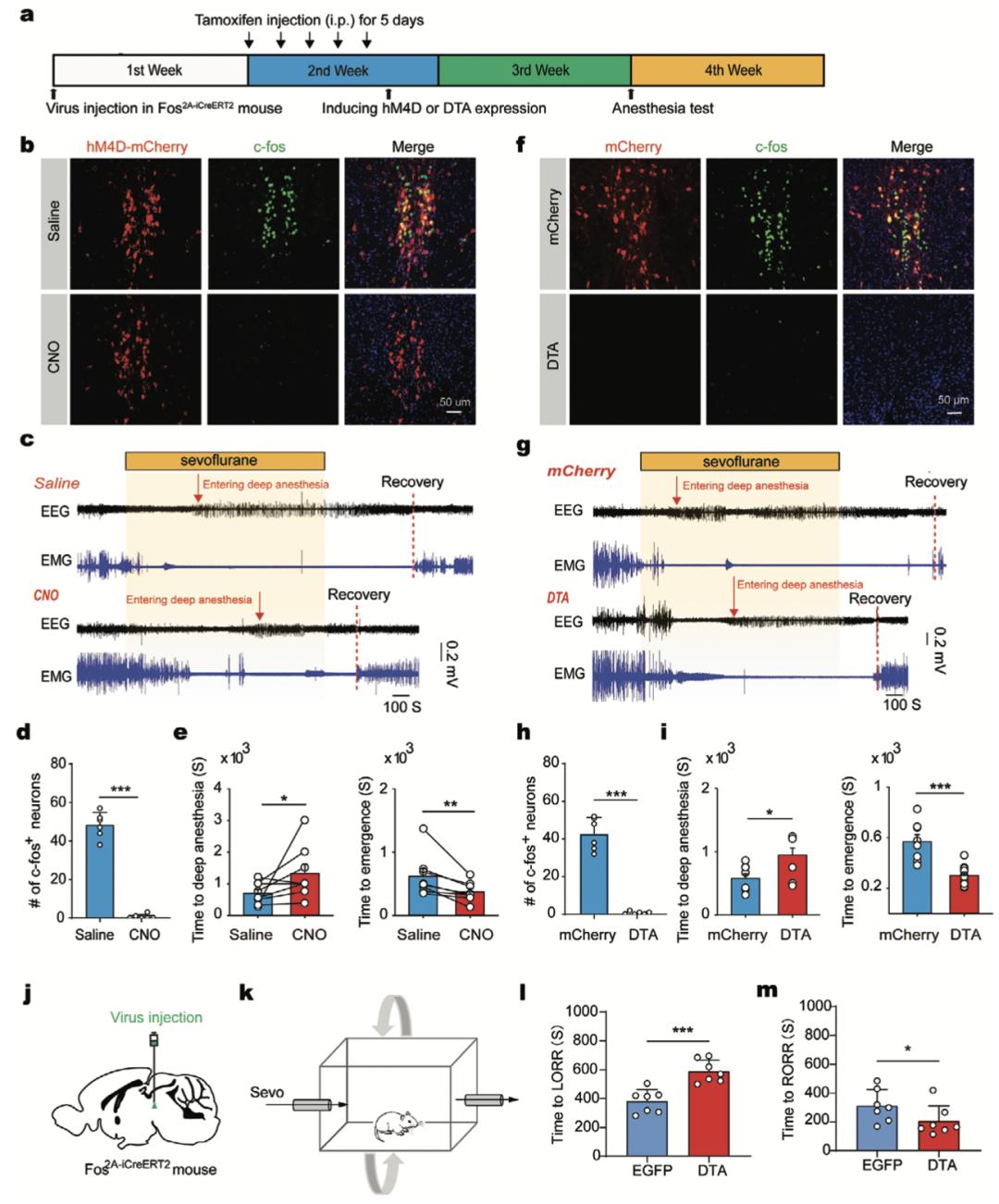
利用TRAP技术特异性抑制七氟烷激活的神经元,首先将AAV2/9-hSyn-DIO-hM4D(Gi)-mCherry注射到Fos2A-iCreERT2小鼠的EWcp区,在注射后1周开始连续5天腹腔注射他莫昔芬。随后将该小鼠进行七氟醚暴露以使七氟烷激活的神经元标记上hM4D-mCherry。约有80%的TRAP标记的神经元为c-fos阳性,提示TRAP可以特异性标记七氟烷激活的神经元。由于麻醉过程中需要对这群细胞进行几十分钟的抑制,作者选用了化学遗传而不是光遗传学方法来抑制细胞(图2a、b)。在脑片中对这群hM4D-mCherry+的神经元进行全细胞膜片钳记录,结果表明CNO可有效抑制这群神经元。在体实验结果显示,在CNO注射后,七氟烷激活的中脑区域几乎没有c-fos的表达(图2b、d)。
随后作者分别计算了EEG中θ(4-12 Hz)和δ(0.5-4 Hz)的功率,并将θ / δ功率比下降到发生爆发抑制的时间点作为麻醉诱导期。利用CNO抑制七氟烷激活的神经元后,七氟烷诱导期内θ/δ比值更高,并且显著延长了诱导时间(图2c、e)。同样CNO注射后,小鼠恢复时间也显著缩短(图2c、e)。而在WT对照鼠或是仅表达mCherry的小鼠中,CNO注射并不会引起这些指标的改变。综上所述,CNO通过选择性抑制七氟烷激活的神经元进而降低了七氟烷的敏感性,而并非CNO本身有此效应。
为了证实上述发现,作者利用TRAP方法消融了七氟烷激活的神经元(图2a),证实DTA诱导的细胞消融的有效性和特异性(见文章附图)。DTA诱导消融后,TRAP神经元中几乎未见c-fos表达(图2f、h),同时麻醉诱导期间的θ / δ功率比显著升高,麻醉时间显著延长,且麻醉恢复时间显著缩短(图2g、i)。
作者进一步利用行为学研究(翻正反射)验证七氟烷激活神经元是否为七氟烷麻醉的重要靶点。消融七氟烷激活的中脑细胞确实延长了麻醉诱导过程,并加速了麻醉苏醒(图2j-m)。总之,这些发现表明,这些七氟烷激活的中脑神经元是其麻醉作用的重要组成部分。
▲ 图 2
七氟烷激活的中脑神经元是GHSR富集的UCN1+/CART+神经元,参与诱导睡眠发生
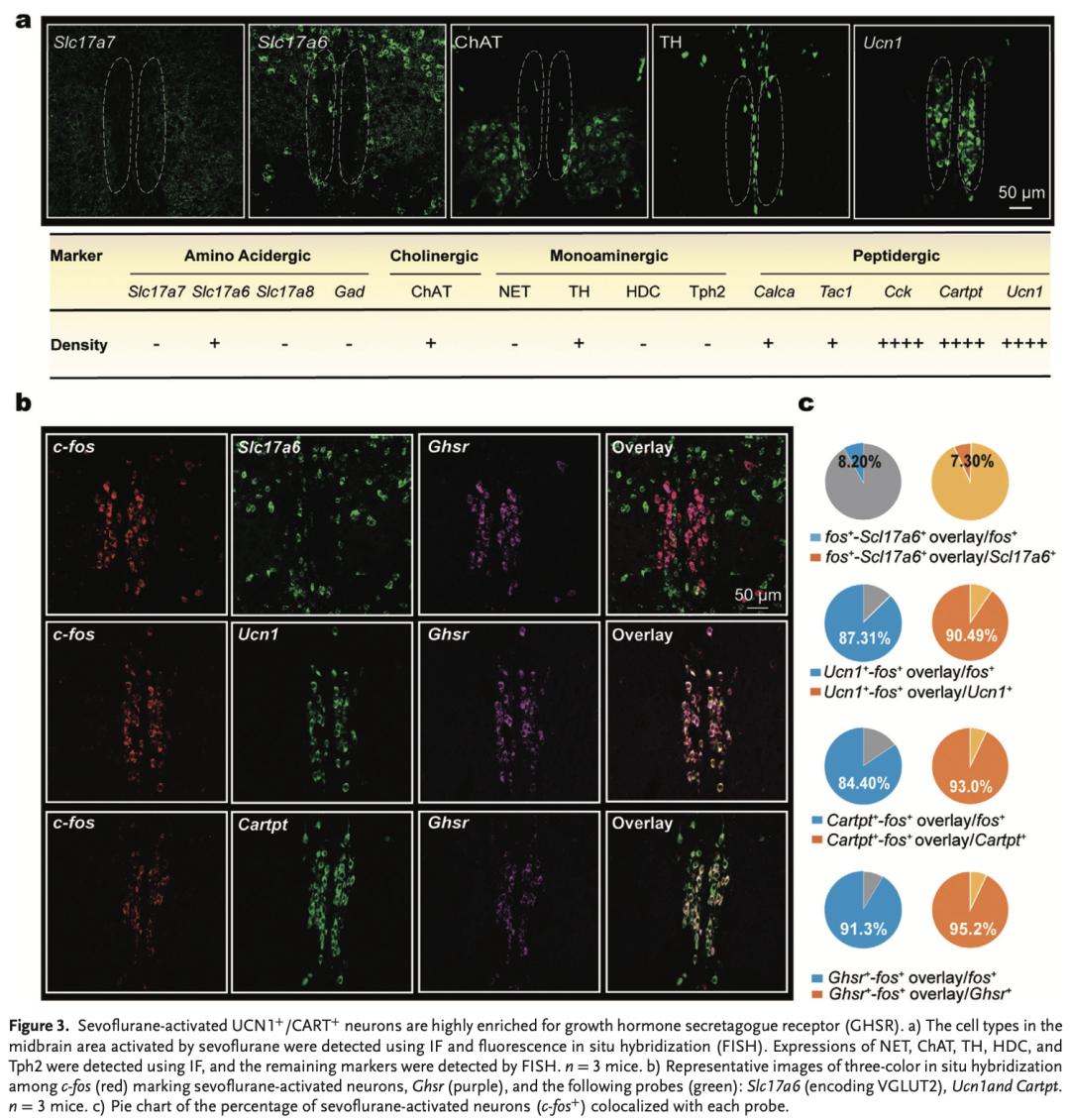
作者进一步利用IF和FISH探索了七氟烷激活的EW区的细胞类型,发现七氟烷激活的中脑区存在谷氨酸能、GABA能、胆碱能、多巴胺能、降钙素基因相关多肽α(CALCA)+、P物质、胆囊收缩素(CCK)+、UCN1+等多种类型的神经元(图3a)。其中,只有很小一部分是谷氨酸能和GABA能神经元(图3b、c)。有趣的是,编码CART的Cartpt与c-fos以及Ucn1与c-fos的表达重叠均达到近90%(图3b、c)。而FISH显示Cartpt和Ucn1的标记完全重叠(>98%,见文章附图)。这些结果表明,七氟烷激活的神经元主要是UCN1+和CART+神经元,而不是谷氨酸能和GABA能神经元。因此在下文中,作者将七氟烷激活的细胞命名为UCN1+/CART+神经元。
Allen小鼠脑图谱的原位杂交图和其他研究表明, GHSR的mRNA在EW区高表达。作者也在七氟烷激活的中脑中观察到了GHSR的高水平表达,且FISH显示GHSR主要(95%)与七氟烷激活的c-fos+和UCN1+/CART+神经元共定位,而不与谷氨酸能神经元共定位(图3b、c)。
▲ 图 3
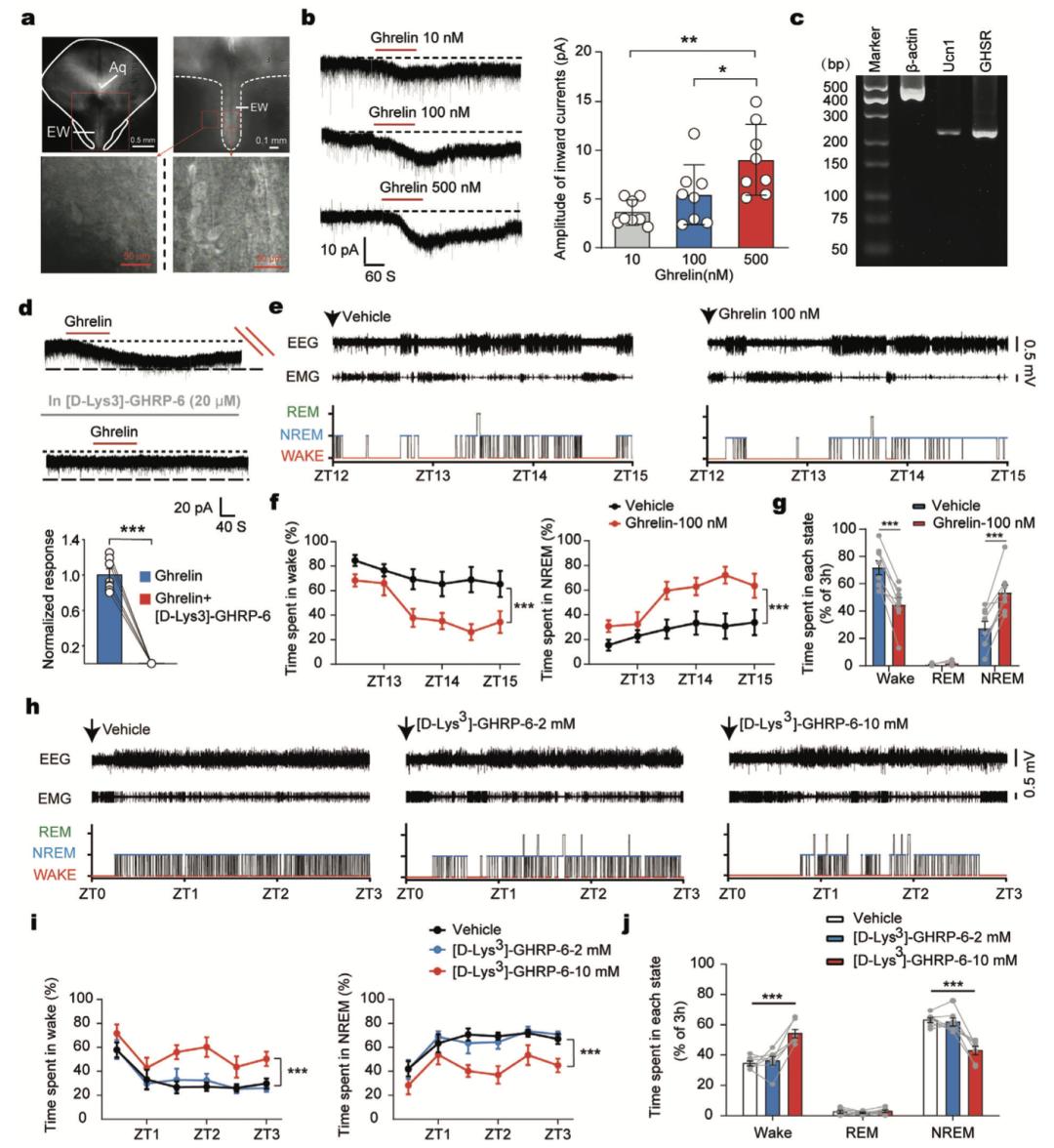
饥饿素(ghrelin)作为GHSR的激动剂,被报道可促进人类的慢波睡眠。由于观察到七氟烷激活的UCN1+/CART+细胞在睡眠时活跃,作者进一步假设ghrelin/GHSR信号通路可能激活UCN1+/CART+神经元,且该通路对生理性睡眠的诱导也是必需的。作者使用全细胞膜片钳记录七氟烷激活的中脑区域的神经元。EWcp中脑区域在急性脑片中表现出强透光性,因此被称为光区,而周围区域表现出弱透光性,比EWcp区域更暗(图4a)。对于所有记录的细胞,ghrelin产生的内向电流呈浓度依赖性(图4b)。scRT-PCR联合全细胞重编码表明,可应答ghrelin并产生内向电流的所有神经元(n = 11)中,UCN1和GHSR均有表达(图4c)。GHSR拮抗剂可阻断ghrelin诱导的内向电流(图4d),表明GHSR激活可兴奋UCN1+/CART+神经元。随后,作者在黑暗期开始时(18:00,ZT12)给小鼠局部注射ghrelin或生理盐水(此时小鼠大部分时间处于清醒状态)。当局部注射低浓度(10 nM)的胃饥饿素时,睡眠-觉醒行为不受影响(文章附图),而当浓度增加到100 nM时,与生理盐水对照组相比, NREM睡眠显著增加(图4e-g)。
随后进一步探索了生理条件下内源性ghrelin/GHSR信号是否参与了睡眠的发生。在光照初期(6:00,ZT0),作者在中脑EW区局部注射GHSR拮抗剂或生理盐水(此时小鼠大部分时间处于睡眠状态)。局部注射低浓度GHSR拮抗剂(2 mM)不影响NREM或REM睡眠时间,但当GHSR拮抗剂浓度达到10 mM时,觉醒显著增加(图4h-j)。以上结果表明,ghrelin/GHSR信号通路对UCN1+/CART+神经元的兴奋性作用可以调控生理条件下的睡眠发生。
七氟烷的麻醉作用依赖于UCN1+/CART+神经元中GHSR的激活
为明确UCN1+/CART+神经元中促进睡眠的ghrelin/GHSR信号是否参与了七氟烷麻醉,作者进行了进一步探究。前人研究表明,0.03% ~ 0.4%七氟烷可在诱导与ghrelin的相似的效应,作者也证实七氟烷可在EWcp区域诱导剂量依赖性内向电流,并且暴露后出现内向电流的所有神经元(n = 11)均为UCN1阳性,而VGLUT2阴性(文章附图)。在电流钳模式下,七氟烷使膜电位去极化,并强烈增加了UCN1+/CART+神经元的放电频率。而在暗区记录的其他一些细胞对七氟烷无反应或有外向电流反应。进一步增加了七氟烷激活的中脑EWcp区及其周围记录的细胞数量(n = 173)之后结论类似。并且七氟烷直接兴奋UCN1+/CART+神经元,而不依赖于突触传递(见文章附图)。
由于GHSR的激活可以使 UCN1+/CART+ 神经元被激活,作者探究了是否七氟烷也是通过该通路进行作用。在低浓度(10 μM) GHSR拮抗剂存在的情况下,七氟烷引起的向内电流在UCN1+/CART+神经元中可减少40%(见文章附图);而较高浓度(20µM)的GHSR拮抗剂可完全阻断七氟烷引起的内向电流(图5a)。作者通过慢斜坡指令实验探讨了七氟烷诱导内向电流的离子机制。七氟烷诱导的内向电流的逆转电位约为- 30 mV,非常接近非选择性阳离子通道(NSCC)的平衡电位(图5b)。且已有研究证实GHSR可激活刺激下游磷脂酶C-蛋白激酶C通路进而调节NSCC。因此,作者推测NSCCs可能介导了七氟烷诱导的内向电流。在NSCC阻滞剂(FFA, 300µM)作用下,七氟烷诱导的电流几乎完全被阻断(图5c),表明NSCC是七氟烷诱导内向电流的主要离子通道。
此外,利用基于GHSR结构的计算模型来预测七氟烷的GHSR结合位点。GHSR属于A类G蛋白偶联受体,其变构结合位点可能与位于TM结构域区域的垂直位结合位点相接触。为了预测确切的结合位点,作者将七氟烷停靠在GHSR的不同结合位点上,发现它可以停靠在垂直位位结合点下的变构袋中,结合自由能为- 5.4 kcal/mol。在七氟烷/GHSR对接模型中,七氟烷通过与Thr276、Phe 272、Ala271、Cys275、Ser 315、Asn319和Ile318的疏水作用与变构袋相互作用(图5d)。
最后,作者探索了UCN1+/CART+神经元上的GHSR是否是七氟烷麻醉必要的。在七氟烷激活的中脑EW区局部输注GHSR拮抗剂(10 mM),分析脑电功率谱以精确判断小鼠是否进入麻醉状态。GHSR拮抗剂增加了七氟烷麻醉诱导期间的theta/delta功率比,延长麻醉诱导时间。此外,在GHSR拮抗剂存在的情况下,七氟烷麻醉恢复时间也显著缩短(图5,e-h)。提示GHSR激活参与了七氟烷麻醉。
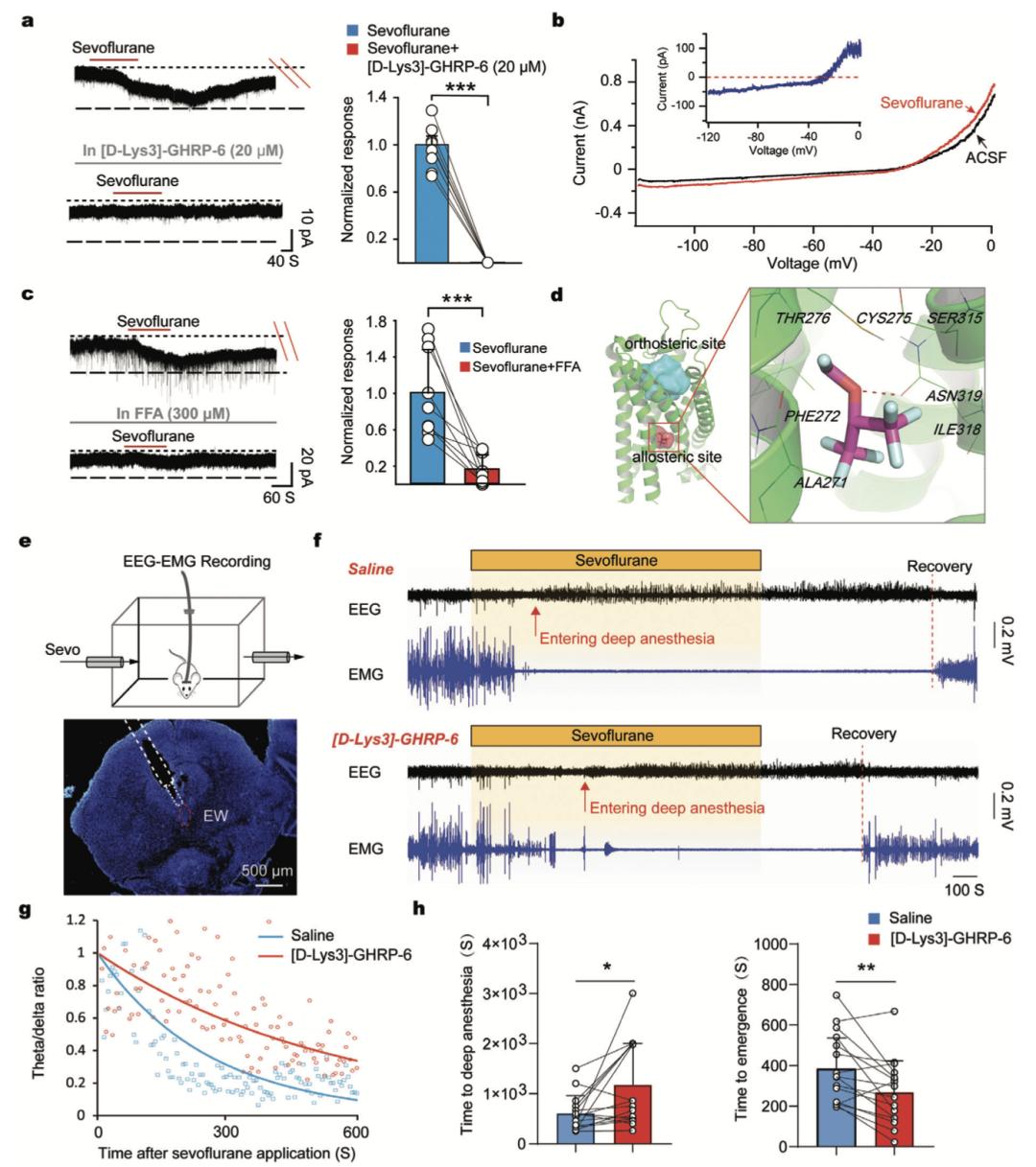
▲ 图 5
总 结
CONCLUSION
在本研究中作者证明了七氟烷通过激活中脑的UCN1+/CART+神经元来诱导和维持麻醉状态。GHSR在七氟烷激活的UCN1+/CART+细胞中富集。消融或抑制七氟烷激活的神经元,或阻断GHSR均可显著减弱七氟烷的麻醉效应。虽然还需要进一步研究七氟烷如何通过蛋白结构生物学激活GHSR,但这些发现为七氟烷麻醉领域提供了包括细胞核和受体在内的新靶点。
原始文献:
Yi T, Wang N, Huang J, Wang Y, Ren S, Hu Y, Xia J, Liao Y, Li X, Luo F, Ouyang Q, Li Y, Zheng Z, Xiao Q, Ren R, Yao Z, Tang X, Wang Y, Chen X, He C, Li H, Hu Z. A Sleep-Specific Midbrain Target for Sevoflurane Anesthesia. Adv Sci (Weinh). 2023 May;10(15):e2300189. doi: 10.1002/advs.202300189. Epub 2023 Mar 24. PMID: 36961096; PMCID: PMC10214273.
编 译:邱 越
排 版:蒋 明
校 审:方 芳
缪长虹
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




