- +1
Cancer Cell:许琛琦/宋宝亮团队全面绘制肿瘤胆固醇代谢图谱,提升CAR-T治疗实体瘤效果
原创 生物世界 生物世界 收录于合集#细胞治疗 70 个 #癌症研究 366 个
撰文丨王聪
编辑丨王多鱼
排版丨水成文
肿瘤微环境中的营养限制是导致癌症免疫逃避的主要因素。虽然免疫细胞对葡萄糖饥饿以及癌症和免疫细胞之间对这种代谢物的竞争已经得到了很好的证实,但其他必需营养素的重要性正在日益得到认识。胆固醇是大多数细胞膜(包括质膜)的重要组成部分,对细胞增殖至关重要。细胞可以通过从头合成或通过低密度脂蛋白受体(LDLR)摄取含胆固醇的脂蛋白来获得胆固醇,这使得有效阻断胆固醇供应变得困难。
细胞的胆固醇代谢主要受两个关键转录因子SREBP2和LXR调控,前者通过调控胆固醇生物合成和摄取基因来上调细胞胆固醇水平,而后者通过调控胆固醇外排和抑制胆固醇摄取基因来下调胆固醇水平。
靶向胆固醇代谢(例如降胆固醇的他汀类药物)治疗癌症的概念已经在临床得到了广泛的测试,但其实际益处并不大,这就需要我们对肿瘤内细胞的胆固醇代谢有一个完整的了解。
2023年5月26日,中科院分子细胞科学卓越创新中心许琛琦团队与武汉大学生科院宋保亮院士团队合作,在 Cancer Cell 期刊发表了题为:Exhaustion-associated cholesterol deficiency dampens the cytotoxic arm of antitumor immunity 的研究论文。
该研究绘制了全面的肿瘤微环境胆固醇图谱,从而揭示了胆固醇缺乏驱动肿瘤微环境中T细胞耗竭和功能障碍的机制。
在此基础上,通过CRISPR-Cas9敲除CAR-T细胞的LXRβ,能够解除胆固醇缺乏导致的T细胞耗竭和功能障碍,从而显著增强CAR-T的实体瘤治疗效果。

胆固醇作为细胞膜(包括质膜)的重要组成部分,对细胞增殖至关重要。癌细胞通常通过激活SREBP2信号来上调胆固醇的生物合成和摄取,以获得足够的增殖基础。因此,抑制胆固醇获取可能是抑制癌症进展的一个有希望的途径。
基于这一理论,已经被广泛使用的降胆固醇药物他汀类药物——抑制胆固醇生物合成中的限速酶HMG-CoA还原酶,已被用于癌症治疗。在临床前研究中,他汀类药物可以抑制癌细胞增殖并诱导细胞死亡。此外,他汀类药物可以促进树突状细胞(DC)的抗原呈递。而在临床试验中,一些小队列研究显示出了令人鼓舞的结果,但他汀类药物在肝癌和胃癌的3期临床研究中没有显示出临床益处,这表明抑制胆固醇生物合成的策略在肿瘤微环境(TME)中可能还具有未知作用。
除了癌细胞外,肿瘤微环境(TME)还富含各种淋巴细胞和骨髓细胞。肿瘤浸润淋巴细胞(TIL)可以识别和杀死癌细胞,而骨髓细胞,最丰富的是肿瘤相关巨噬细胞(TAM)和中性粒细胞,具有促肿瘤和免疫抑制功能。作为增殖细胞,淋巴细胞在抗原刺激下上调胆固醇的生物合成和摄取,以支持克隆扩增,另一方面,非增殖性的骨髓细胞在干扰素刺激下下调胆固醇生物合成,同时上调胆固醇摄取,从而参与炎症程序。
因此,淋巴细胞和骨髓细胞的胆固醇代谢程序本质上是不同的,这反映了需要充分了解肿瘤微环境(TME)中的胆固醇图谱。
浸润性免疫细胞的胆固醇代谢如何在肿瘤微环境(TME)中发生改变仍是一个谜。肿瘤相关巨噬细胞(TAM)被认为是积累脂质,但同时参与活跃的胆固醇外排。肿瘤浸润淋巴细胞(TIL)是否具有异常高或异常低的胆固醇水平以及胆固醇代谢失调如何影响TIL功能也尚不清楚。此外,临床试验中的药物对免疫细胞是否有有益或有害的影响需要仔细评估。解决这些基本问题可以为了解癌症和免疫提供重要信息,并可以为代谢干预提供新的策略。
在这项最新研究中,研究团队使用不同的荧光探针,采用流式细胞术测定肿瘤微环境中不同细胞群的胆固醇水平。同时,他们还通过测量活细胞吸收荧光标记脂蛋白的能力来测定胆固醇的摄取。这种实验策略被应用于从小鼠和人类肝癌和结直肠癌组织中分离的肿瘤细胞。从这些实验中产生的数据被结合起来建立一个全面的肿瘤微环境胆固醇图谱。
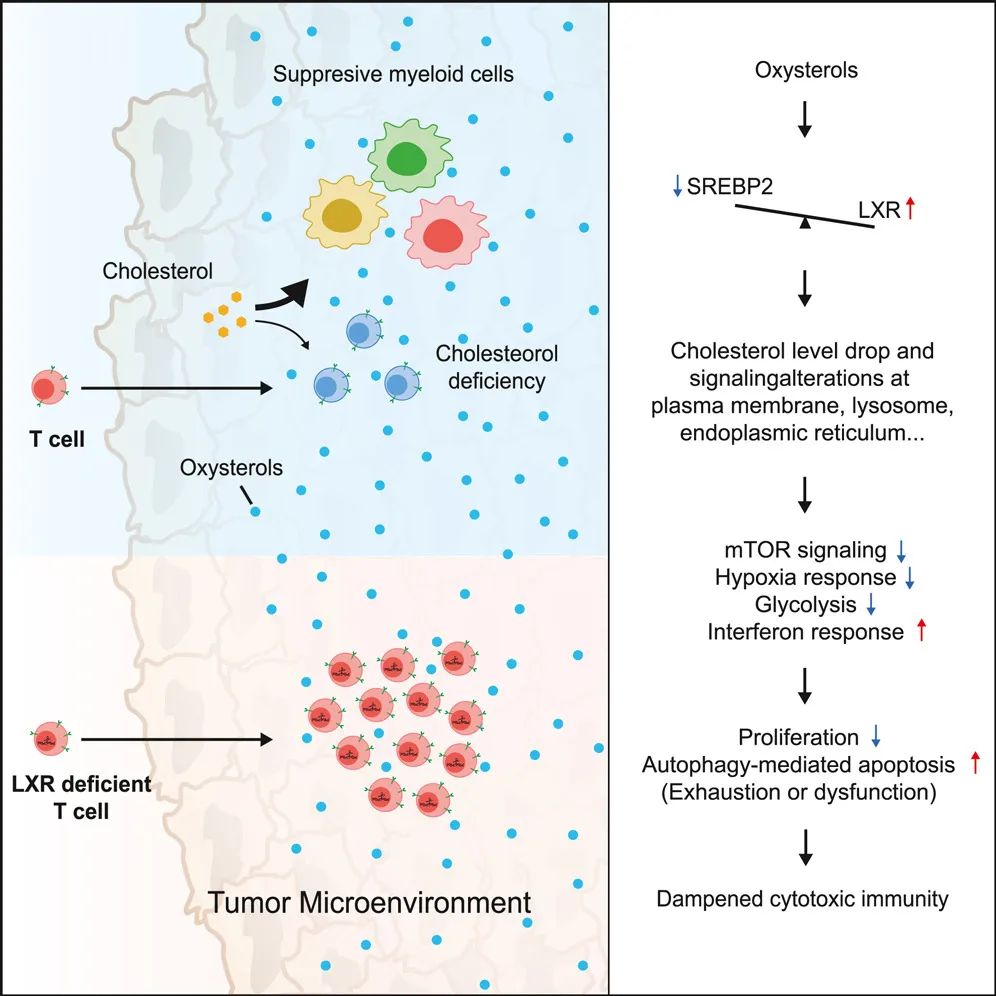
通过对肿瘤微环境胆固醇图谱的表征,研究团队发现了肿瘤浸润淋巴细胞(TIL)中存在胆固醇缺乏,而免疫抑制性骨髓细胞和肿瘤细胞中则具有丰富的胆固醇,并消耗了大部分环境胆固醇。与CD4+辅助细胞相比,胆固醇缺失对CD8+细胞毒性T细胞增殖和存活的影响更为严重。
研究团队进一步确定了肿瘤微环境(TME)中T细胞胆固醇缺乏的关键调节因子,并揭示了胆固醇缺乏驱动T细胞耗竭和功能障碍的机制——低胆固醇水平抑制T细胞增殖并引起自噬介导的细胞凋亡,特别是对细胞毒性T细胞。在肿瘤微环境中,氧甾醇(LXR的天然配体)介导LXR和SREBP2通路的相互改变,导致T细胞胆固醇缺乏,随后导致异常的代谢和信号通路,驱动T细胞耗竭和功能障碍。
更重要的是,该研究还发现,通过CRISPR-Cas9基因编辑技术删除CAR-T细胞中的LXRβ,会导致其对实体瘤的抗肿瘤功能增强,而且这不会导致CAR-T细胞过继转移后不受控制的增殖或长期滞留。
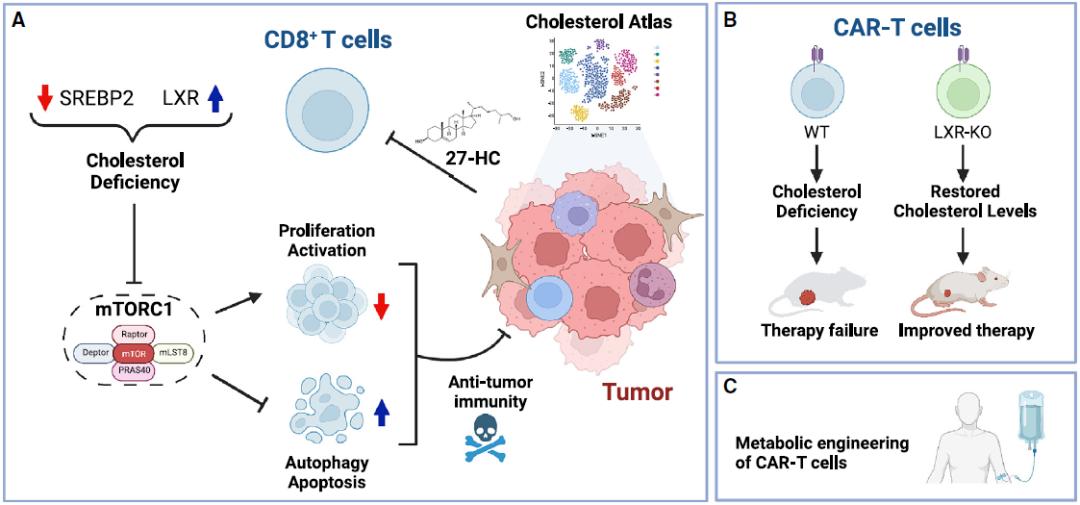
肿瘤微环境胆固醇图谱揭示了CD8+T细胞耗竭的机制,为改进CAR-T细胞治疗提供了新途径
此外,由于T细胞的胆固醇代谢和氧甾醇通常还与其他疾病有关,该研究发现的胆固醇调控机制和胆固醇正常化策略,除了用于提高CAR-T细胞治疗实体瘤的效果外,还可能在其他疾病中潜在应用。
论文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00142-3
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




