- +1
程强/魏妥发表长篇综述:详解mRNA-LNP在癌症治疗中的应用与展望
原创 生物世界 生物世界 收录于合集 #mRNA技术 98个
编译丨王聪
编辑丨王多鱼
排版丨水成文
由于新冠mRNA疫苗的成功,让mRNA技术在各种疾病的预防和治疗中受到了极大关注。为了达到预防或治疗目的,mRNA必须进入靶细胞并表达足够量的蛋白。因此,开发有效的递送系统是必要且至关重要的。
脂质纳米颗粒(LNP)是目前最主要的mRNA递送载体,其显著加速了mRNA在人类中的应用,目前已有几种基于mRNA-LNP的疫苗和疗法已经获批或正在临床试验中。
近日,北京大学未来技术学院程强研究员(星锐医药科学创始人)、中科院动物研究所魏妥研究员(星锐医药科学顾问)作为共同通讯作者,在 Advanced Materials 期刊发表了题为:Lipid Nanoparticle (LNP) Enables mRNA Delivery for Cancer Therapy 的长篇综述论文。
该综述详细介绍了基于mRNA-LNP的癌症治疗,总结了mRNA-LNP制剂的主要开发策略,讨论了具有代表性的癌症治疗方法,并指出了该研究领域目前面临的挑战和可能的未来方向。论文作者表示,希望这些递送相关的信息能够帮助进一步提高mRNA-LNP技术在癌症治疗中的应用。

该综述首先系统地总结了mRNA-LNP的开发策略,包括LNP组分的设计和筛选、内部配比的优化、LNP表面的修饰以及给药途径的选择。然后回顾了使用mRNA-LNP治疗癌症的方法,包括疫苗、抗体、细胞因子、基于CAR的细胞疗法、肿瘤抑制因子和基因组编辑。最后,讨论了该领域当前面临的挑战和未来的发展方向。
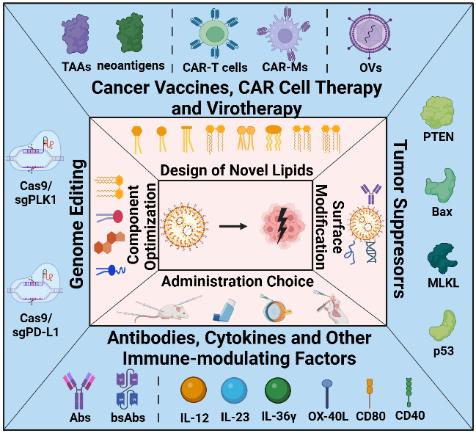
背景介绍
随着新冠mRNA疫苗的获批和广泛应用,mRNA疗法成为生物医学领域的热门话题。自1961年首次发现mRNA以来,mRNA作为一种新的药物类型在之后的时间里得到了广泛探索,直到2020年底被FDA首次批准作为疫苗。
在这60多年时间里,一系列里程碑研究促进了mRNA疗法的临床转化。2005年,Katalin Karikó 和 Drew Weissman 在 Immunity 期刊发表论文,首次报道了对mRNA的核苷进行修饰可以大大减少mRNA引起的免疫反应,还能提高mRNA的稳定性和翻译效率,这样mRNA疫苗就可以以更高的剂量注射,从而产生更多的抗体反应,而发烧、发冷、疼痛等令人讨厌的副作用则更少,这项研究为mRNA疗法的成功成为可能。目前,越来越多的mRNA疫苗开始进入临床阶段,并显示出巨大的成功和治疗潜力。

Drew Weissman(左)和Katalin Karikó(右)
基于mRNA技术的应用有几个优点,包括快速设计和生产感兴趣的蛋白质、瞬时表达,以及易于规模化生产。因此,mRNA在疫苗之外的领域同样显示出巨大潜力,例如用于癌症治疗。
通过理性序列设计,可以很容易控制mRNA生成任何想要的蛋白质,这极大地促进了癌症治疗替代策略的发展。例如表达肿瘤相关抗原(TAA)和用于肿瘤免疫治疗的治疗性抗体,通过编码肿瘤抑制蛋白直接杀伤肿瘤细胞,以及调节肿瘤微环境(TME)或肿瘤细胞以增强治疗效果。此外,最近还有几项研究通过递送CAR mRNA,让体内原位生成的CAR-T细胞治疗成为可能。
然而,由于mRNA具有分子量大、带负电、易降解等理化性质,裸mRNA分子无法有效进入细胞,因此难以达到治疗目的,利用递送载体是克服这一挑战的最重要方法。
理想的递送系统需要有效地封装mRNA并保护其免受降解,还能够选择性地靶向特定细胞类型,促进内体逃逸,并最终将mRNA释放到细胞质中进行蛋白质表达。
到目前为止,各种生物基和化学基载体已被开发用于递送mRNA,其中一些显示出了很好的性能。在生物基载体中,包括外泌体(exosome)、细菌外膜囊泡(OMV)和病毒样颗粒(VLP),在某些应用中显示了潜力。在化学基载体中,聚合物和脂质纳米颗粒由于其高效和多样性而被广泛使用。PACE、PEG-PGBA、PLO、PBAE、CART、ZPP等因合成路线可控和易于规模化而得到了很好发展。
对于脂质基载体,脂质纳米颗粒(LNP)被认为是递送mRNA的首要选择,新冠mRNA疫苗的成功证明了这一点。目前,已有十多种mRNA药物在临床试验中使用LNP作为递送载体,包括传染病和癌症疫苗,以及遗传疾病疗法,其中一些已经取得了很大进步,展示了这类平台的光明前景。
值得注意的是,最近公布的数据显示,Moderna公司开发的呼吸道合胞病毒(RSV)mRNA疫苗的3期临床试验在60岁以上人群中达到主要终点,对预防RSV相关下呼吸道疾病的防护有效性达83.7%。而Moderna与默沙东合作开发的针对黑色素瘤的mRNA疫苗也显示出了积极的结果,这项IIb期临床试验结果显示,在完全切除后高复发风险的III/IV期黑色素瘤患者中,相较于单独使用抗PD-1单抗(Keytruda),mRNA疫苗联合Keytruda能够将患者复发或死亡风险降低44%。FDA也已授予上述两种mRNA-LNP疫苗突破性疗法称号,再次印证了该领域的广阔前景。
为了更好地了解mRNA-LNP技术及其应用,该综述首先回顾了LNP递送系统的发展,然后总结了利用mRNA-LNP平台治疗癌症的策略。
LNP的开发
LNP通常由四种成分组成:可电离阳离子脂质、磷脂、胆固醇和聚乙二醇化脂质。
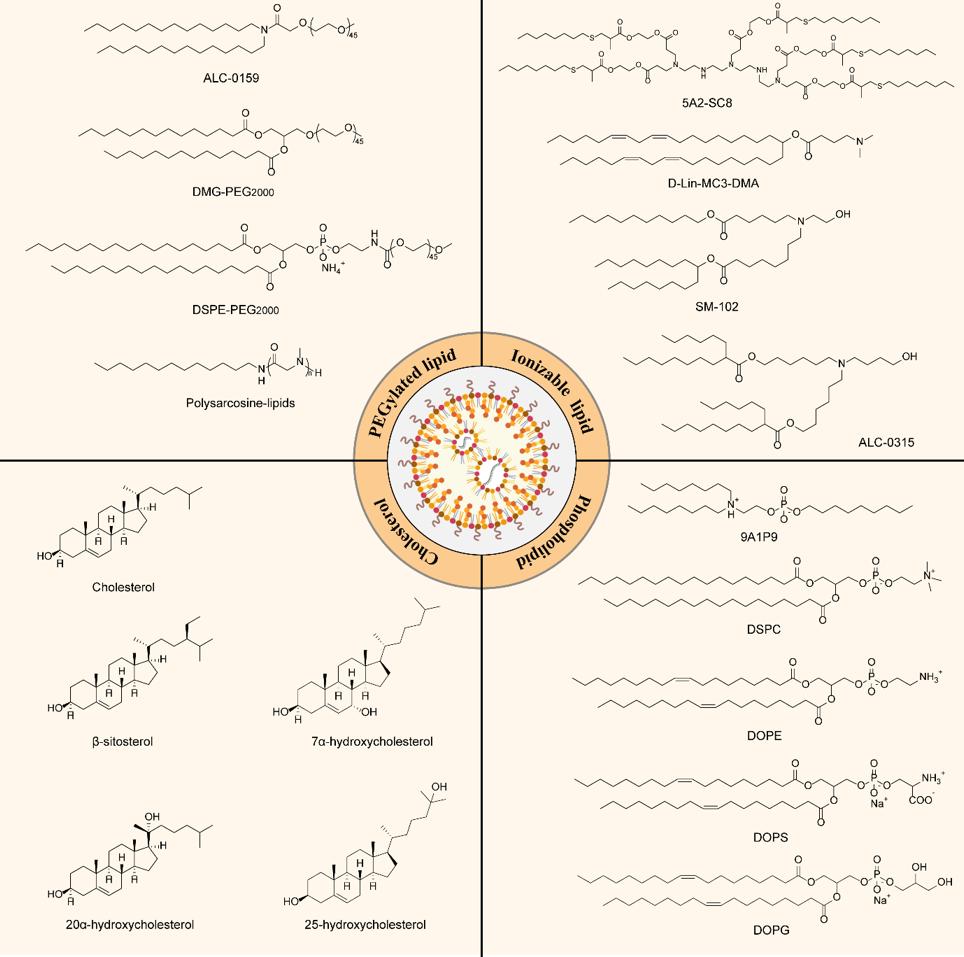
LNP四组分的代表性结构
每个成分对LNP的稳定性、转染效果和安全性都起着至关重要的作用。对于mRNA-LNP的形成,不同的脂质和mRNA通常分别溶解在乙醇和酸性水相中。然后,将乙醇和水相以1:3的体积比与微流控装置混合,完成自组装过程。在形成过程中,可电离阳离子脂质被质子化带正电,然后通过静电相互作用与带负电的mRNA结合,从而将mRNA包裹在LNP内。同时,其他辅助性脂质,包括磷脂、胆固醇和聚乙二醇化脂质,在其上自组装以稳定形成的mRNA-LNP。随后,通过缓冲液置换将mRNA-LNP溶液调节到中性pH,在此期间,可电离脂质变得不带电,使其在生理pH下稳定且毒性较小。
虽然多组分使LNP的开发复杂化,但也赋予了LNP多样性。迄今为止,已经开发了多种LNP类型并得到了验证,引领了mRNA疗法的临床应用。
该综述总结了LNP开发的主要策略,包括:
1、新型脂质分子的设计与筛选;
2、LNP中脂质比例的调节;
3、LNP的表面改性;
4、给药途径的选择。
需要特别指出的是,改变LNP的组分可以实现器官选择性靶向,例如2020年4月,Daniel Siegwart 教授、程强研究员、魏妥研究员等在 Nature Nanobitechnology 期刊发表论文,开发了一种新型器官选择性靶向纳米颗粒平台——SORT。SORT递送系统通过在广泛使用的四组分LNP系统添加阳离子脂质(例如DOTAP)、阴离子脂质(例如18PA)或可电离脂质(例如DODAP)作为第五组分,可使mRNA选择性递送到小鼠的肺、脾或肝脏。
2021年12月,他们在《美国国家科学院院刊》(PNAS)发表论文,解析了SORT系统能够实现器官特异性靶向递送的潜在机制。
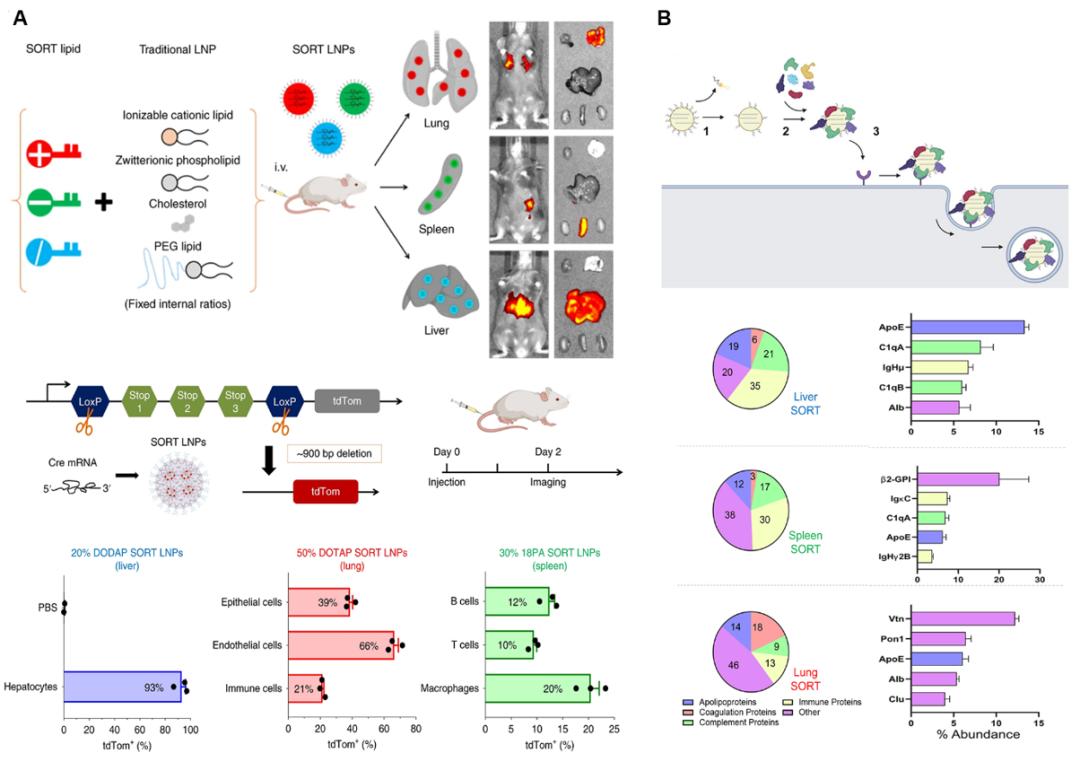
SORT递送系统及其潜在机制
表面改性是赋予LNP功能的有效途径。特别是将抗体、多肽或其他分子(透明质酸、适配体、DNA、甘露糖等)偶联到LNP上可以提高其靶向能力。
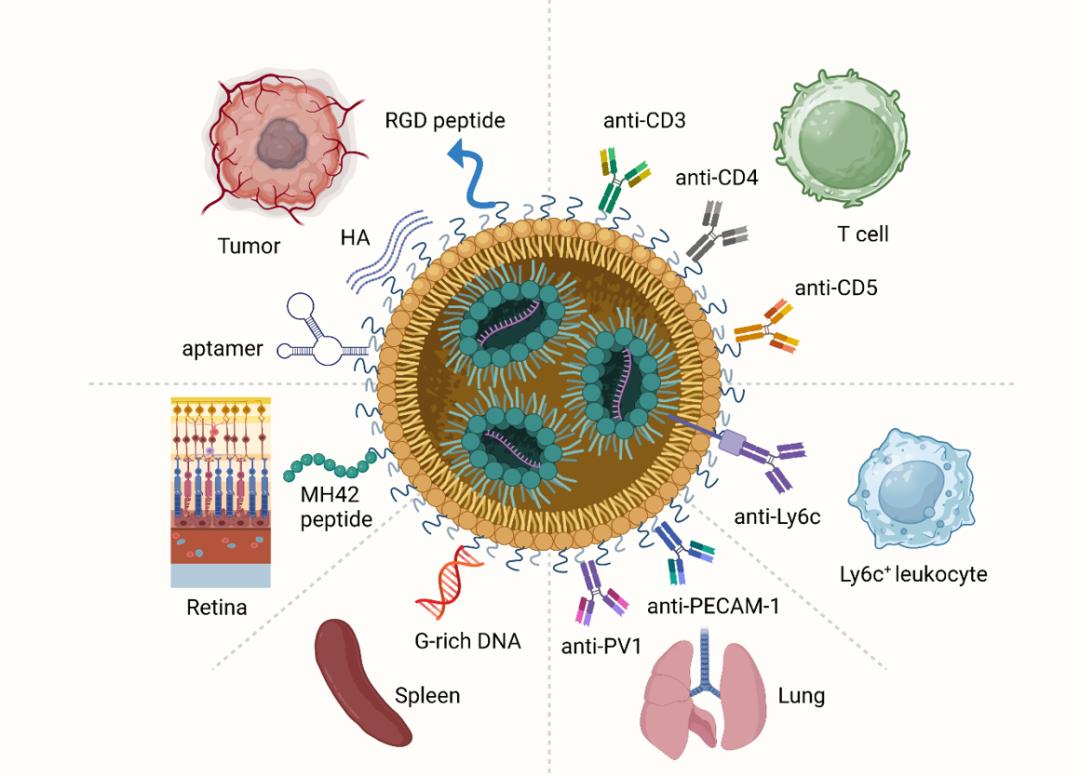
具有代表性的LNP表面修饰策略
除了对LNP本身的修饰外,选择合适的给药途径也可以加速靶向性mRNA-LNP的开发。例如,静脉注射是肝脏靶向治疗的最佳选择,因为mRNA-LNP在血液循环时很容易到达肝细胞。而疫苗通常使用肌内注射,注射后,mRNA-LNP主要分布于注射部位的结缔组织和引流淋巴结,由mRNA编码的抗原被抗原呈递细胞(APC)处理,并呈递到T淋巴细胞进行随后的免疫反应。而一些新型递送装置也有助于优化mRNA-LNP疗法,例如减少注射的疼痛感、提高免疫原性。
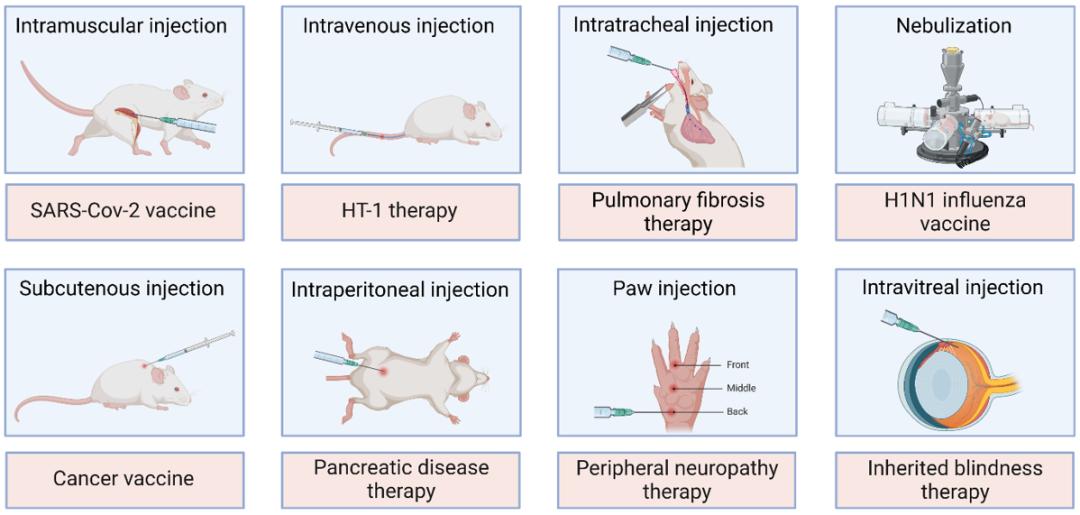
代表性给药方式及其应用
基于mRNA的癌症疗法
癌症免疫疗法
基于mRNA的癌症免疫治疗潜力巨大,因为mRNA可以被设计成表达任何蛋白质来诱导所需的免疫反应。一种常见的策略是递送编码肿瘤抗原的mRNA用于免疫,或者,将mRNA设计为产生细胞因子、免疫检查点抑制剂或其他功能蛋白,以重塑肿瘤微环境(TME)并恢复免疫适应性。此外,mRNA疗法还可以与常规癌症疗法相结合,进一步提高治疗效果。
癌症疫苗
由于作用迅速、成本低,以及可表达任何蛋白质的灵活性,mRNA疫苗受到了极大的关注。mRNA疫苗在对抗传染病方面取得了巨大成功,还可以通过表达肿瘤相关抗原(TAA)在癌症治疗中发挥着至关重要的作用。为了实现这一目标,mRNA应首先被递送到抗原呈递细胞(APC)中,在APC中产生TAA或新抗原。然后将表达的抗原与APC表面的主要组织相容性复合体(MHC)呈递给T淋巴细胞,激活CD4+和CD8+T淋巴细胞,最终杀死肿瘤细胞。
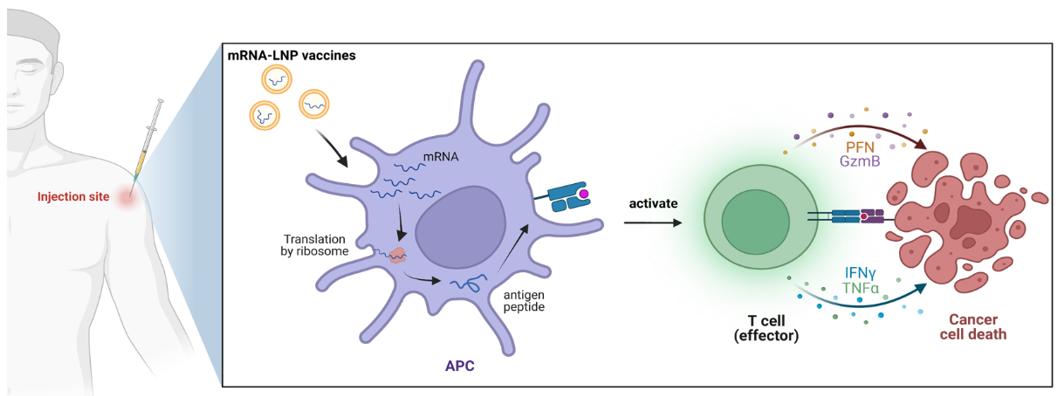
mRNA-LNP癌症疫苗的作用机制
根据这些癌症疫苗的靶向性,可以通过静脉注射、肿瘤内注射、皮内注射或肌肉注射来施用。目前已有多款mRNA-LNP癌症疫苗进入临床试验阶段,其中有少数已进入2期临床阶段。
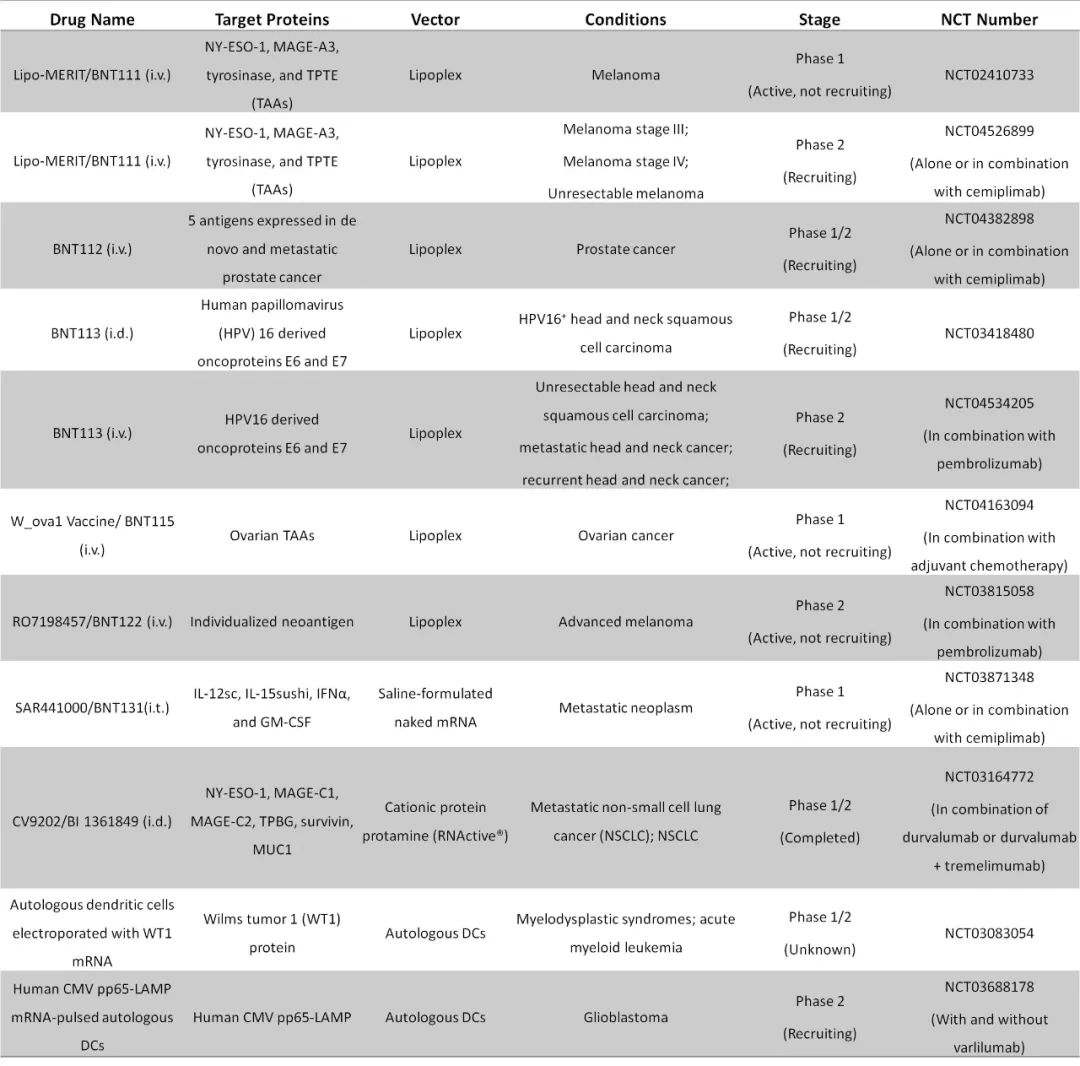
临床试验中具有代表性的mRNA癌症疫苗
治疗性抗体
在过去的几十年里,抗体介导的癌症治疗得到了大力发展并广泛应用于人类。通过序列设计,mRNA也可以编码治疗性抗体。由mRNA产生的抗体被认为比直接基于蛋白质的抗体具有更长的半衰期和更低的成本。截至目前,mRNA已被设计用于表达多种抗体,包括单克隆抗体(mAb)、双特异性抗体(bsAb)及其衍生物。
免疫调节因子
细胞因子(Cytokines)是一类可以调节多种细胞类型和细胞活动的分泌蛋白,特别是在免疫系统中,它们可以作为促炎性因子(例如IL-12、TNFα、IFN-γ)或抗炎性因子(例如IL-4、IL-10、IL-13)。其中一些能够抑制肿瘤的发生和发展而被广泛用于癌症治疗。IL-12是其中一个著名的候选者,它可以激活T淋巴细胞,诱导大量IFN-γ分泌,杀死肿瘤细胞,募集免疫细胞用于癌症治疗。可以通过mRNA-LNP向肝脏靶向递送表达IL-12,从而发挥抗肿瘤作用。
尽管细胞因子在癌症治疗中受到了极大关注,但由于其毒性,包括产生3级和4级不良反应,其全身给药受到阻碍。因此,局部注射是一个可行的选择。此外,mRNA编码的细胞因子可与其他免疫调节因子联合发挥协同治疗作用。
过继细胞疗法
截至目前,FDA已经批准了6种CAR-T细胞疗法,还有成百上千款CAR-T、CAR-NK疗法临床试验正在世界范围内进行,展示了过继细胞疗法的美好未来。与通常使用的将CAR以DNA形式插入到宿主细胞的方法相比,mRNA形式的CAR,具有瞬时表达和无插入突变风险等多种优势,正在变得越来越有吸引力。
体外生产:对于体外生产CAR-T或CAR-NK细胞来说,通常使用电穿孔技术,但电穿孔可能引起严重的细胞毒性,并且难以在体内利用。而LNP可能克服这些限制,目前已有多项研究利用mRNA-LNP平台成功在体外生成CAR-M及CAR-T细胞,并展现了良好的临床前抗肿瘤效果。LNP为基于mRNA的CAR细胞生产提供了一种更简便的方法。
体内生产:与传统的体外CAR细胞工程相比,利用mRNA技术直接在体内生产CAR-T细胞更具吸引力,有望解决当前CAR-T细胞疗法生产工艺复杂、周期长、价格高昂的难题。目前已有多项体内生产CAR细胞的概念验证性研究,相信在不久地将来会有更多有前景的研究陆续出现。
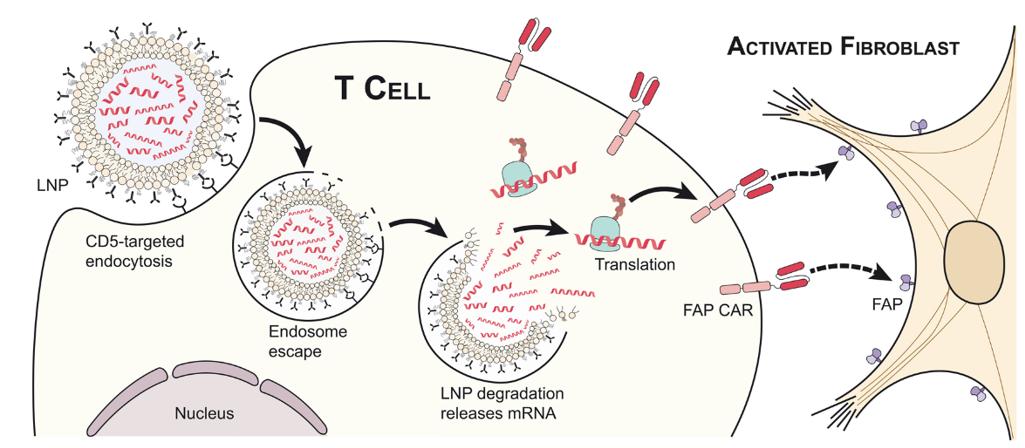
基于mRNA-LNP的体内CAR-T策略
合成溶瘤病毒
溶瘤病毒(OV)能够选择性杀死肿瘤细胞并调节肿瘤微环境以治疗癌症。然而,其重复给药可能会引发抗病毒免疫反应,从而导致治疗效果降低。有研究团队将病毒基因组RNA(vRNA)封装到LNP中,开发出一种合成RNA溶瘤病毒平台。利用这一策略构建的合成溶瘤病毒能够在肿瘤细胞中选择性复制,并导致有效的免疫激活。值得注意的是,这种合成溶瘤病毒在其中和抗体存在的情况下仍然有效,这表明RNA-LNP平台在克服重复给药挑战方面具有巨大潜力。
恢复肿瘤抑制因子
肿瘤抑制因子是指由肿瘤抑制基因表达的蛋白质,具有调节多种与肿瘤发生和抑制相关的信号通路的能力。在许多类型的肿瘤细胞中,肿瘤抑制蛋白如PTEN和p53经常功能失调。通过mRNA恢复这些基因及其表达的蛋白的功能,可以调节细胞的抗肿瘤过程并诱导细胞凋亡,这为癌症治疗提供了一种有希望的策略。
基因组编辑疗法
基因组编辑技术可以通过删除、插入或改变宿主基因组中的特定DNA序列,以CRISPR为代表的基因组编辑技术的出现,彻底改变了当前的生物医学研究,并推动了该领域许多令人兴奋的进展。
特别是,CRISPR-Cas9系统已被广泛用于治疗罕见遗传性疾病,例如β-地中海贫血、镰状细胞病、转甲状腺素淀粉样变性、遗传性血管性水肿和血友病等。而且,它也是治疗癌症的有力工具。随着递送系统的快速和显著发展,CRISPR-Cas9系统可以以RNA、DNA或RNP的形式被递送到细胞中。与DNA和RNP形式相比,Cas9 mRNA和sgRNA的共递送方式具有更高的有效性和安全性,通常被认为是一种更有吸引力的方式。
Cas9 mRNA一旦进入靶细胞中,就能在细胞质中产生Cas9核酸酶,然后与特定的sgRNA形成Cas9-sgRNA复合物,从而实现高效的基因组编辑。除了CRISPR-Cas9系统外,其他有前景的基因组编辑工具,例如碱基编辑(Base Edting)和先导编辑(Prime Editing)也可以通过RNA-LNP的形式递送,同样具有巨大的癌症治疗潜力。
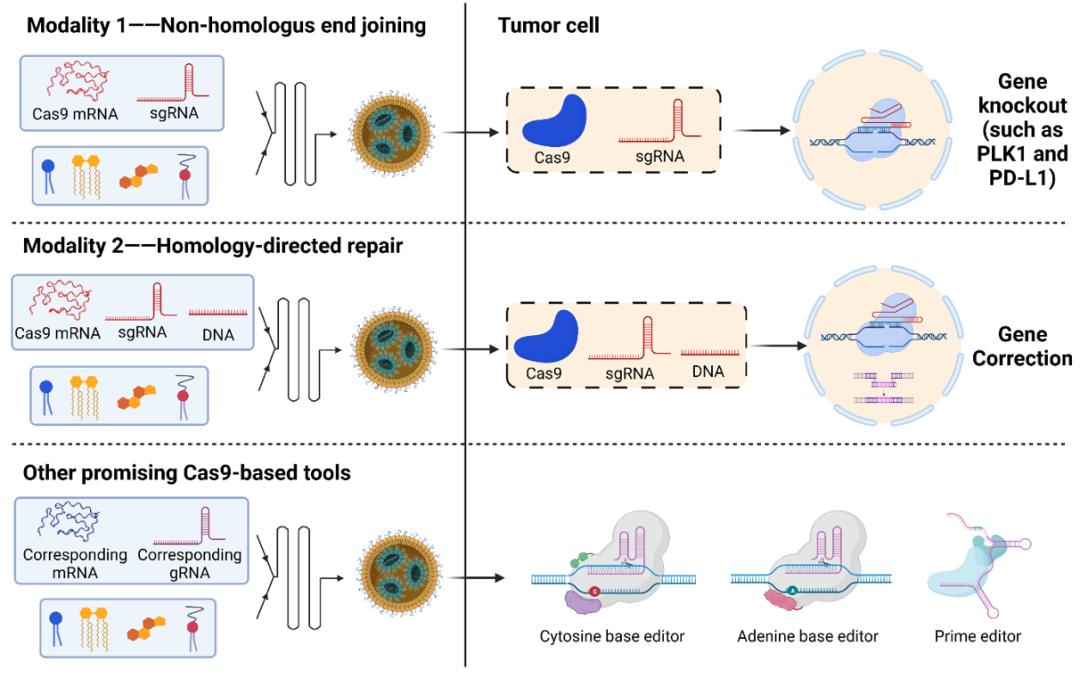
基于mRNA LNP的基因组编辑用于癌症治疗
结论与展望
在2019年之前,人们普遍认为至少需要五年的时间才能看到mRNA疗法应用于人类。而新冠大流行加速了mRNA技术的发展,将这项了不起的技术提前带给了人类。
2020年底,BNT162b2(由BioNTech和辉瑞开发)和mRNA-1273(由Moderna开发)获得紧急使用授权用于抗击COVID-19,这也标志着2020年成为mRNA技术发展史上具有里程碑意义的一年。从那时起,基于mRNA的疗法成为临床转化的超级热点。仅在2021这一年,就有超过20亿美元的资金投入了mRNA技术转化。在这一年,来自中国的艾博生物(Abogen)完成了7亿美元的C轮融资,这也是有史以来最大规模的IPO前单笔融资之一。
mRNA疫苗已经在抗击COVID-19方面取得了成功,但该平台在开发预防性和治疗性疫苗方面同样具有巨大潜力。最近,Nature 杂志将mRNA疫苗列为2023年值得关注的科学事件之一,这表明该平台得到了高度和持续认可。从长期来看,这一领域也是乐观的,预计由于对新冠mRNA疫苗的需求减少,mRNA疫苗市场可能会在短期内下降,但将从2028年开始增长,到2035年达到230亿美元规模。
就技术本身而言,mRNA疗法的成功高度依赖于其递送载体,而LNP是最好的递送载体选择之一。在这篇综述中,程强、魏妥等总结了LNP的开发策略,包括设计每个脂质成分,平衡内部脂质比例,修饰LNP表面,以及优化给药途径。如上所述,大量研究表明mRNA可以有效地递送到肝脏、肺、脾和大脑。随着进一步发展,还将有更多的器官和组织能够被靶向递送。更进一步,未来应该更多关注于靶向递送到特定组织中的某些细胞类型。在靶向给药的同时,消除LNP的免疫原性和毒性也不容忽视。结合可生物降解材料,优化剂量,并开发新的脂质替代品有望解决这些问题。
该综述还重点回顾基于mRNA-LNP的疗法在癌症治疗中的进展,系统回顾和讨论了癌症免疫治疗、恢复肿瘤抑制基因、基因组编辑疗法等具有代表性的癌症治疗方法,并总结了它们的最新临床状态。
值得注意的是,最近开发的体内CAR-T细胞疗法为癌症治疗开辟了新途径。传统的CAR-T生产是一个相当复杂且耗时的过程,包括自体T细胞的提取、CAR基因的转染、扩增和激活、回输到患者体内。而直接在体内生产CAR-T细胞可以解决上述问题,为晚期癌症治疗提供了一条有希望的新途径。当然,这一方法仍有许多问题或限制需要解决。瞬时mRNA生成的CAR-T细胞是否能够支持长期抗肿瘤作用?是否能够精确地将CAR mRNA递送到T细胞而不是其他细胞以避免脱靶效应?
随着细胞类型靶向LNP和mRNA长效表达技术(例如环状RNA)的发展,这些问题可能得到部分回答。论文作者对这一方向持乐观态度,并期待很快看到更多进展,论文作者还表示,希望这篇综述提供的信息可以帮助设计更好的LNP载体,并制定适当的策略来改进基于mRNA的癌症治疗。
论文链接:
1. https://doi.org/10.1002/adma.202303261
2. https://www.nature.com/articles/s41565-020-0669-6
3. https://www.pnas.org/content/118/52/e2109256118
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




