- +1
免疫检查点抑制剂相关性肝损伤
原创 张婷 哆啦问药 收录于合集#药物不良反应 9 个 #肿瘤 15 个
这是哆啦问药的第227期推送
*本文为「哆啦问药」原创内容
▼
关于免疫检查点抑制剂,我们有多篇推文进行过介绍,包括作用机制、药理学特性、药效学特性等等内容,感兴趣的可以查看。
本期,我们给大家介绍“免疫检查点抑制剂(ICIs)相关性肝损伤”。
一、ICIs抗肿瘤作用机制及类型
1. 抗肿瘤作用机制
免疫检查点分子(Immune Checkpoint Molecules):是指位于效应T淋巴细胞上的一些激活性和抑制性受体调节开关,激活可以使得T淋巴细胞处于效应状态,抑制可以使得T淋巴细胞处于沉默状态。是免疫细胞表面参与免疫调节的分子。
T细胞激活的双信号:第一信号来自TCR识别MHC/抗原肽复合物,传递抗原特异 性刺激信号;第二信号来自APC的共刺激分子提供,为非特 异性协同刺激信号。共刺激分子包括:CD28、CTLA-4、CD80、CD86, 4-1BB和4-1BBL,CD40和CD40L,PD-1和 PD-L1等。
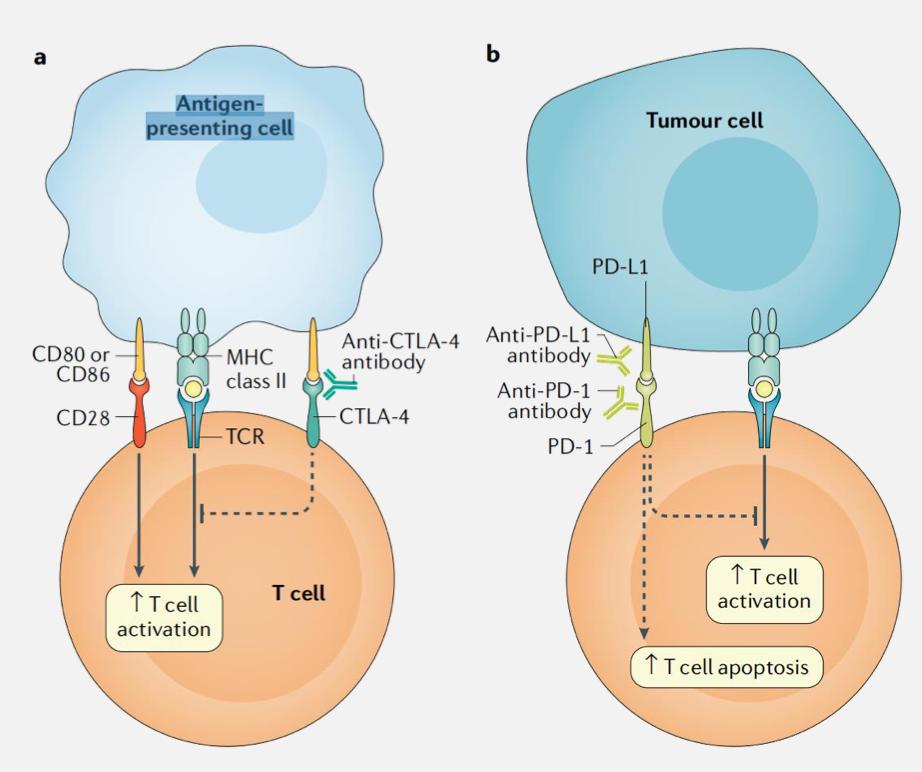
图片来源:Nat Rev Dis Primers. 2020;6(1):38.
2. 上市药物
CTLA-4和PD-1/PD-L1 是目前研究最广泛的抑制性检查点途径,在临床上取得了成功,靶向 CTLA-4 的伊匹木单抗于 2011年最早上市,是全球第一个免疫检查点抑制剂,随后在 2014 年 FDA 批准 PD-1 抑制剂纳武利尤单抗用于治疗晚期黑色素瘤,免疫治疗大门从此打开,免疫检查点抑制剂接连上市。
二、ICIs相关不良反应
免疫相关不良反应(irAEs)是由于免疫检查点抑制剂导致过度的免疫激活,对正常组织细胞产生破坏而带来相应的症状、体征、实验室检查异常结果。正常组织中免疫细胞活化,失去对自身抗原的免疫耐受,可出现类似自身免疫性疾病的症状。常见的 irAEs包括甲状腺功能低下、免疫性肺炎、免疫性肝损伤(IMH)、免疫性心肌损伤等。
所有级别irAEs的发生率为65%~76%,3级以上irAEs发生率为3%~5%,尽管大部分毒性为轻度且可逆,但仍存在0.3%~1.3%的严重致死性毒性,是造成肿瘤患者非预期死亡的重要原因。
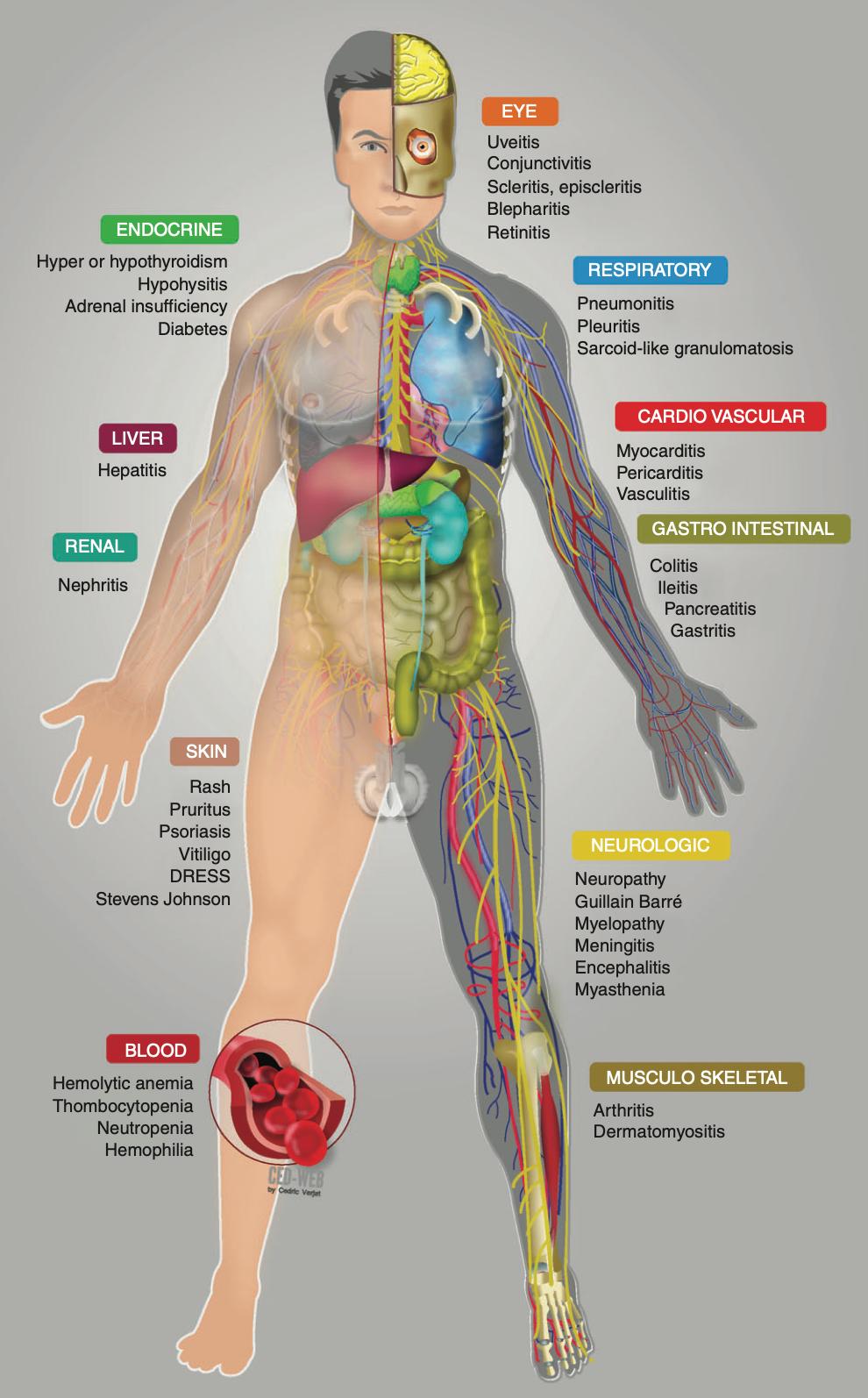
图片来源:Ann Oncol. 2016;27(4):559-574
三、ICIs相关肝脏毒性(IMH)
1. 临床表现
ICIs相关肝脏毒性(ICI induced immune mediated hepatitis , IMH)主要表现为谷丙转氨酶(ALT )和/或谷草转氨酶(AST)升高,伴或不伴有胆红素升高。一般无特征性的临床表现,有时伴有发热、疲乏、食欲下降、早饱等非特异性症状,胆红素升高时可出现皮肤巩膜黄染、茶色尿等。症状也可来自同时发生的其他脏器毒性,如结肠炎、甲状腺炎或肺炎等。
目前依据不良事件通用术语标准(CTCAE)对肝脏免疫相关不良事件的严重程度分为5级。
图片来源:《CSCO 免疫检查点抑制剂相关的毒性管理指南》2021
2. 发生率
IMH可发生于首次使用后任意时间,最常出现在首次用药后8~12周。接受CTLA-4抑制剂(联合或不联合PD-1抑制剂)的患者出现肝毒性的时间相对更早。IMH的发生率差异很大,从0.7%~16%不等,取决于ICIs的种类、剂量以及是否使用联合治疗。
3. 发生机制
ICIs相关的肝毒性为免疫介导,但确切的机制尚不清楚。免疫检查点分子在肿瘤组织中存在的同时,也在T淋巴细胞中表达,所以靶向这些分子的单克隆抗体可能通过对T淋巴细胞的直接作用引起自身免疫反应,从而导致损伤的发生。此外,CTLA-4和PD-1与自身的免疫耐受有关,对某些易感的人群而言,可能导致自身的免疫耐受打破,从而引发包括肝脏在内的不同器官的自身免疫性损伤。
4. 高危因素
5. 诊断
与其他药物导致的肝损伤诊断一样,其诊断策略仍为排他性。一方面,需结合患者的病史、临床表现、生化指标、影像学检查,必要时进行肝脏组织学检查,以排除引起肝损伤的其他潜在病因如病毒性肝炎、非酒精性脂肪性肝病、酒精性肝病、自身免疫性肝炎等;另一方面,应仔细了解、询问患者其他的合并用药,以排除其他药物引起肝损伤的可能。
治疗前肝脏生物化学指标检查正常的患者,治疗中出现生物化学指标异常;或与治疗前的基线相比,肝脏生物化学指标显著异常,临床上提示有明确的肝损伤或肝损伤进展证据时,均应考虑ICIs导致肝损伤的可能性。
6. 组织学特征
肝活检可以明确IMH的诊断,并评估组织损伤的严重程度。
由于发病机制的复杂性,IMH的肝组织学表现是异质性的,包括小叶性肝炎、脂肪变性以及胆管损伤等。但组织学除了在诊断和评估肝损伤的严重程度外,也可区分PD-1/PD-L1抑制剂和CTLA-4抑制剂的毒性。
CTLA-4相关的肉芽肿性肝炎,由上皮样细胞组成,中央可出现有巨噬细胞环绕的脂质空泡,外围为纤维蛋白环,最外层为组织细胞,炎性细胞主要为CD8+的T细胞(左图B)。另一种是PD-1/PD-L1模式,具有较高异质性,表现为程度不等的非肉芽肿性小叶内或汇管区肝炎,肝细胞点灶状坏死,少见桥接坏死。炎性细胞由CD4+及CD8+T细胞共同构成(右图F)。
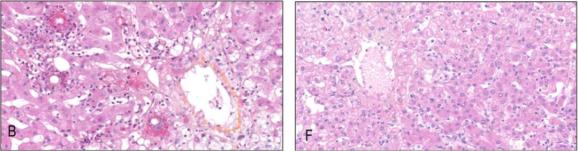
图片来源:J Hepatol. 2018;68(6):1181-1190
四、IMH的治疗
1. 治疗
IMH可通过暂停免疫治疗或加用皮质类固醇来治疗。尽管指南之间存在细微差异,但它们都采取逐渐抑制免疫的方法,包括暂停或永久停止ICIs,然后进行皮质类固醇治疗和进一步的免疫抑制等,是否重新应用ICIs取决于最初的严重程度和对后续治疗的反应。
指南建议2级IMH患者口服泼尼松,剂量为0.5~1mg/kg,3/4级患者静脉注射甲基泼尼松龙,剂量为1~2mg/kg。如患者2-3天内对皮质类固醇激素无反应,应加用麦考酚酯,如效果仍不佳,可换用低剂量他克莫司(5~7ng/dl)。新型的治疗药物 包括布地奈德、抗胸腺球蛋白(ATG)和血浆置换等,可在有经验的中心谨慎使用。英夫利西单抗因其自身潜在的肝脏毒性,不建议考虑使用在IMH的患者中。

图片来源:csco免疫检查点抑制剂相关的毒性管理指南 2021
2. 免疫抑制治疗

3. 经验治疗
4. 免疫治疗再挑战
在与ICI再挑战相关的6123例irAEs中,452例(7.4%)是信息性再挑战(informative rechallenge,即有再次发生irAE状态信息的病例,比如同一反应再次出现或 未再次出现);其中,130例(28.8%;95%CI,24.8-33.1)是初始irAEs的再发生。
1. 再次使用PD-1/PD-L1抑制剂单药治疗后irAEs再发率为28.6%(n=105,95%CI,24.0%-33.2%);
2.抗CTLA-4单药治疗后再发率为47.4%(n=7,95%CI,24.8%-69.9%);
3. 联合治疗后再发率为43.5%(n=18,95%CI,29.1%-57.8%)。
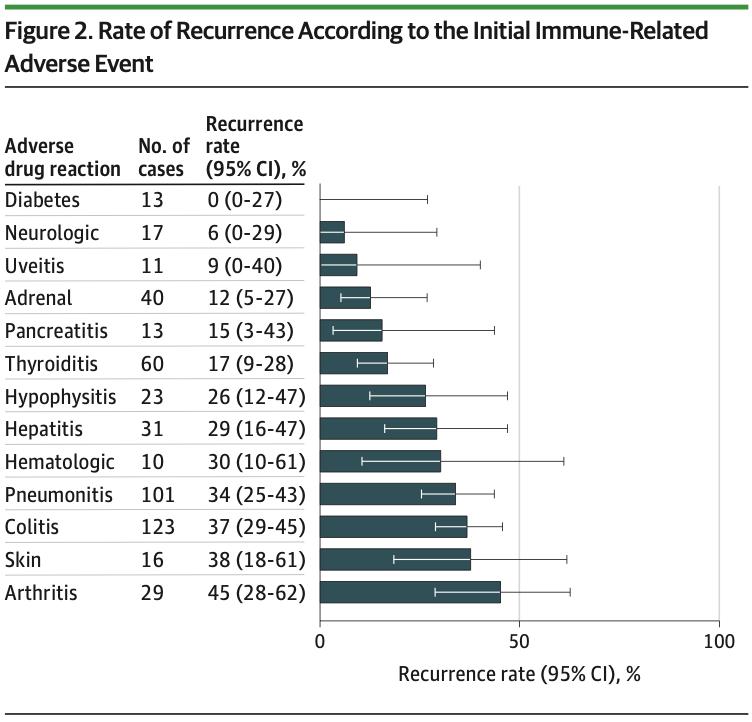
图片来源:JAMA Oncol. 2020;6(6):865-871
在多因素分析中,在调整了年龄、性别、ICI方案、随访状态和irAEs类型后,下列 变量与较高的irAEs再发率相关:抗CTLA-4方案、年龄、结肠炎、肝炎、和肺炎。
除了初始肺炎外,再发性和初始irAEs发作 的中位时间是相当的。肺炎的再发性irAEs发病时间可能晚于未再发irAEs,分别是88(58-178)VS. 44(20-90)天。
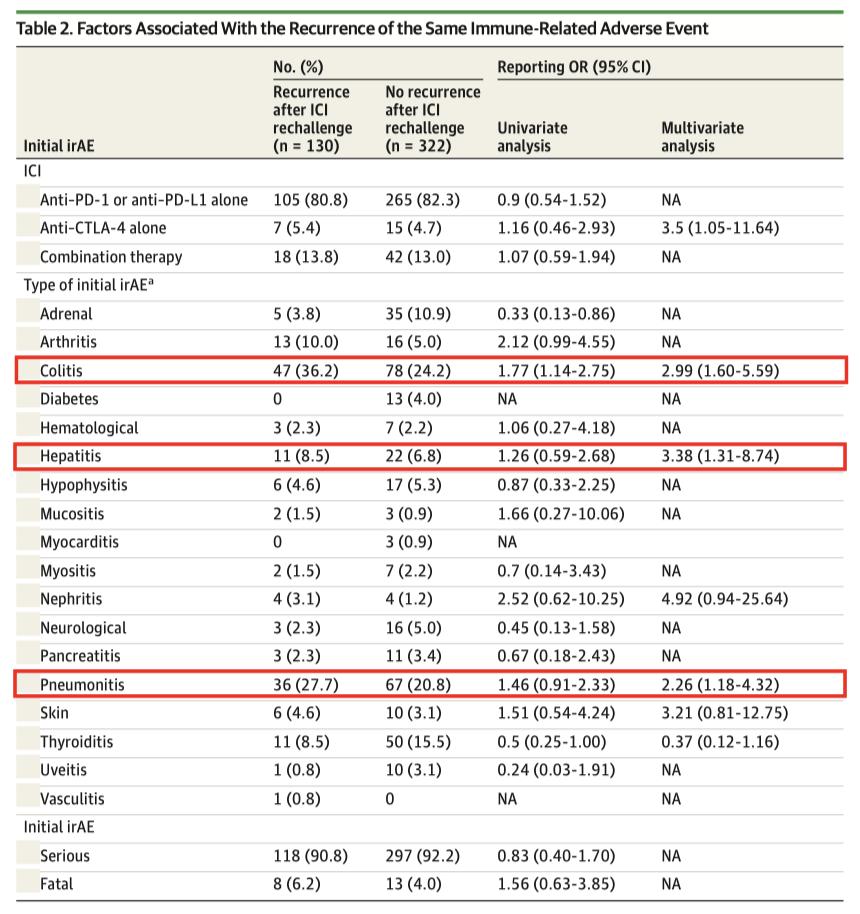
图片来源:JAMA Oncol. 2020;6(6):865-871
以上便是今天的全部内容。如果觉得这篇文章写得不错的话,欢迎关注、点赞、点在看、分享至朋友圈,更多临床用药问题,我们下期再会。
-----------------下期见-----------------
编辑 | 陈默
指导老师 | 吴薇
封面图片来源于https://pixabay.com,该图片由Donate PayPal Me在Pixabay上发布
点击阅读原文,可查看你还可能感兴趣的内容:版权申明
本文为作者原创,码字不易,谢绝未经授权的转载,本文仅作学术交流,如需转载,请后台联系获取授权
原标题:《免疫检查点抑制剂相关性肝损伤》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




