- +1
中科院动物所王红梅团队揭秘食蟹猴全妊娠周期胎盘细胞谱系分化和动态变化特征
原创 Cell Press CellPress细胞科学

生命科学
Life science
2023年4月12日,中国科学院动物研究所王红梅团队在Cell Press细胞出版社期刊Developmental Cell上发表了题为“Identifying a dynamic transcriptomic landscape of the cynomolgus macaque placenta during pregnancy at single-cell resolution”的研究成果。该研究以食蟹猴为模型,利用单细胞转录组测序和深度分析,结合胎盘原代细胞培养、Co-IP、细胞侵润迁移模型和染色鉴定等方法,系统描绘了食蟹猴全妊娠周期胎盘细胞谱系分化和动态变化特征,揭示了胚外中胚层细胞向胎盘绒毛内细胞的分化轨迹,阐述了人和食蟹猴母-胎界面细胞的种间差异。该研究为揭示灵长类胎盘形成机制提供了宝贵的数据资源,也为了解人类胎盘异常发育的相关疾病及其病理机理提供重要的线索与依据。安徽医科大学校聘教授蒋祥祥、中国科学院动物研究所副研究员翟晶磊、北京理工大学副教授肖振宇、中国科学院动物研究所博士研究生吴绪伦和浙江大学教授张丹为该论文共同第一作者。
胎盘是妊娠过程中连接母体和胎儿的临时器官,具有为胎儿提供营养物质,保护胎儿免受母体排斥等功能。胎盘发育和功能异常可导致多种妊娠并发症,如子痫前期、胎儿宫内生长受限等1。
胎盘绒毛是胎盘的基本功能单元,由外层的滋养层上皮和内部的绒毛内细胞(placental villous core cells)构成。滋养层上皮由位于内层的细胞滋养层细胞(cytotrophoblast cells,CTBs)和外层的合体滋养层(syncytiotrophoblast ,STB)构成2。在绒毛远端,CTBs增殖形成滋养层柱,并分化为绒毛外滋养层细胞(extravillous trophoblast cells,EVTs)。EVTs可分为间质EVTs和血管EVTs。间质EVTs侵入母体蜕膜,与蜕膜细胞相互作用,调节母-胎界面免疫平衡。血管EVTs沿子宫螺旋动脉内侧改建血管内皮细胞,使螺旋动脉被重塑为低阻力、高容量的子宫胎盘动脉,从而保障胎盘血液灌注充足。已有研究利用single-cell RNA sequencing(scRNA-seq)确定了CTBs、STB和EVTs的亚群及它们在某特定妊娠阶段或病理条件下的分子特征。然而,滋养层细胞在全妊娠周期的动态变化特征仍未被全面解析。
胎盘绒毛内细胞的发育对胎盘形态发生和功能至关重要3。胎盘绒毛内细胞主要包括胎盘间质细胞(placental mesenchymal cells, pMes)、内皮细胞(placental endothelial cells, pECs)、胎盘定植型巨噬细胞霍夫鲍尔细胞(Hofbauer cells, HBCs)和红细胞(placental erythrocytes, pEry)等。pMes与pECs共同维持胎盘血管结构,并共同参与造血微环境的构建。HBCs可通过分泌多种细胞因子促进胎盘血管生成。长期以来,领域内普遍认为胎盘绒毛内细胞起源于胚外中胚层(extraembryonic mesoderm, ExE.Meso),但基本上是根据早期植入胚胎的HE切片染色等结果间接证明4,尚需更加直接和可信度更高的实验证据,且ExE.Meso分化成pMes、pECs、HBCs和pEry等细胞的具体细节尚未被阐明。
为了解答以上全妊娠周期胎盘细胞谱系分化和功能变化的关键科学问题,需要获取灵长类全妊娠周期胎盘和早期胚胎组织。但人的相关组织极难获得。非人灵长类食蟹猴在进化上与人类相近,其胚胎和胎盘的发育过程和结构特征与人类相似,是研究上述问题的理想模型之一。因此,研究者收集了覆盖食蟹猴全妊娠周期的10个阶段(E20、E23、E26、E29、E35、E45、E62、E84、E90和E140)的胎盘和子宫蜕膜样品,以及卡耐基分期(Carnegie stage, CS)8-11阶段的6个胚胎样品(E20、E23、E26和E29)5,利用10x Genomics单细胞转录组测序技术获得了217404个建库成功的单细胞,构建了食蟹猴全妊娠周期胎盘和子宫蜕膜以及早期胚胎的单细胞转录组图谱。基于所检测到的单细胞的基因多态性、组织来源、差异表达基因(differentially expressed genes, DEGs)等特性,研究者将所有细胞分为20个主群(图1)和91个亚群。根据DEGs分析,发现胎盘滋养层细胞可被分为早期(E20-E35)、中期(E45)和晚期(E62-E140)的亚群,提示灵长类胎盘或具有早、中、晚三个功能阶段。基于数据库的构建,研究者进一步通过深度数据挖掘和实验验证,尝试回答胎盘发育的关键科学问题。
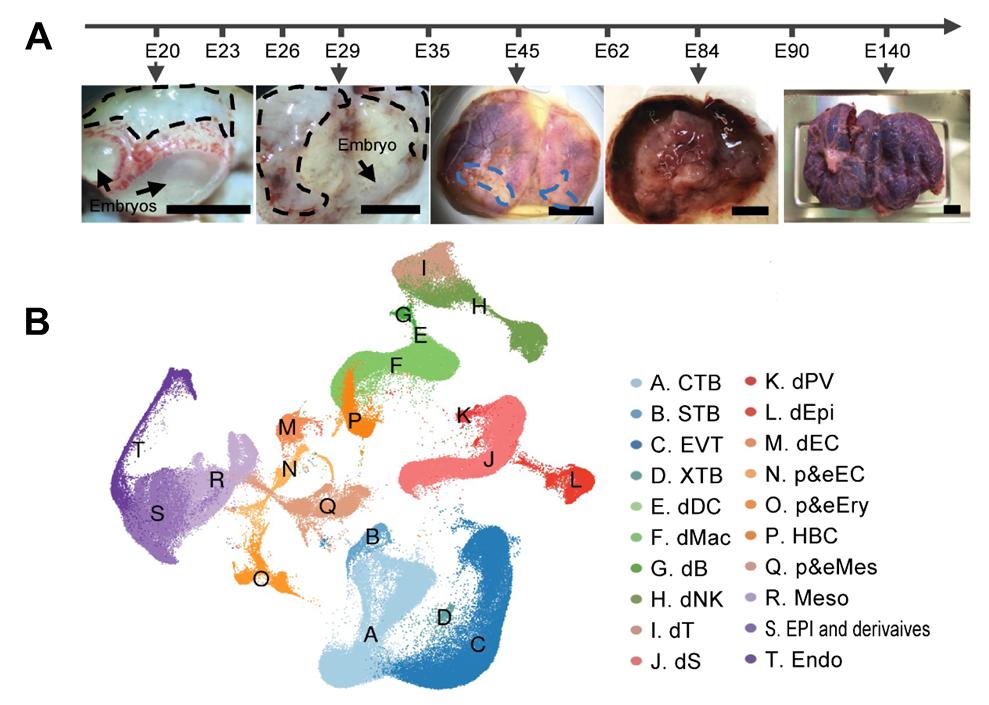
图1. 不同发育阶段获得的代表性食蟹猴胚胎和胎盘明场图像(A)与20种主要细胞类群(B)
为了研究全妊娠周期滋养层细胞的分子特征和功能变化,研究者将61791个滋养层细胞分为13个亚型,包括早、中、晚期的固有CTBs(intrinsic CTBs,iCTBs),早、中、晚期的具有融合能力的CTBs(fusion-competent CTBs,fcCTBs),早、中、晚期的EVTs,两种平滑绒毛滋养层细胞(smooth chorion trophoblast-like cells, XTBs)和STB。不同阶段CTBs具有不同特性,例如,DEGs分析和荧光染色鉴定提示早期iCTBs具有较强增殖能力,增殖细胞的数量随着妊娠过程逐渐减少。融合基因表达分析和原代细胞融合实验提示fcCTBs融合能力伴随妊娠进程逐渐增强。DEGs分析和荧光染色实验提示晚期CTBs特异高表达泛素化酶,这可能与防止妊娠晚期绒毛膜异常蛋白代谢相关。GO分析和划痕实验等发现,早期EVTs具有更强的侵袭能力,而晚期EVTs的侵袭能力降低。拟时间轨迹和RNA速率分析表明,早期iCTBs可分化为中、晚期iCTBs和早期EVTs,但中、晚期CTBs失去了分化为EVTs的潜力(图2)。
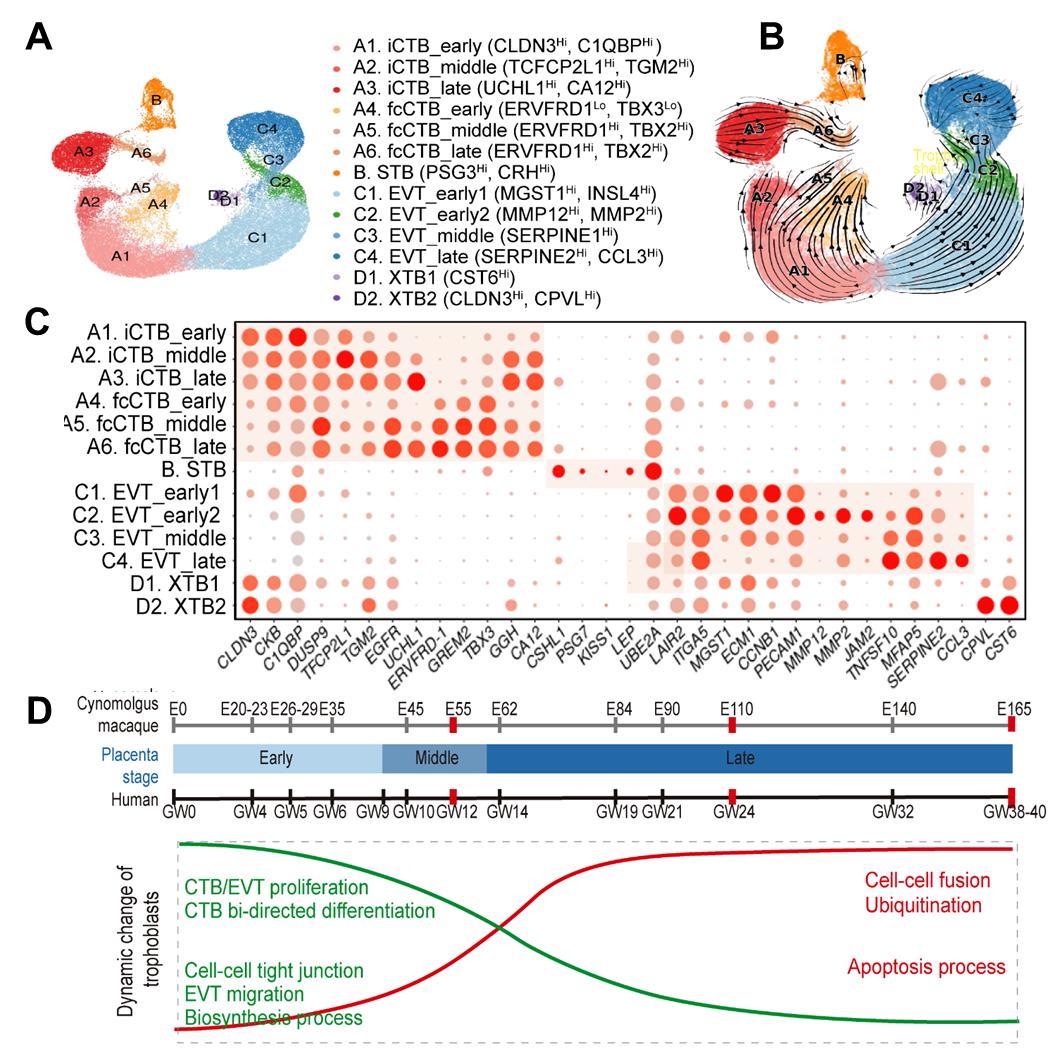
图2. 13种滋养层细胞亚型的UMAP图(A);13种细胞亚型的RNA速率分析(B);各滋养层亚型特异性标记基因表达(C);滋养层细胞在不同阶段的动态功能变化(D)
食蟹猴子宫蜕膜细胞包括蜕膜基质细胞(decidual stromal cells, dSs)、血管周细胞(decidual perivascular cells, dPVs)、NK细胞(decidual NK cells, dNKs)、T细胞(decidual T cells, dTs)和巨噬细胞(decidual macrophages, dMac)等。与滋养层细胞相比,它们在整个妊娠周期的细胞组分和转录组特性相对稳定。CellphoneDB分析和Co-IP实验提示,EVTs和蜕膜细胞之间潜在的受体-配体耦联伴随着妊娠进程呈动态变化,这些变化与母-胎界面的细胞增殖、迁移、血管生成和免疫耐受等功能密切相关。
对于胎盘绒毛内细胞,研究者发现pECs伴随妊娠周期可分为早期和中晚期的功能亚群。CellphoneDB分析提示CTBs与绒毛内细胞之间具有丰富的受体-配体耦联,这些特征提示CTBs或具有募集绒毛内细胞,促进血管生成和调节pECs的造血潜能等作用。在绒毛内细胞中,HBCs、pMes和pECs之间也具有丰富的受体-配体耦联,这些特征提示HBCs或为pMes和pECs提供分化微环境。
ExE.Meso细胞是绒毛内细胞的主要来源,但其如何分化为功能性的绒毛内细胞仍未被阐释清楚。为此,研究者将来自CS8-11(E20-29)的胚胎、绒毛和卵黄囊的59032个细胞进行整合分析。DEGs分析、拟时间分析和荧光染色提示,ExE.Meso包括ExE.Meso1和ExE.Meso2两个亚群。ExE.Meso1主要分布在羊膜背侧的尾部与尿囊远端,可分化为pMes;而ExE.Meso2分散在卵黄囊脏侧和尿囊远端,可分化为胎盘的血细胞谱系,包括HBCs、pECs和pEry。
为了详细描述ExE.Meso2向胎盘血细胞谱系的分化轨迹,研究者将胎盘、胚胎和卵黄囊的血细胞谱系进行深度分析,并定义出成血管原细胞(hemangioblasts, Haems)、胚胎和卵黄囊内皮细胞(embryonic and yolk sac ECs, e&ysECs)、血祖细胞(blood progenitor cells, BPs),巨核祖细胞(megakaryocyto progenitors cells, Mega progenitors)、胚胎和卵黄囊红细胞(e&ysEry)、红髓前体细胞(erythro-myeloid progenitor cells, EMPs)、髓系祖细胞(myeloid progenitor cells, Mye progenitors),胚胎和卵黄囊巨噬细胞(e&ysMacs)等。RNA速率分析和拟时间轨迹提示,ExE.Meso2向胎盘血细胞谱系分化的过程包括:(1)ExE.Meso2分化为Haems,Haems可能分化为e&ysEC1和EMPs;(2)e&ysEC1→e&ysEC2→e&ysEC3的顺序分化,以及e&ysEC3分化为e&ysEC4和pECs;(3)EMPs分化为Mye progenitors和BPs;(4)Mye progenitors→e&ysMacs→HBCs的顺序分化;(5)BPs分化为Mega progenitors和e&ysEry1;(6)e&ysEry1→e&ysEry2→ e&ysEry3→pEry的顺序分化(图3)。
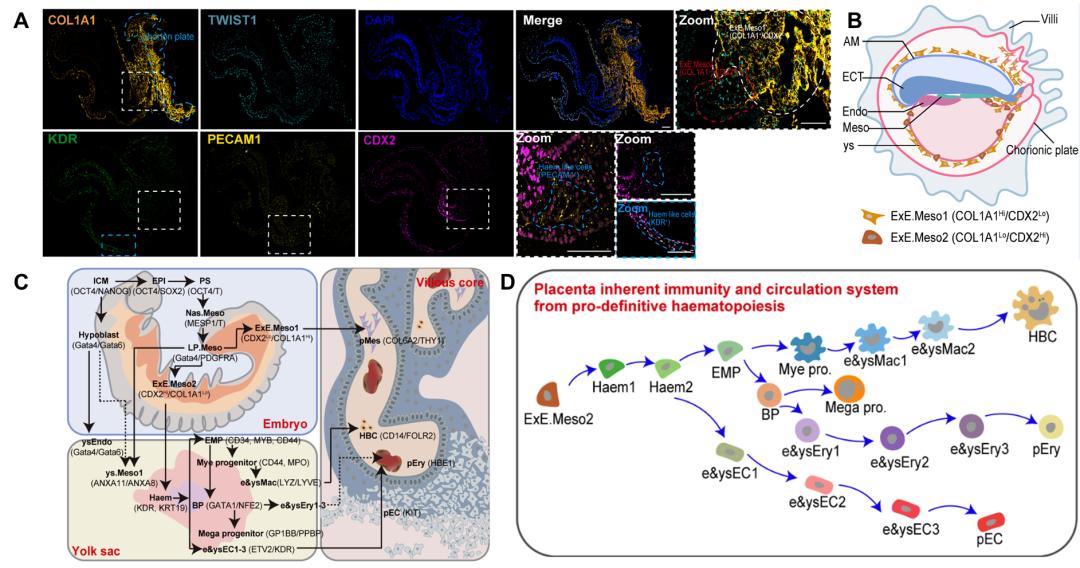
图3.免疫荧光结果显示ExE.Meso1(COL1A1+/TWIST1+/CDX2Lo)和ExE.Meso2(CDX2+/COL1A1Lo)在E22食蟹猴胚胎上的定位(A);模式图展示了推定的两种ExE.Meso的定位差异(B);模式图显示ExE.Meso2向成血管原细胞(Haems)分化,后向卵黄囊、胚胎和胎盘造血谱系细胞的假定分化途径(C);模式图根据拟时间轨迹预测和速率分析绘制胎盘HBCs、pECs、pEry来源于原始造血细胞谱系(D)
为了揭示食蟹猴和人母-胎界面细胞的种间差异,研究者将已报道的人妊娠早、中、晚期胎盘和蜕膜的单细胞转录组数据与食蟹猴全妊娠周期母-胎界面单细胞转录组数据进行比对,发现两物种母-胎界面的细胞组分和转录组特征具有高度相似性。EVTs和dNKs的表面标志物差异是已知的两物种母-胎界面的典型差异之一。CellphoneDB分析提示,两物种的EVTs和dNKs细胞之间具有相似的受体-配体耦联,提示食蟹猴和人母-胎界面上NKs募集和免疫耐受的机制具有相似性。但CD94:NKG2C和KLRC2特异存在于人,所以人EVTs和dNKs通过CD94:NKG2C_HLA-E和KLRC2_HLA-E的耦联所产生的相互作用更为显著,这可能与高等灵长类的子痫发病率更高密切相关6。
综上所述,该研究揭示了不同妊娠周期胎盘滋养层细胞的分子特征和功能变化,描绘了蜕膜细胞和滋养层细胞的相互作用伴随妊娠周期的变化,阐述了两种ExE.Meso向胎盘内细胞的分化轨迹;比较了人与食蟹猴母-胎界面细胞和分子的种间相似性和差异性。这项工作为解析灵长类胎盘发育的机制提供了重要数据和理论基础,同时为人类胎盘异常发育引起的妊娠相关疾病的研究提供对照和参考。
国家重点研发计划、中国科学院战略性先导科技专项和国家自然科学基金为该研究提供资助。
本文参考文献(可划动查看)
1. Hemberger, M., Hanna, C.W., and Dean, W. (2020). Mechanisms of early placental development in mouse and humans. Nature Reviews Genetics 21, 27-43. 10.1038/s41576-019-0169-4.
2. Megli, C.J., and Coyne, C.B. (2022). Infections at the maternal–fetal interface: an overview of pathogenesis and defence. Nature Reviews Microbiology 20, 67-82. 10.1038/s41579-021-00610-y.
3. Knöfler, M., Haider, S., Saleh, L., Pollheimer, J., Gamage, T.K.J.B., and James, J. (2019). Human placenta and trophoblast development: key molecular mechanisms and model systems. Cellular and Molecular Life Sciences 76, 3479-3496. 10.1007/s00018-019-03104-6.
4. Boss, A.L., Chamley, L.W., and James, J.L. (2018). Placental formation in early pregnancy: how is the centre of the placenta made? Human reproduction update 24, 750-760. 10.1093/humupd/dmy030.
5. Zhai, J., Guo, J., Wan, H., Qi, L., Liu, L., Xiao, Z., Yan, L., Schmitz, D.A., Xu, Y., Yu, D., et al. (2022). Primate gastrulation and early organogenesis at single-cell resolution. Nature 612, 732-738. 10.1038/s41586-022-05526-y.
6. Moffett, A., and Colucci, F. (2015). Co-evolution of NK receptors and HLA ligands in humans is driven by reproduction. Immunological reviews 267, 283-297. 10.1111/imr.12323.
作者专访
Cell Press细胞出版社公众号特别邀请王红梅研究员代表研究团队接受了专访,请她为大家进一步详细解读。
CellPress:
您的团队为何选择开展食蟹猴全妊娠期胎盘的动态转录组图谱的研究?
王红梅研究员:
人类胎盘是妊娠期保护母体和胎儿健康的重要临时器官。胎盘发育和功能异常可导致多种妊娠疾病。因此全面了解全妊娠周期胎盘细胞的谱系分化过程和动态变化特征极为重要。胎盘的发育并非孤立事件,其发育不仅依赖于囊胚阶段滋养外胚层的分化,而且依赖于原肠运动阶段胚胎尾部原条细胞的分化。尽管已有研究利用单细胞转录组测序揭示了胎盘细胞在某些特定发育阶段的分子特性,但胎盘细胞谱系在全妊娠周期的分化过程和变化特征仍未被解答。若要全面解答这一问题,我们不仅需要获得全妊娠周期的胎盘样品,还需要获得早期的胚胎样品。但是,获得正常的均一的人全妊娠周期胎盘样品和早期胚胎样品非常困难。因此我们开展了这项非人灵长类食蟹猴全妊娠期母-胎界面细胞的转录组图谱研究。
CellPress:
您认为此项研究的亮点是什么?
王红梅研究员:
我们首次构建了灵长类全妊娠期的母-胎界面单细胞转录组图谱。基于深度生信分析和实验验证,我们发现胎盘滋养层细胞在全妊娠期表现出动态分子差异和功能变化,而蜕膜细胞相对稳定。滋养层细胞和蜕膜细胞的相互作用在不同妊娠阶段的改变提示母-胎界面在不同妊娠阶段的功能变化。基于早期胚胎细胞和胎盘绒毛内细胞的整合分析,我们发现ExE.Meso的两个类群或分别贡献于胎盘间质和血细胞谱系。基于食蟹猴和人母-胎界面细胞的比较分析,我们发现两物种母-胎界面的细胞组成和分子特征非常相近,进一步证明我们食蟹猴胎盘研究对人胎盘研究的可推演价值。
CellPress:
您觉得此项研究对领域内外有哪些理论和应用意义?
王红梅研究员:
此项研究公开发表了食蟹猴全妊娠周期母-胎界面的单细胞转录组数据,为精确系统地认知灵长类胎盘发育过程和功能演变提供了完整的数据参考,为灵长类胎盘或蜕膜的研究提供系统的可比对的数据蓝本。我们在食蟹猴不同时期滋养层细胞的增殖和分化能力的研究中发现早期CTBs具有更强的增殖和分化能力,这为灵长类滋养层干细胞的体外诱导分化提供理论支持。我们首次展示了胚外中胚层向胎盘绒毛内细胞分化的生信证据,这对解释灵长类胎盘绒毛内细胞的起源具有重要理论意义。同时我们的研究为妊娠相关疾病的研究提供了可参考的数据蓝本,妊娠早、中、晚期疾病的母-胎界面研究均可对照我们的数据,直接获知相关基因在某种细胞生理性表达水平,并有助于对组学研究数据进行细胞注释和分期,所以该项研究工作对妊娠疾病的研究同样具有重要意义。
作者介绍

王红梅
研究员
王红梅,中国科学院动物研究所研究员,博士生导师。干细胞与生殖生物学国家重点实验室主任,北京干细胞与再生医学研究院副院长。国家杰出青年基金获得者,国家重点研发计划“基于干细胞的生育力维持与重建”项目负责人。国家百千万人才工程,“有突出贡献中青年专家”。主要研究方向为:(1)哺乳动物早期胚胎和胎盘发生的细胞和分子机制;(2)干细胞与人类生育力的维持和重建。以通讯作者身份在Science、Nature、Nat Genet、Cell Res、Adv Sci、Cell Rep、eLife、Trends Genet、Curr Opin Cell Biol、Trends Mol Med、Development、Mol Endocrinol和Biol Reprod等期刊发表研究论文及综述100余篇。

蒋祥祥
校聘教授
蒋祥祥,安徽医科大学校聘教授,博士生导师。先后在中国科学院动物研究所攻读博士学位和从事博士后研究工作。国家自然科学基金青年基金项目主持人,国家重点研发计划项目骨干。主要研究方向为:哺乳动物(人、食蟹猴、小鼠等)母-胎界面细胞发育和功能,即以胎盘为中心,利用生物信息分析和生物实验技术研究胎盘细胞和胚胎细胞的发育及母体蜕膜免疫细胞的功能。以第一作者和通讯作者身份在Science、Nature、Dev Cell、Cell Mol Immunol、Cell Discov等期刊发表研究论文12篇。

翟晶磊
副研究员
翟晶磊,中国科学院动物研究所干细胞与生殖生物学国家重点实验室副研究员。先后在中国科学院动物研究所攻读博士学位和从事博士后研究工作。主持国家自然科学青年项目和中国科学院特别研究助理项目,以研究骨干身份参与国家重点研发计划两项。主要研究方向为:(1)利用生物材料构建啮齿类和灵长类胚胎体外长时程培养体系;(2)利用胚胎培养体系研究灵长类动物原肠运动与早期器官发育核心事件;(3)构建灵长类早期胚胎和胚外组织单细胞多组学图谱等。以第一作者身份在Science、Nature、Trends Cell Biol和Adv Sci等期刊发表研究论文及综述7篇。

肖振宇
副教授
肖振宇,北京理工大学生命学院副教授,校聘研究员,博士生导师。荷兰莱顿大学(Leiden University)生物学博士,中国科学院动物研究所“致一”博士后。主持欧盟“地平线计划”、国家级、省部级项目多项。主要研究方向为:(1)解析灵长类胚外组织发育、细胞谱系发生与疾病机理;(2)关注生命科技前沿领域伦理、网络生物安全与挑战。以第一作者和通讯作者身份在Nat Commun、Dev Cell和Trends Cell Biol等期刊发表研究论文及综述18篇。

吴绪伦
博士在读
吴绪伦,中国科学院动物研究所博士研究生,师从王红梅研究员。

张丹
主任医师
张丹,浙江大学求是特聘教授,主任医师,博士生导师。浙江大学医学博士。主持国家重点研发计划项目、国家自然科学基金课题等国家级项目八项。主要研究方向为:生殖健康与发育源性疾病的临床与基础研究。以通讯作者身份在Nat Commun、Am J Obstet Gynecol、Nano Today、Jama Netw Open、Cell Rep等期刊发表研究论文及综述50篇。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Developmental Cell上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Identifying a dynamic transcriptomic landscape of the cynomolgus macaque placenta during pregnancy at single-cell resolution
▌论文网址:
https://www.cell.com/developmental-cell/fulltext/S1534-5807(23)00108-9
▌DOI:
https://doi.org/10.1016/j.devcel.2023.03.012
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




