- +1
区区胃炎为何牵扯出乳腺癌?罕见转移诊治思路,一文梳理
原创 Lily 医学界肿瘤频道
*仅供医学专业人士阅读参考
警惕诊疗走“弯路”!
撰文 | Lily
主诉“腹胀恶心15日”,外院胃镜“慢性非萎缩性胃炎”,看似平平无奇的病例,如何牵扯出“首例”首诊原发性乳腺癌合并胃转移及骨转移?近日,吉林大学附属第二医院团队于BMC Womens Health报告了相关病例,“医学界肿瘤频道”特整理治疗过程,带您一探究竟!

病例发表于BMC Womens Health
从胃炎到乳腺癌,诊疗走过哪些“弯路”?
患者,女性,58岁。发现腹胀伴恶心呕吐15天。于2022年9月1日在外院接受胃镜检查及保守治疗,症状未见缓解,2022年9月5日至我院肝胆胰外科就诊。
初步诊断:十二指肠肿块合并胃潴留
体格检查:未发现异常。
钡剂造影:胃体积增加、胃潴留、胃肠吻合口狭窄,造影剂通过受阻(图1A)。
外院胃镜:十二指肠球部变化、胃潴留和慢性非萎缩性胃炎。
外院胃镜活检:十二指肠粘膜慢性炎症、水肿和腺体增生。

图1A. 术前上消化道x线钡餐示胃潴留,胃十二指肠吻合口狭窄,造影剂通道梗阻。
首次治疗:胃空肠吻合和结肠造口手术
2022年9月15日,为缓解梗阻症状,患者行胃空肠吻合和结肠造口手术。
术中发现:胃窦到十二指肠球部有局限性隆起,大小约为6.0 cm×3.0 cm×2.0 cm,肿块所在胃壁增厚、硬化且活动度差,肿块侵犯部分十二指肠壁,探查相邻器官和淋巴结未见异常,取十二指肠周围受累组织进行检查。
术中快速病理:胃窦存在少量炎性细胞浸润和少量异型细胞,不能排除恶性病变,有待术后病理和免疫组化结果进一步分析。
术后病理:胃窦纤维结缔组织中散在异质细胞,结合免疫组化染色结果,不排除乳腺起源的浸润性小叶癌。
免疫组化:ER(90%),PR(-),Ki67(2%),GATA3(+),CK(AE1 / AE3)(+),CK7(+),CK20(-)(图2)。
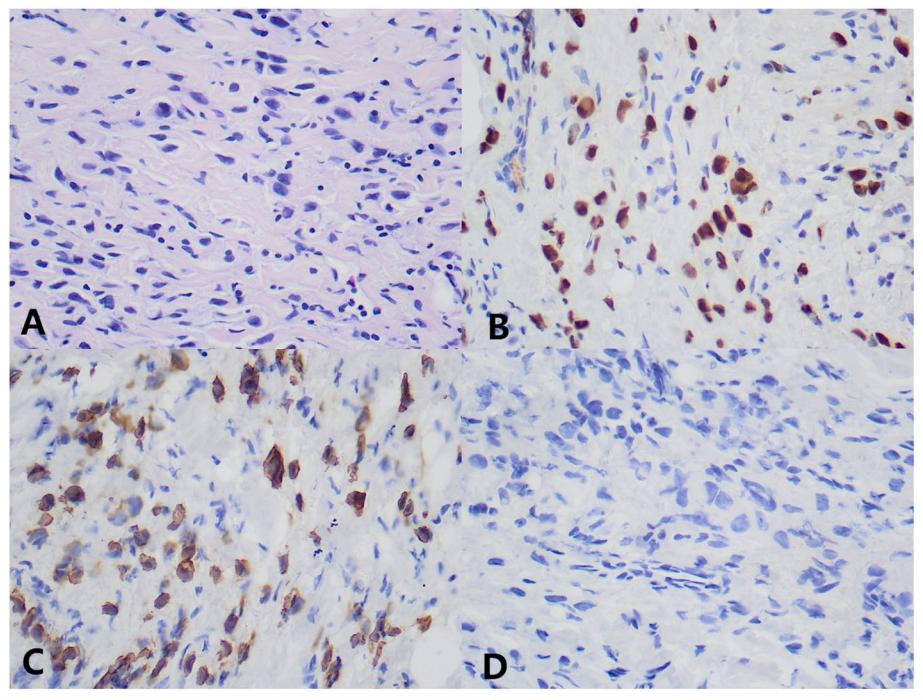
图2. 胃转移灶黏膜组织病理学免疫组化图。×400:HE染色显示胃窦转移灶浸润性小叶癌。B×400:胃转移灶的肿瘤细胞经IHC分析显示GATA3阳性。C×400:IHC分析显示胃转移灶肿瘤细胞CK7阳性。D×400:胃转移灶内肿瘤细胞经IHC检测显示CK20阳性。
乳房和腋窝超声检查:右乳7点乳头旁可见一大小约2.1 cm×1.0 cm的低回声团,形态不清且不规则,内有点状强回声。可见右腋窝淋巴结回声,约1.2 cm×0.7 cm,以皮质回声为主。
超声诊断:右乳肿块,BIRADS-US分级:4C级。右腋窝淋巴结肿大(图1B,C)。
2022年9月21日,在局麻下对右乳肿块和腋窝淋巴结行粗针穿刺活检。

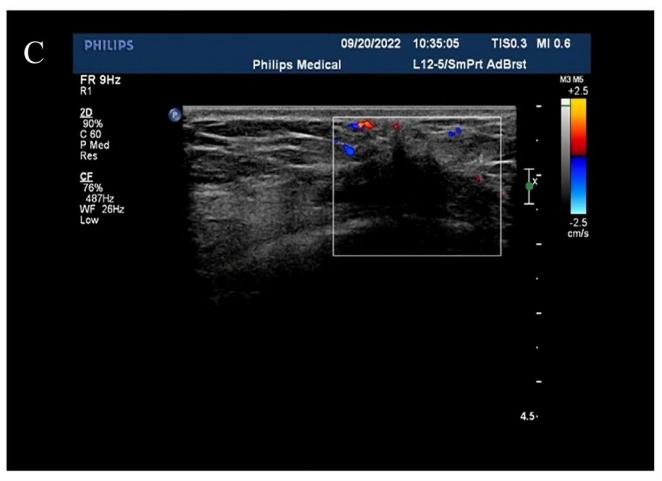
图1B,C. 乳腺超声示右乳7点乳头旁约2.1 cm×1.0 cm低回声团,形状不规则,边界不清,内有点状强回声,CDFI:可见血流信号。
穿刺病理:(右乳肿块穿刺)浸润性小叶癌(经典型),(右腋窝淋巴结穿刺)未见癌。
免疫组化:ER(95%),PR(-),HER-2(0),Ki67(5%),GATA3(+),E-Cadherin(-),CK(AE1/AE3)(+),P120(胞浆+)(图3)。
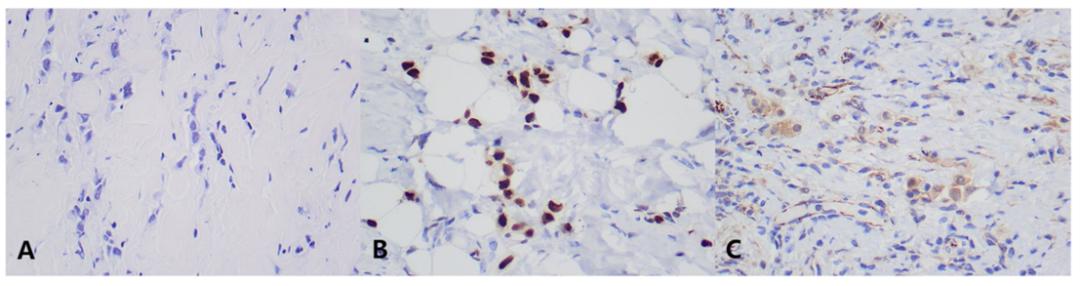
图3. 乳腺肿瘤组织病理免疫组化图。A×400:HE染色显示乳腺肿瘤病理类型为浸润性小叶癌。B×400:乳腺肿瘤细胞经IHC分析GATA3阳性。C×400:IHC检测乳腺肿瘤细胞胞浆内P120阳性。
最终诊断:右乳腺癌
2022年10月8日,患者至我院乳腺外科接受下一步治疗。入院后行乳腺肿瘤标志物、全身骨扫描和胃部增强CT检查以进一步评估病情。
乳腺肿瘤标志物:CA125 39.60U / ml(0~35U / ml),CA153 32.40U / ml(0~31.3U / ml)。
术后胃部CT:窦区胃壁增厚伴周围淋巴结(图1D,E)。
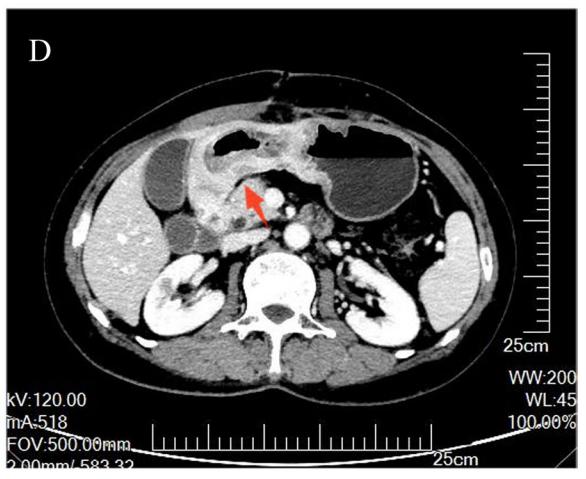

图1D,E. 术后胃CT显示胃窦胃壁增厚,最厚处直径约22 mm,累及管腔环周,长约150 mm,周围淋巴结提示术后梗阻症状明显缓解。
全身骨扫描:多发肿瘤骨转移,通过全身检查和骨科专家会诊,最终考虑来源于乳房(图1F)。
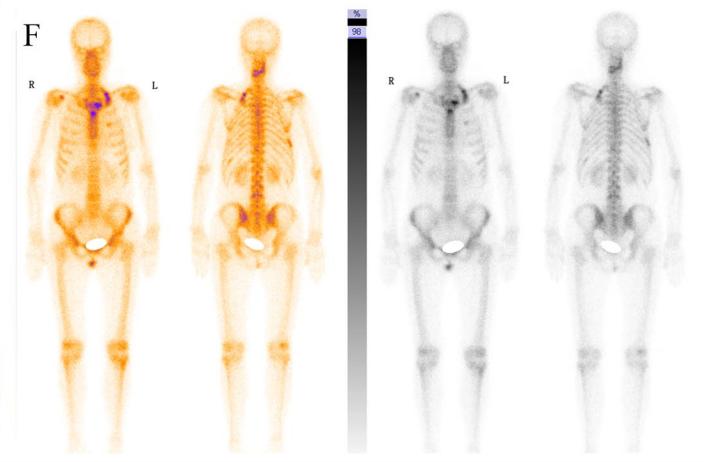
图1F. 全身骨扫描提示肿瘤多发转移。
诊断:右乳腺癌,cT2N0M1,IV期。
治疗:使用双磷酸盐和CDK4 / 6抑制剂哌柏西利(Palbociclib)联合芳香化酶抑制剂(AI)依西美坦(Exemestane)进行姑息治疗。病人目前正在接受定期评估和随访。
乳腺癌罕见转移,需梳理诊疗思路
乳腺癌是我国女性第一大癌。在医疗检查手段不断进步、公众筛查意识日益增强的今天,仍有3.6%-6%乳腺癌初诊为IV期。对于骨(66.3%)、肺(30.3%)、肝(26.1%)和脑(7.3%)这些最常见的远处转移部位,我们往往能保持警惕,但发生率仅0.3%的胃转移实属让人防不胜防。类似病例少见,但其带给我们的启示却不少,以下从三个方面为您梳理诊治思路。
01
乳腺小叶癌+胃肠道症状,留神胃转移
乳腺癌胃转移不仅少见,且多发生在乳腺癌诊断后数年,Ayantunde等回顾发现原发性乳腺癌诊断到胃肠道转移的平均潜伏期为6.5年。本例患者以腹胀为首发症状,检查结果提示胃窦内巨大结节,依靠术中及术后病理作出诊断,这种情况在迄今为止的所有报告中都很少见。且乳腺癌胃转移临床表现多为消化不良和上腹部疼痛,可伴有出血、恶心、呕吐,因此往往难以与原发性胃癌区分。
乳腺癌胃转移的胃镜表现通常为粘膜下层和内在肌层的弥漫性浸润性炎症,散在结节和外压少见。弥漫性浸润又是侵袭性小叶癌转移的特点,Taal等报道83%的乳腺癌胃转移患者以小叶乳腺癌为主要病理类型。大多数(94%)患者还会有其他部位的转移,其中主要为骨转移。
因此,在乳腺浸润性小叶癌患者出现胃肠道症状时,应警惕胃转移的存在。
02
免疫组化分析,善用“组合拳”
据报道,即使乳腺癌原发灶ER和PR表达呈阳性,胃转移的ER和PR状态仍可能呈阴性,因此通过激素受体表达状态诊断乳腺癌转移尚不可靠。
研究表明, E-钙黏蛋白(E-cadherin)表达缺乏与转移性乳腺侵袭性小叶癌显著相关,而胃镜下癌组织中E-cadherin表达的缺失可能增加乳腺侵袭性小叶癌转移的可能性。此外,GATA结合蛋白3(GATA3)和巨囊性病液体蛋白-15(GCDFP-15)非常有助于乳腺癌转移瘤的诊断,还可在鉴别诊断中发挥重要作用。GCDFP-15的阳性表达可正确识别为转移性乳腺癌的恶性病变,高度敏感(55%-76%)和特异(95%-100%)。
研究表明,GATA3的诊断敏感性为32%-90%,在所有乳腺肿瘤细胞中为阳性,而在胃肠道癌症中表达极低,因此使用GATA3抗体识别乳腺癌胃转移非常有效。再次,乳腺癌通常呈CK7表达阳性,CK20表达阴性, CK20通常在结肠直肠和其他胃肠道癌症中表达,很少在乳腺癌中表达。
在本例中,胃转移的免疫组化为ER(90%),PR(-),Ki67(2%),GATA3(+),CK(AE1/AE3)(+),CK7(+),CK20(-),表明肿瘤来源于乳腺,并被认为是乳腺浸润性小叶癌的胃转移。
综上所述,免疫组化分析应善用组合,因为没有标记物具有100%特异性或敏感性。
03
乳腺癌胃转移,手术并非首选
目前,尚无关于乳腺癌胃转移治疗的指南。手术并非首选,而应主要作为患者出现阻塞、出血和穿孔等并发症时的姑息治疗。
在晚期HR阳性乳腺癌患者中,PALOMA-2临床试验表明,哌柏西利联合AI作为一线内分泌治疗可将无进展生存期(PFS)较对照组延长10.3个月。故本例患者最终接受了胃肠姑息手术,并在多学科会诊后选择联合使用CDK4/6抑制剂与依西美坦进行内分泌治疗。
更多精彩内容,扫码下方二维码,查看乳腺癌相关治疗
长按识别二维码
或点击阅读原文
精彩资讯等你来
参考文献:
[1]Sun L, Liu J, Guo M, Xu J, Wang D. First diagnosed invasive lobular carcinoma of the breast combined with gastric metastasis and bone metastasis: a case report and review of the literature. BMC Womens Health. 2023 Mar 25;23(1):133. doi: 10.1186/s12905-023-02267-6. PMID: 36966290; PMCID: PMC10040113.
审核主编:于江泳教授
责任编辑:Sheep
*医学界力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
原标题:《区区胃炎为何牵扯出乳腺癌?罕见转移诊治思路,一文梳理》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




