- +1
Trends in Microbiology综述:靶向入胞复合物和融合蛋白的人类疱疹病毒预防及治疗
原创 Cell Press CellPress细胞科学

生命科学Life science
人类疱疹病毒在人群中普遍感染,初次感染后会在宿主体内形成终生潜伏,并伴有反复再激活,与多种疾病的发生发展密切相关。然而,目前仅有针对水痘-带状疱疹病毒的疫苗上市,亟需研发针对其他亚型人类疱疹病毒的有效性预防及治疗药物。人类疱疹病毒感染靶细胞是多个糖蛋白参与的复杂过程,其中核心感染过程均涉及以糖蛋白H和L(gHgL)为基础的入胞复合物和融合蛋白B(gB)。对于入胞复合物及融合蛋白的结构及融合机制的研究将有助于研发有效的预防性疫苗及治疗性药物等。近日,中山大学肿瘤防治中心/重庆医科大学/厦门大学/美国罗文大学联合在Cell Press细胞出版社旗下期刊Trends in Microbiology发表综述文章“Targeting herpesvirus entry complex and fusogen glycoproteins with prophylactic and therapeutic agents”,系统性总结了人类疱疹病毒感染的分子机制以及靶向入胞复合物和融合蛋白gB的疫苗及中和抗体的最新研究进展。
人类疱疹病毒感染过程
一般来说,所有人类疱疹病毒感染细胞的过程都基本分为三个步骤(图1):首先,病毒糖蛋白与细胞表面分子结合,以锚定病毒并拉近病毒包膜与宿主细胞膜之间的距离;其次,基于gHgL的入胞复合物与特定的细胞受体结合,介导入胞复合物发生构象变化,进而将膜融合信号传递给gB。最后,gB发生构象变化,导致融合环插入到宿主细胞膜或内体膜,而后gB重新折叠形成能量更低、结构更稳定的融合后状态,最终完成膜融合过程。
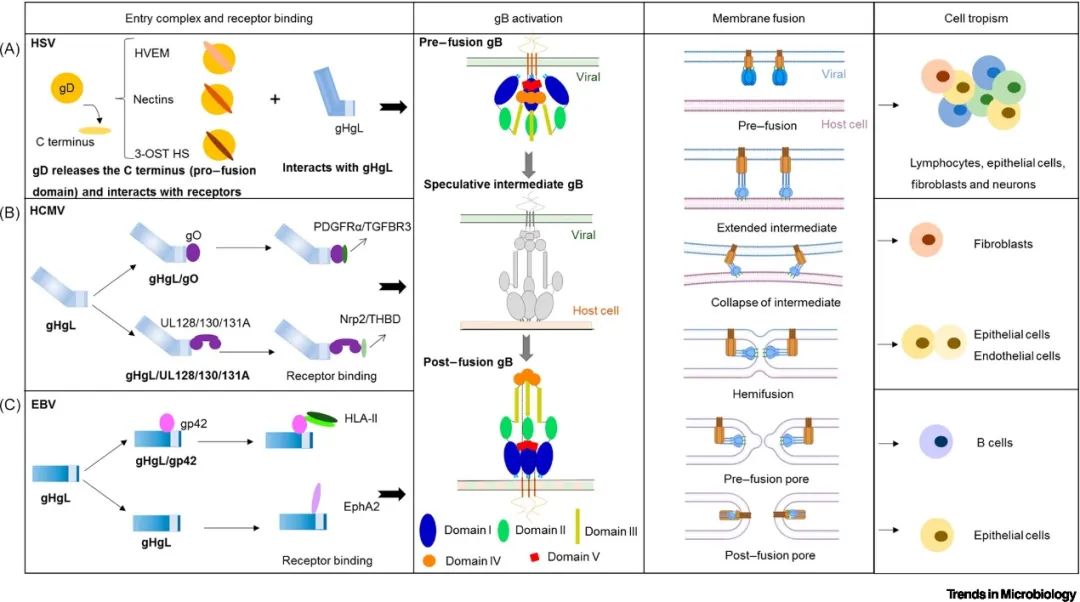
▲图1 人类疱疹病毒α-、β-和γ-亚家族感染细胞的过程
入胞复合物及其受体
所有人类疱疹病毒的入胞复合物均包含gH、gL两种核心蛋白。gH包括膜外域、单次跨膜螺旋结构域和胞内域三部分。gL是一种分泌型糖蛋白,其作为分子伴侣与gH的膜远端结构域(gH结构域I)共折叠形成稳定的异源二聚体。
除gH和gL外,不同亚型人类疱疹病毒的入胞复合物还包含其他蛋白。例如,gD是HSV入胞的必需糖蛋白 [1];gO、UL128、UL130、UL131A是HCMV感染的必需糖蛋白 [2];gQ1和gQ2参与人类疱疹病毒-6A、6B和7感染细胞 [3];另外,gp42是EBV感染B细胞所必需的 [4]。入胞复合物与各种细胞表面受体之间的相互作用决定了不同亚型人类疱疹病毒的细胞嗜性。
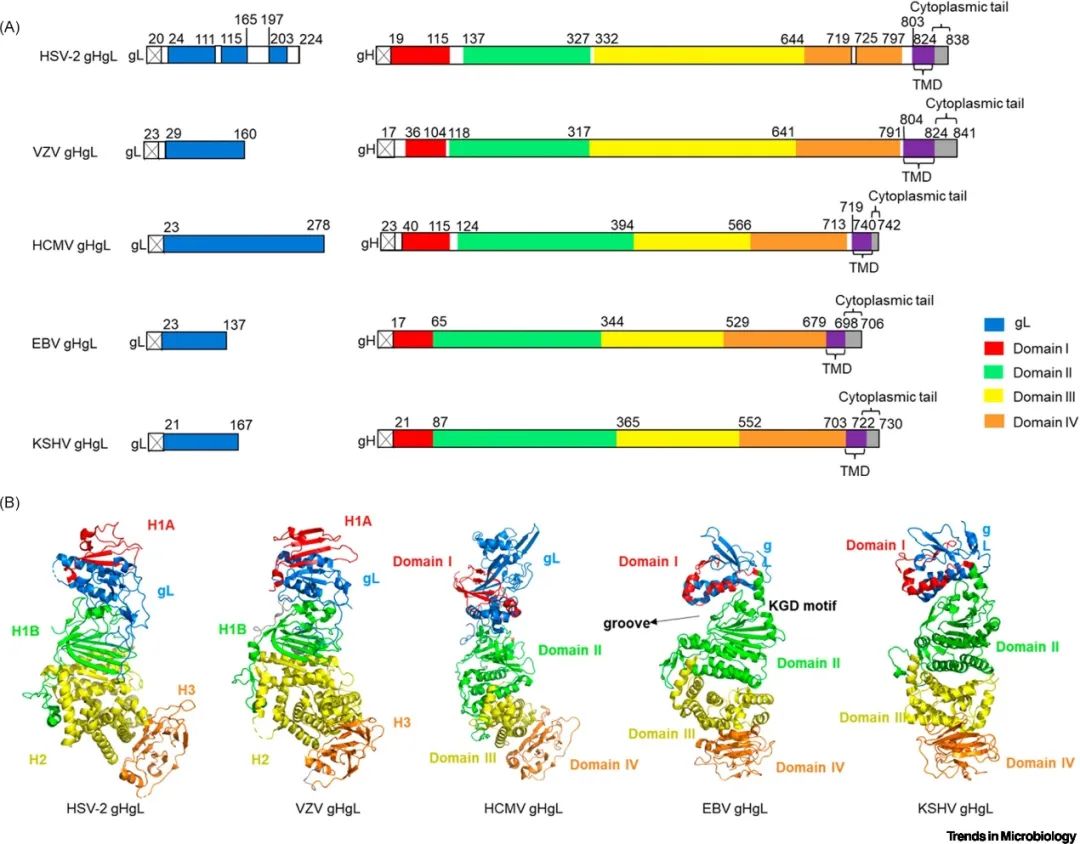
▲图2 gHgL异源二聚体结构
融合蛋白gB
人类疱疹病毒融合蛋白gB属于III类融合蛋白,不同亚型疱疹病毒gB的结构整体相似,包含D-I到D-V五个结构域(图3)。gB的近膜端区域、跨膜结构域和胞内域共同构成了一个支架,其中胞内域作为一个固定夹稳定pre-gB构象,直到被入胞复合物所传递的融合信号触发,完成从pre-gB到post-gB的构象转变,介导细胞膜和病毒包膜的融合。gB融合前构象的不稳定性导致难以在天然状态下获得其精确结构,因此最近HCMV和HSV-1 pre-gB的结构主要是借助cryo-EM平台并通过添加小分子变构抑制剂及交联剂或引入脯氨酸突变等分子设计解析获得(图3) [5,6]。
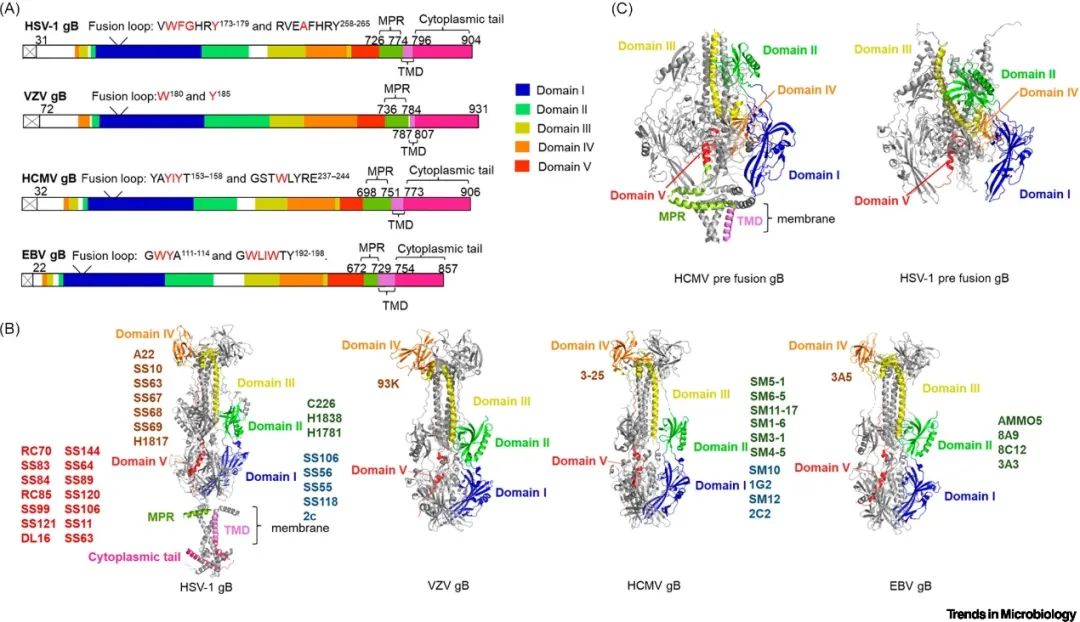
▲图3 融合蛋白gB的结构及靶向gB的中和抗体
靶向入胞复合物及gB的中和抗体
解析入胞复合物和融合蛋白的结构及其与受体的相互作用,可以进一步指导小分子抑制剂和高效中和抗体的开发。目前已经鉴定出多种靶向入胞复合物和gB的中和抗体,并进入临床试验评估。靶向入胞复合物的中和抗体其中和机制主要是干扰其与受体的相互作用或影响入胞复合物不同糖蛋白之间的相互作用。gB特异性中和抗体可能会干扰融合的不同步骤,如阻断gB与受体的相互作用、阻断gB与入胞复合物之间的相互作用、抑制gB构象变化或与融合环结合以阻断其融合活性。考虑到人类疱疹病毒感染的复杂性,有些临床试验中采用了中和抗体的鸡尾酒疗法。例如,靶向HCMV的鸡尾酒疗法CSJ148(包含一种靶向HCMV gB的特异性中和抗体LJP538和一种HCMV 五聚体入胞复合物的特异性中和抗体LJP539)可有效降低病毒载量。
靶向入胞复合物及gB的疫苗
在病毒感染过程中发挥关键作用的入胞复合物组分和融合蛋白gB是疱疹病毒疫苗开发的理想抗原。同样,考虑到人类疱疹病毒感染的复杂性,多种包膜糖蛋白的组合可能是一种更优的免疫原。针对HCMV的mRNA疫苗(mRNA-1647)由分别编码gB和5个五聚体入胞复合物蛋白的mRNA组成,在III期临床试验(NCT05085366)中显示可诱导产生强效和持久的中和抗体。Moderna公司研发的针对EBV的mRNA疫苗(mRNA-1189)正在进行临床试验(NCT05164094),共包含有4种分别编码gH、gL、gp42和gp220的mRNA。
总结与展望
人类疱疹病毒感染入胞是一个复杂且精密的过程。目前对gHgL的结构研究和受体鉴定以及对融合蛋白gB融合前和融合后构象的深入研究为我们在分子水平上理解人类疱疹病毒的感染过程提供了有价值的信息。然而,本领域内仍然存在一些尚未解决的问题,如涉及膜融合过程的其他病毒蛋白的结构解析、融合信号在病毒糖蛋白间的传递机制以及如何研发更为有效的针对人类疱疹病毒的疫苗或治疗性药物等。
中山大学肿瘤防治中心博士生钟玲、张琬琳以及罗文大学Claude Krummenacher教授为本文的共同第一作者,中山大学肿瘤防治中心徐淼教授、重庆医科大学张晓副教授为本文的共同通讯作者。
本文参考文献(上下划动查看)
1.Fan, Q. et al. (2017) Mapping sites of herpes simplex virus type 1 glycoprotein D that permit insertions and impact gD and gB receptors usage. Sci Rep 7, 43712. 10.1038/srep43712
2.Zhou, M. et al. (2015) Human Cytomegalovirus gH/gL/gO Promotes the Fusion Step of Entry into All Cell Types, whereas gH/gL/UL128-131 Broadens Virus Tropism through a Distinct Mechanism. J Virol 89, 8999-9009. 10.1128/JVI.01325-15
3.Akkapaiboon, P. et al. (2004) Intracellular Processing of Human Herpesvirus 6 Glycoproteins Q1 and Q2 into Tetrameric Complexes Expressed on the Viral Envelope. Journal of Virology 78, 7969-7983. 10.1128/jvi.78.15.7969-7983.2004
4.Sathiyamoorthy, K. et al. (2016) Structural basis for Epstein-Barr virus host cell tropism mediated by gp42 and gHgL entry glycoproteins. Nat Commun 7, 13557. 10.1038/ncomms13557
5.Liu, Y. et al. (2021) Prefusion structure of human cytomegalovirus glycoprotein B and structural basis for membrane fusion. Sci Adv 7. 10.1126/sciadv.abf3178
6.Vollmer, B. et al. (2020) The prefusion structure of herpes simplex virus glycoprotein B. Sci Adv 6. 10.1126/sciadv.abc1726

论文作者介绍

徐 淼
研究员
中山大学肿瘤防治中心华南肿瘤学国家重点实验室PI,研究员,博士生导师,国家优青。研究方向为EB病毒和鼻咽癌。2005年清华大学本科毕业,2010年博士毕业于北京协和医学院、中国医学科学院。近年来围绕“华南高发区存在特异致鼻咽癌的EB病毒亚型”这一研究主线,开展基础和转化研究:1)首次发现鼻咽癌特异EB病毒高危亚型BALF2_CCT,是迄今为止发现的鼻咽癌最高风险因素,阐明了“鼻咽癌为何在华南高发”这一关键科学问题,开发新筛查方案提高鼻咽癌筛查效能9倍;2)揭示EB病毒与抗原特异T细胞和gB中和抗体关键相互作用,为EBV疫苗和鼻咽癌治疗提供潜在干预靶点。相关研究成果入选2019年中国医药生物技术十大进展,被EB病毒领域资深同行专家引用推荐并撰写专门评述。近五年来以(共同)第一/通讯作者发表多篇国际高水平期刊论文,包括Nat Genet、Nat Commun、Proc Natl Acad Sci USA、J Virol、Cancer Res等;主持国家重点研发计划青年科学家、国家自然科学基金、广东省杰青等项目;参与编写国家卫计委“十二五”规划教材《肿瘤学》和全国高等医学院校教材《肿瘤学概论》。

张 晓
副教授
重庆医科大学药学院副教授,博士,硕士研究生导师。于2015年博士毕业于厦门大学,随后加入中山大学肿瘤防治中心从事博士后和特聘研究,2022年以“青年创新人才”引入重庆医科大学继续开展工作。科研工作主要聚焦于病毒感染及其相关疾病的干预策略研究。截至目前发表SCI论文40多篇,多项代表性成果以第一(共一)或通讯作者发表在PNAS, Cell Res, Nat Commun, Nano Lett, JVI等高水平期刊;授权或申请专利十余项;作为负责人主持包括国自然青年基金在内的国家及省部级课题3项。参编人民卫生出版社首部《生物技术制药》实验数字教材。
相关论文信息
相关研究发表在Cell Press细胞出版社旗下
期刊Trends in Microbiology,
▌论文标题:
Targeting herpesvirus entry complex and fusogen glycoproteins with prophylactic and therapeutic agents
▌论文网址:
https://www.cell.com/trends/microbi-ology/fulltext/S0966-842X(23)00077-X
▌DOI:
https://doi.org/10.1016/j.tim.2023.03.001
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




