- +1
药品开发的新视角:G-四链体与膳食黄酮类化合物的相互作用
原创 Cell Press CellPress细胞科学

生命科学Life science
G-四链体结构丰富多样,在生物体内动态存在,参与了转录、复制、基因组稳定性和表观遗传调控等关键的基因组功能,与癌症生物学密切相关。黄酮类化合物是天然的抗氧化剂, 能帮助清除体内的自由基, 可抑制多种化学物质的诱变作用, 激发和提高动物免疫系统的功能, 并具有抗促癌及诱导癌细胞分化的作用,对于预防心血管疾病、各种肿瘤、更年期综合征等慢性疾病意义十分重大。G-四链体结构与膳食黄酮类化合物存在相互作用,能够影响癌症基本过程,有望为癌症治疗和检测提供新的途径。本篇综述对G-四链体、膳食黄酮类化合物及二者相互作用进行了阐述。2023年2月20日,这项文献综述以“Structural insights and shedding light on preferential interactions of dietary flavonoids with G-quadruplex DNA structures: A new horizon”为题,发表在Cell Press细胞出版社期刊Heliyon上。

论文摘要
G-四链体是一种独特的核酸结构,它分布在人类基因组的各个部位,靶向G-四链体业已成为一种新的药物开发策略。天然形成的膳食黄酮类化合物化学结构独特,易于获取,毒性低,生物利用度高,广泛存在于植物性饮料和食品中。目前合成药物应用广泛,随之而来的各种不良反应亦层出不穷;而膳食黄酮类化合物作为低分子量化合物,药理效果理想,细胞毒性小,或可替代合成治疗药物。因此从药物开发角度而言,对于膳食黄酮类化合物这种可与四链体相互作用的天然小化合物,筛选研究其对多态G-四链体结构的选择性相互作用能力非常重要。本综述旨在提供有关G-四链体结构、G-四链体结构与膳食黄酮类化合物相互作用方面的最新研究情况,为开发新型治疗药物提供新视角。
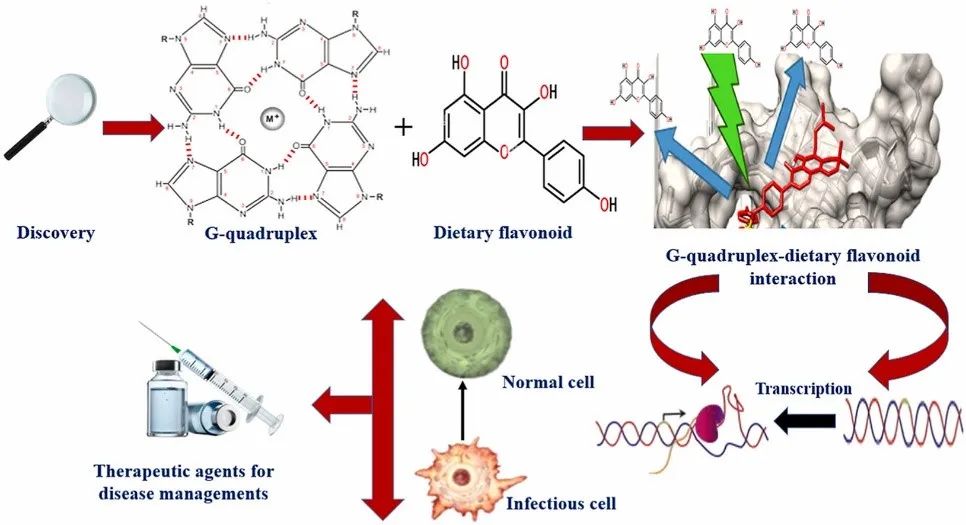
简介
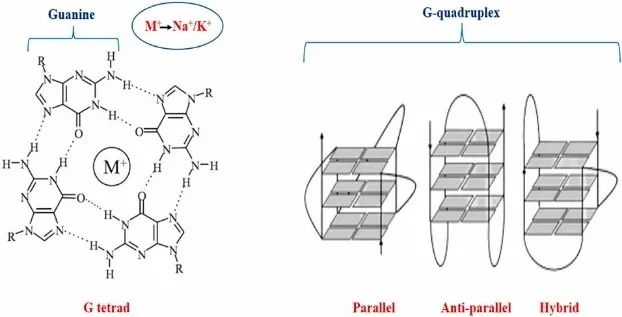
G-四链体是一种在核酸中存在的独特的结构,它分布在人类基因组的各个部位。G-四链体结构存在于癌基因的重要调控区域,影响转录、剪接、翻译、端粒完整性等过程。它们的完整性和结构的改变会导致癌基因的不同表达,从而导致癌症。因此,小分子生物制剂靶向G-四链体结构已经成为了在研的抗癌方式。G-四链体结构可以在具有较长环或每个重复少于三个鸟嘌呤的区域形成,也可以在不符合这种严格G-四链体模式的区域形成。G-四链体结构的稳定性由许多参数决定,包括每个重复中鸟嘌呤的数量和环长度。人类DNA中有超过50%的重复DNA序列,当这些序列在转录或复制等过程中解开时,它们会转化为单链长度,可以折叠成各种非典型形式——G-四链体DNA结构、i-基序、十字形DNA、三链体,以及其他类似结构。富含鸟嘌呤的DNA产生的二级构建体可能形成G-四链体结构,但如果存在单价金属离子就无法产生。
虽然G-四链体最初是在体外发现的,但越来越多的证据表明这种核酸构建体也在全基因组范围内的活细胞中产生。这些富含鸟嘌呤的重复序列很可能相互堆叠形成鸟嘌呤平面。G-四链DNA结构根据链极化可分为三个主要变型:
“反平行”(四个链中的一对指向相同的方向)
“平行”(所有链指向相同的方向)
“杂交”或“混合平行—反平行”(三个链以相同的方向运行,而第四个链以相反的方式运行)。
作为治疗癌症的可能候选药物,有两大类G-四链体DNA结构引起了关注:
A. 能够形成于端粒DNA单链鸟嘌呤突出端的G-四链体;
B. 位于特定癌基因启动子区域内的G-四链体(如c-MYC、VEGF、c-KIT、PDGF-A、k-RAS、Hsp90、HIF1)。
一般来说,细胞DNA以B形式存在。在人类基因组中,G四链体DNA的形成序列经常出现在疾病相关基因的染色体突变热点区域。尽管该领域取得了一些重要进展,但关键问题仍然是选择性和亲和力之间的权衡。由于G-四链体结构在癌症等疾病中并不稳定,发现特别稳定的G-四链体配体就成了化学和生物学的一个前瞻性研究领域。目前已经研究了几种可结合与稳定G-四链体结构的小化合物。这些化合物中的大多数都具有较大的表面积,并通过π-π堆叠相互作用附着在G-四链体DNA上。
黄酮类化合物是天然存在于药用植物、蔬菜、水果、花卉和一些饮料中的多酚类物质,具有抗病毒、抗炎、抗氧化、抗肿瘤的特性。膳食黄酮类化合物可以作为抗氧化剂,诱导改变信号转导途径,减轻DNA损伤,清除活性氧,阻止DNA加合物的产生,促进DNA修复,干扰化学损伤。大豆黄酮、芦丁、槲皮素和染料木黄酮已被证明可与G-四链体DNA相互作用。
本文重点探讨了几种膳食黄酮类化合物与G-四链体之间的相互作用。膳食黄酮类化合物之间的结构差异可导致这些化学物质与不同的DNA结构发生不同的相互作用。
G-四链体的体内组织和功能表征
人类基因组包含700000个潜在G-四链体产生序列。这种结构不是随机分布的,而是与主要调控区域密切相关(如端粒、启动子、3’-UTR、5’-UTR、RBS)。启动子中的四链体通常会抑制基因表达,但5’-UTR和3’-UTR中的四链体通常会影响miRNA结合、替代多聚腺苷酸化、前mRNA剪接、翻译和mRNA靶向。G-四链体形成序列首次发现于人类端粒DNA。端粒的稳定性和结构与衰老、癌症和遗传稳定性有关。G-四链体可抑制端粒酶,保留端粒,从而起到肿瘤抑制作用。
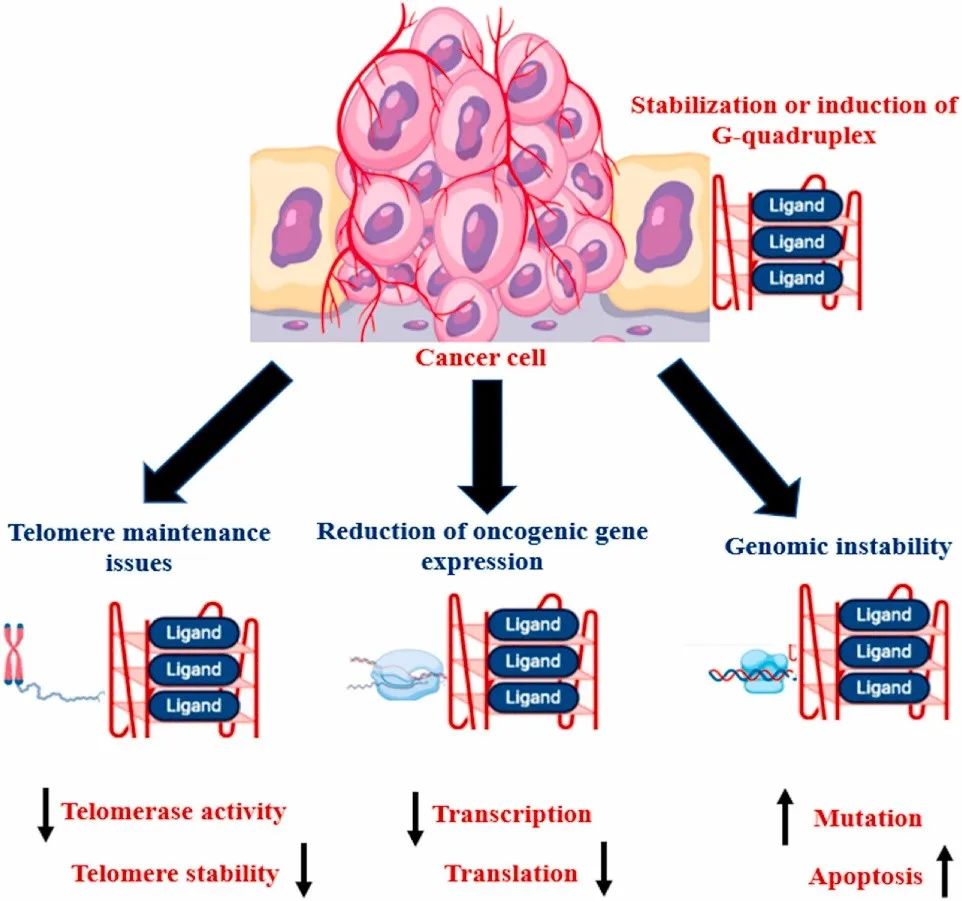
G-四链体是细胞内重要的调控守门人。G-四链体进化具有保守性,许多物种的G-四链体基序全基因组评估证实了这一点。在纤毛虫(Stylonychia lemnae)的端粒DNA中,G-四链体靶向抗体直接提示了G-四链体的存在。使用结构特异性抗体BG4后,也在哺乳类动物端粒区域和端粒之外检测到G-四链体。高DNA测序显示G-四链体结构与抗体BG440、H2AX43、1H641、hf242和DEAH/RHA解旋酶家族共定位。所有这些证据不仅阐述了G-四链体结构在基因组中的存在和位置,还证明了G-四链体的重要作用。
G-四链体配体:相互作用模式
G-四链体上附着有许多配体,使其变得更稳定或更不稳定。许多配体不是附着在已形成的四链体上,而是有助于鸟嘌呤丰富区域折叠成四链体。许多配体具有共同的结构和化学特征,都具有带电侧链的平面芳香环。一些配体通过主链网络产生的沟槽附着在G-四链体上,该网络主要包括末端G-四链体、中间G-四链体、环/主链/沟槽和中间沟道。平面杂环配体与G-四链体的接合主要通过π-π安装在末端G-四链体上。平面配体具有插入G-四链层的能力,而带电化合物则更有可能与G-四链复合物的环、主链或沟槽接合。最近研究的一项研究发现phen-DC3在氯化钾溶液中诱导dTAGGG (5’TTAGGG3’)3完全改变其折叠形态,从杂交-1变成了反平行椅子型构型,在此过程中,配体插入了2-四链单元和伪四链单元之间,并排出一个钾离子。这一研究首次揭示了配体络合成分子内G-四链体的过程。
G-四链体DNA探针和生物学结果
基因启动子序列中G-四链体DNA配体介导的结构调控或可控制有害基因表达。增加G-四链体DNA的产生和稳定性的研究显示,基于G-四链体DNA与转录调节蛋白的关联可进行转录调控。
不论是化学荧光团还是金属复合物,G-四链体DNA结构稳定的化学物质的配体都可以作为G-四链体-DNA构象的探针。G-四链体DNA相互作用后,探针的“亮”或“不亮”可表示荧光/光谱指标的上升或下降;这一过程同时也是在进一步探索那些已被荧光“标记”的高亲和力配体。染色体成像研究发现了细胞中几种具有潜在生物物理特性的配体。
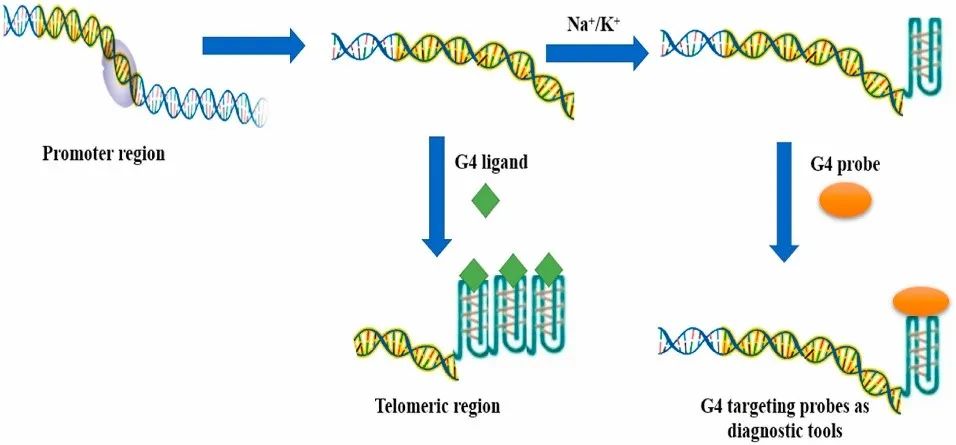
过去十年,有效的具有稳定二级结构的G-四链体特异性化合物的探索取得了重大进展。四链体选择性配体研究已经从在经典DNA中识别四链体,发展到目前难区分四链体结构的探索。用于四链体复合物体内识别的荧光特异性配体相关研究也遇到了类似的困难。
什么是膳食黄酮类化合物?
黄酮类化合物对人体和生理健康产生了积极的影响。黄酮类化合物是天然存在的多酚类物质,广泛存在于蔬菜、柑橘类水果、种子之中,被人类通过饮食大量摄入。文献中确定的黄酮类化合物数量超过10000种,是第三常见的植物生物活性物质。黄酮类化合物包括异黄酮、花青素、黄酮、黄烷酮、儿茶素和黄酮醇。黄酮类化合物在植物中的主要作用是抵御紫外线和感染,吸引传粉媒介帮助授粉。两个芳香环A和B由含有三个碳原子的C环连接,由黄酮类化合物基本化学成分中的15个碳原子(C6-C3-C6)组成。研究表明,黄酮类化合物可以预防多种疾病,包括心脏病、癌症、神经系统疾病以及其他与年龄相关的疾病。黄酮类化合物具有强大的药理功效和最小的细胞毒性,使其成为传统药物的潜在替代品。
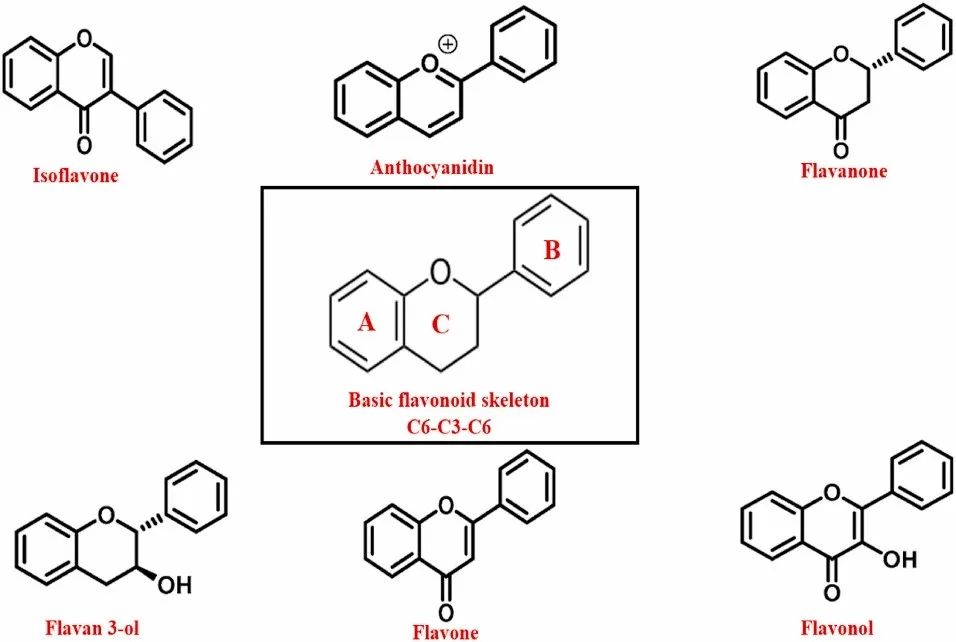
在大多数流行病学调查中,黄酮类化合物和黄酮醇的摄入量与未来的心血管疾病呈负相关,且有一项前瞻性试验表明黄酮醇具有抗癌作用。食物中的黄酮类化合物与糖会偶联为β-糖苷,不可被人体吸收。糖分会影响膳食黄酮类化合物的生物利用度和吸收。膳食黄酮类化合物与G-四链体DNA的相互作用受到相对较少的关注。
G-四链体DNA与膳食黄酮类化合物的相互作用
从控制不同的酶活性到防止细胞增殖,黄酮类化合物具有多种积极的益处,但其潜在过程尚不明确。越来越多的数据表明,黄酮类化合物可能靶向G-四链体结构。木犀草素、芦丁、槲皮素、染料木黄酮、山奈酚、柚皮苷、杨梅素和大豆黄酮都是常见的膳食黄酮类化合物,因其抗转移、抗血管生成和抗增殖活性作用而引起了广泛的研究兴趣。
槲皮素可与人类端粒区域短暂重复产生的单体和二聚G-四链体结构相互作用。槲皮素也因其独特的双色荧光特性,被用于检测G-四链DNA——在含有水溶剂的情况下,游离槲皮素几乎不发出荧光;而当G-四链体DNA和其他目标生物分子结合时,则检测到显著的荧光信号。量子化学分析研究表明,槲皮素与GCGC四链体有效相互作用,具有优异的结构强度和更大的相互作用能。槲皮素通过π-π堆叠接合在5’和3’G-四链体处堆叠并稳定Pu24T G-四链体结构。槲皮素对每个G-四链体结构的结合能因结构而异,或可作为先驱分子靶向多态性端粒G-四链体结构和癌症原癌基因,成为可用于抗癌治疗的天然药物分子。
芦丁是从Styphnolobium Japonicum(L.)中分离的槲皮素糖苷衍生物。虽然芦丁和槲皮素具有相当的G-四链体结合倾向值,但芦丁对G-四链体的偏好优于ds DNA。CID(碰撞诱导解离)实验显示芦丁可更有效地稳定G-四链体结构,分子对接表明堆叠是优选的相互作用类型。计算模型显示芦丁有望通过堆叠相互作用,而堆叠是G-四链体稳定的最有效策略。
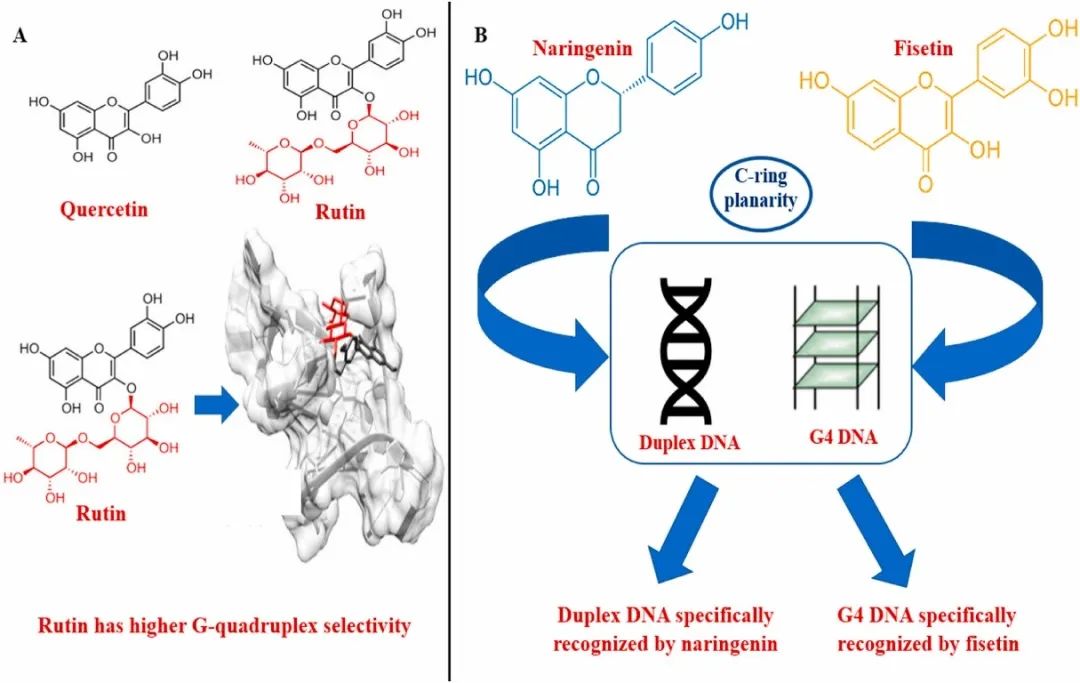
柚皮素和漆黄素是柑橘类水果中发现的膳食黄酮类化合物。柚皮素可以执行多种生物过程,以治疗氧化应激引起的各种炎症性疾病和病理性疾病。漆黄素具有抗凋亡、抗血管生成、抗氧化和抗肿瘤的特性。光谱和计算实验研究探究了这两种结构相关的化合物与平行G-四链体和双链体DNA的生物相互作用。研究表明柚皮素和漆黄素之间的结构差异使它们能够与不同的DNA结构进行不同的相互作用。漆黄素与平行G-四链体结构的结合比双链体DNA的结合更强,而柚皮素对双链体DNA的亲和力高于平行G-四链体DNA。黄酮类化合物结构的C环平面性似乎是黄酮类化合物首选G-四链DNA结合的一个关键因素。
光谱和对接实验研究了桑黄酚和山奈酚这两种结构相似的植物黄酮醇与不同的双链DNA和G-四链DNA序列(c-MYC、h-TELO、c-KIT1、VEGF和c-KIT2)的亲和力。研究结果表明,山奈酚与VEGF G-四链体DNA的相互作用优于双链DNA和其他G-四链序列。山奈酚还提高了VEGF G-四链体DNA的耐热性。桑黄酚与不同的G-四链体DNA和双链DNA的亲和力明显较小。不同的DNA结合行为表明黄酮醇结构中B环的2-OH官能团起着关键作用。山奈酚具有相对平面的形状,但由于额外的2’-OH基团的空间位阻,桑叶蛋白具有相当大的非平面构型。这种微小的结构变化似乎对山奈酚和桑叶蛋白与VEGFG-四链体-DNA结合的能力至关重要。因此,山奈酚或为VEGFG-四链体-DNA的有效配体,可用于调节癌细胞的基因转录。
G-四链体结构与膳食黄酮类化合物相互作用作为未来疾病管理的潜在分子靶点
从癌基因和肿瘤抑制因子的翻译和转录,到端粒稳定性和基因组不稳定性,G-四链体广泛参与了多种生物学活动。膳食黄酮类化合物作为抗增殖和抗肿瘤药物的能力早已被证实,而靶向人类端粒G-四链体DNA或可成为黄酮类化合物抗癌活性的表现。使用纳米结构技术可以提高槲皮素的生物能力,与其他药物联合使用具有协同作用。
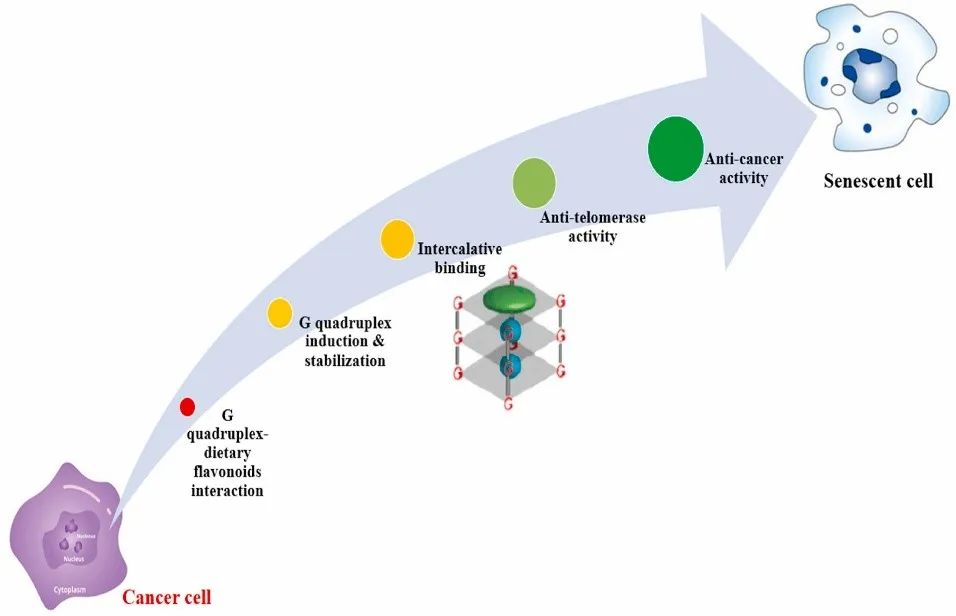
膳食黄酮类化合物可以与DNA结合,影响DNA活性,以实现治疗或疾病预防目标,且具有多模式影响,毒性最小。下图为癌细胞通过G-四链体—膳食黄酮类化合物相互作用转化为衰老细胞的示意图。目前计算机模拟和光谱技术主要用于研究黄酮类化合物的生物物理参数和DNA关联。未来有必要在不同水平上彻底研究膳食黄酮类化合物与DNA的相互作用。
未来相关研究还有很长的路要走。首先,这些配体结合位置的多样性及其对四链体结构影响的差异使确定四链体如何影响生物功能变得困难,即不能确定四链体的稳定性是否有助于促进基因表达。其次,体外稳定性和细胞活性之间的关系并不明显。体外确定的G-四链体靶标可能不是唯一针对细胞的G-四链体。内在细胞变异性也影响体内和体外观察之间相关性。迄今为止确定的大部分配体的另一个问题是它们具有更高的分子量和质子化侧基,或会影响它们的细胞吸收。此外,四链体配体实际使用的主要障碍似乎也与选择性有关。一些四链体配体的选择性模式具有剂量依赖性,必须提前明确靶点。其他可能的障碍包括配体对正常组织的潜在不良影响。必须建立预测的反应指标,以提供定制的抗癌治疗方案。
G-四链体结构与黄酮类化合物相互作用会影响癌症基本过程,有望为癌症治疗和检测提供新的途径。其中两个特定区域的相互作用至关重要:一是可以作为潜在分子靶标的癌细胞中产生的G-四链体结构;二是能够结合、稳定甚至可视化G-四链体复合物的小化合物。研究黄酮类化合物与G-四链体DNA的相互作用及其机制,将有助于开发适当的饮食治疗和癌症治疗辅助药物。为了阐明膳食黄酮类化合物与G-四链体相互作用的潜在机制,需要在蛋白质组和基因组水平上进行更多的研究。展示黄酮类化合物与G-四链体DNA的直接相互作用,可以深入了解膳食黄酮类化合物影响细胞活动的过程,也可以促进理解、预测和管理黄酮类化合物类化合物反应。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Heliyon上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Structural insights and shedding light on preferential interactions of dietary flavonoids with G-quadruplex DNA structures: A new horizon
▌论文网址:
https://www.cell.com/heliyon/fulltext/S2405-8440(23)01166-0
▌DOI:
https://doi.org/10.1016/j.heliyon.2023.e13959
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




