- +1
机器学习联合食管细胞学实现食管鳞癌和胃食管结合部腺癌精准高效筛查
原创 柳叶刀 柳叶刀TheLancet
《柳叶刀-胃肠病学和肝脏病学》(The Lancet Gastroenterology & Hepatology)近日发表海军军医大学长海医院消化内科李兆申院士、王洛伟教授团队的最新研究。该研究基于作者团队首创的新型食管细胞富集装置,应用机器学习算法整合数字化细胞特征和流行病学危险因素,构建并验证了食管鳞癌和胃食管结合部腺癌风险评估工具。该方法操作简便、诊断准确性高,可在漏诊率极低的情况下大幅浓缩高危个体、节约内镜诊疗资源,在食管和胃食管结合部腺癌高发区具有重要推广应用价值。识别文中二维码或点击文末“阅读原文”,了解原文更多内容。
本研究在国际上首次报道了机器学习联合食管细胞学筛查食管鳞癌和胃食管结合部腺癌,并表现出优异的准确性和筛查效率。
2021年1月至2022年6月,来自中国食管癌高发地区39所医院和5个社区的17498名受试者参与本项筛查研究。筛查的主要目标病变为食管/胃食管结合部癌及高级别上皮内瘤变。
研究以内镜和活检病理为金标准,以数字化细胞学特征和流行病学危险因素为预测特征,训练了机器学习模型预测目标病变。在独立测试集中,模型的ROC曲线下面积和平均精度分别可达0.960和0.482,与细胞病理学专家诊断效能相似。
本方法应用于内镜前大范围初筛可减少90.3%的非必要内镜检查,显著提高筛查效率,缓解诊疗资源不足现状。
文章解读
食管癌发病和死亡例数在全球分别排名第七和第六,对人类健康造成严重危害。[1]食管癌主要包括两种病理类型——鳞状细胞癌和腺癌,二者在病理特点和地区分布上具有显著的差异性。食管鳞癌(ESCC)主要发生于食管中上段,是中东亚、东非、拉丁美洲等地区的主要食管癌类型;食管腺癌主要发生于食管下端,在欧美国家占大多数,与贲门癌和近端胃癌合称为胃食管结合部腺癌(AEG)。[2,3]
ESCC和AEG在中国均呈现出严峻的高发态势,2018年中国ESCC和AEG发病例数分别占全球总数的57.5%和60.8%。[2]ESCC和AEG总体五年生存率均不足30%,主要原因在于80%以上的患者在确诊时肿瘤已进展至中晚期。李兆申院士指出,绝大部分ESCC和EAG患者在早期没有明显症状,在出现吞咽困难症状后就诊往往已错过早诊早治机会。因此,在高风险人群中大力推行筛查是实现早期诊断,提高防控效果的必由之路。遗憾的是,目前ESCC/AEG的早期筛查手段十分有限,既无特异性肿瘤标志物,也无特征性影像表现,上消化道内镜检查几乎是唯一可靠的筛查方法。然而,内镜属侵入性检查,无症状人群依从性较差,并且中国内镜诊疗资源配置不足,难以覆盖数以亿计的筛查目标人群。研发一种简便、高效、准确的食管和胃食管结合部癌内镜前初筛手段是当前的瓶颈问题。
王洛伟教授介绍,上个世纪中国食管癌高发区曾开展拉网细胞学筛查,虽然该方法因敏感性和患者接受度不佳等原因目前已较少开展,但仍然给了我们重要的启发。我们团队改良了食管细胞采集器,利用海绵样高分子材料富集食管细胞,并结合液基细胞学制片、全视野玻片图像数字化、人工智能辅助诊断等新技术,将食管脱落细胞学的准确度和患者接受度提升至新台阶。
本研究联合了39所国内医疗机构和5个社区,共纳入17,498名受试者。每名受试者均按标准流程进行流行病学问卷调查、食管细胞学采样和上消化道内镜检查。食管细胞学样本的质控标准为细胞总数大于300万个且存在贲门柱状上皮细胞,采样不符合标准的受试者将进行二次采样。每一例样本在经过严格的质控后制作成30张液基细胞学玻片,并经数字化扫描和处理后上传至研究专用云平台。参考细胞病理医师经验的定量描述,项目团队依托前期训练的细胞识别和分类深度学习算法对每份样本自动提取105个数字化细胞学特征。作者进一步训练了多种机器学习算法,整合105个数字化细胞学特征和15个流行病学特征,以内镜和活检组织病理为金标准,构建了ESCC和AEG筛查风险测评模型。
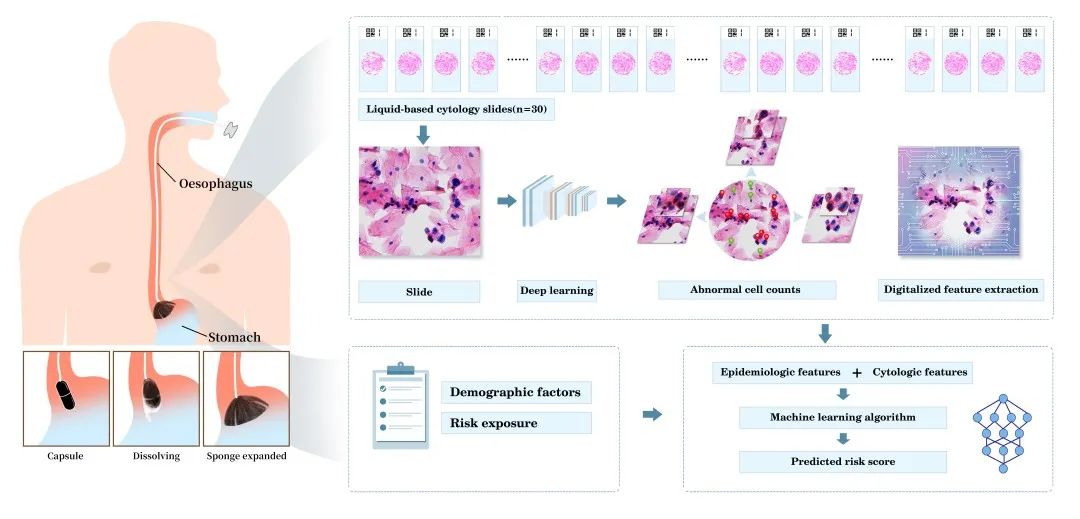
图1. 风险评估模型的构建方法
在独立测试集中,基于LightGBM算法的风险测评模型表现出令人振奋的诊断效能。模型的ROC曲线下面积和平均精度分别为0.960(95%CI,0.937-0.977)和0.482(95% CI,0.470-0.494),与细胞病理学专家达到相似的准确性水平(ROC曲线下面积,0.955;P=0.749;差异0.005,95%CI,-0.011-0.020)。作者根据模型输出的预测风险评分(范围0-1)将受检者定义为低风险(0-0.25)、中风险(0.25-0.5)和高风险组(0.5以上),具有良好的风险分层效果。如果仅推荐模型定义的中高风险人群接受进一步内镜检查,模型敏感性、特异性和预测阳性预测值分别为94.5%(95%CI,88.8%-97.5%)、91.9%(95%CI,91.2%-92.5%)和18.4%(95%CI,15.5%-21.6%),并可节约90.3%的内镜诊疗资源。作者进一步对模型可解释性进行了研究,解析了不同预测特征在模型中的贡献度排名,打破了人工智能预测过程的黑箱,进一步提升了可信度。
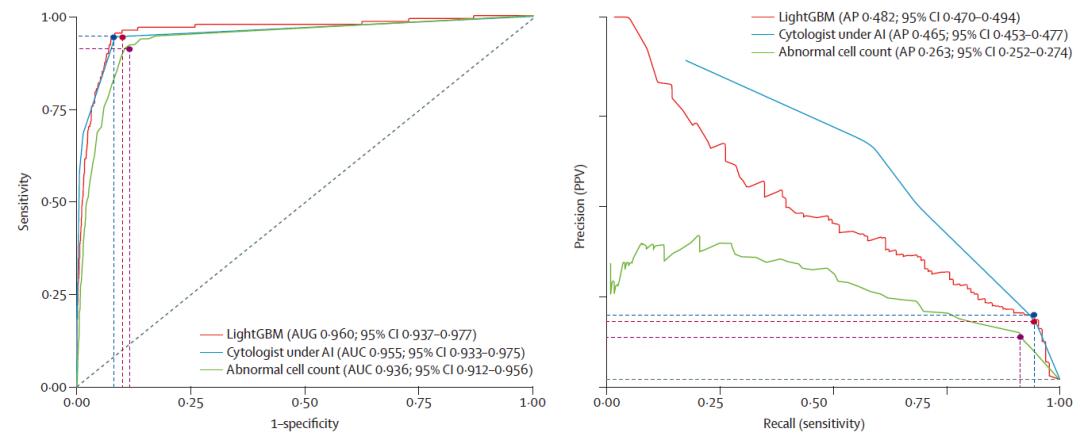
图2. 风险评估模型的诊断效能及与细胞病理医师表现对照
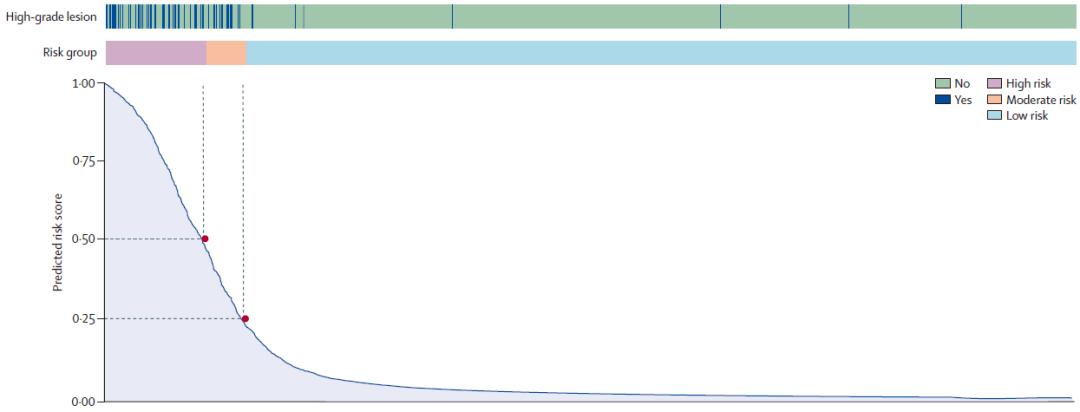
图3. 模型预测风险评分对受检者的风险分层作用
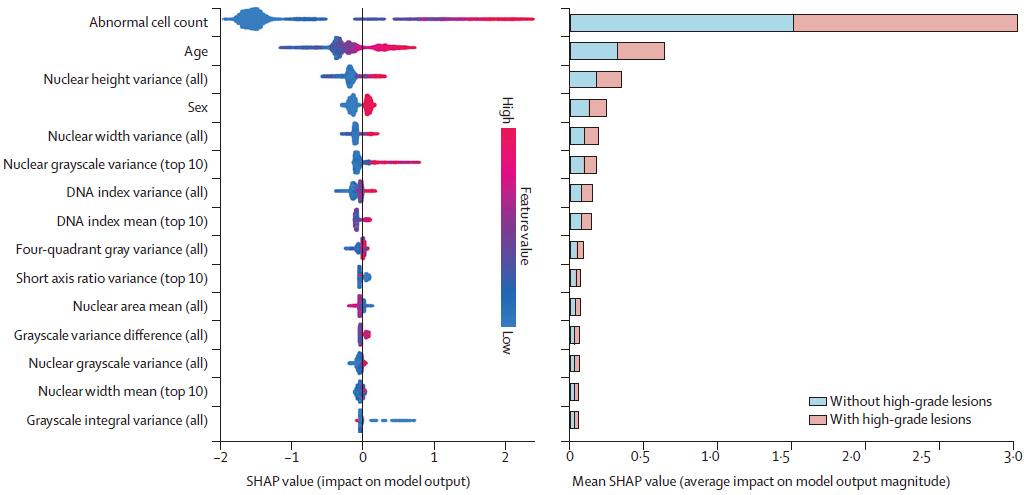
图4. 风险评估模型的可解释性及主要贡献特征排名
本研究的主要局限性在于风险评估模型现阶段做不到准确区分ESCC和AEG,而是将初筛阳性者统一归入“中高风险个体”。ESCC和AEG有许多共同的危险因素,且借助液基细胞形态学准确区分鳞状上皮和腺上皮的异型细胞对于细胞病理专家来说常常也是存在难度的,因此在初筛阶段准确将两者区分是具有挑战性的工作。考虑到上消化道内镜检查是两者的共同确诊方法,作者认为,在初筛阶段浓缩中高风险个体、在后续内镜检查中进一步明确诊断的策略并不影响人群整体筛查获益。在后续研究中,团队将进一步借助深度神经网络、细胞蜡块和分子病理检测等手段,尝试实现对ESCC和AEG的精准区分。
本研究建立并验证了一种可实现食管和胃食管结合部癌高效准确筛查的新方法,在ESCC和AEG的高发地区和高危人群中具有重要的推广应用价值。该方法可实现目标人群大规模初筛,浓缩高危个体,优化筛查中的医疗资源配置效率,助力发现更多早期癌和癌前病变,进而提升中国食管和胃食管结合部癌防控效果。END
作者团队介绍
本研究为海军军医大学长海医院李兆申院士、王洛伟教授带领团队完成。李兆申院士为中国工程院院士,海军军医大学长海医院消化内科主任,主任医师、教授。王洛伟教授为海军军医大学长海医院消化内科副主任,主任医师、教授,主要研究方向为食管癌发病机制和早期诊治、消化内镜质量提升。本研究第一作者为海军军医大学长海医院消化内科高野博士。
参考资料:
1.Sung H Ferlay J Siegel RL et al.
Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries.
CA Cancer J Clin. 2021; 71: 209-249
2.Arnold M Ferlay J van Berge Henegouwen MI Soerjomataram I
Global burden of oesophageal and gastric cancer by histology and subsite in 2018.
Gut. 2020; 69: 1564-1571
3.Abnet CC Arnold M Wei WQ
Epidemiology of esophageal squamous cell carcinoma.
Gastroenterology. 2018; 154: 360-373
*中文解读由作者提供,仅供参考,所有内容以英文原文为准。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




