- +1
【学术前沿】康铁邦/武远众团队揭示阻断KAT8-IRF1凝聚体形成可抑制PD-L1表达并增强抗肿瘤…
肿瘤细胞表达的PD-L1是抗肿瘤免疫监视的主要抑制因子之一【1,2】,肿瘤微环境中伽马干扰素IFNγ可强烈诱导PD-L1表达【3】。PD-L1通过与PD-1结合,抑制T细胞增殖并促进其耗竭【4,5】;在肿瘤细胞内部,PD-L1发挥多种功能促进肿瘤免疫逃逸,如增加肿瘤细胞抵抗干扰素的细胞毒性【6】、增强DNA损伤修复【7】和促进免疫抑制基因的表达【8,9】。临床上,靶向肿瘤PD-L1的免疫治疗在部分肿瘤取得了良好的治疗效果,但仍面临机制不明、响应率低等诸多问题。因此,系统性深入研究PD-L1表达调控机制,有助于开发新的靶向药物,对于肿瘤治疗有重要意义。
生物大分子可通过多价弱相互作用介导的液-液相分离(liquid-liquid phase separation,LLPS,简称相分离)形成生物分子凝聚体(biomolecular condensates),该理论是近年生命科学领域的概念性突破【10,11】。相分离与神经退行性疾病、肿瘤、病毒感染等重大疾病密切相关,靶向相分离过程的疾病治疗是目前生物医学前沿。但目前相分离过程的靶点鉴定、发生机制、与疾病发生发展的关系等研究仍处于起步阶段,亟待深入探索。
2023年3月9日,中山大学肿瘤防治中心康铁邦(中国细胞生物学学会肿瘤细胞生物学分会副会长)/武远众团队在Nature Cancer发表了题为Disrupting the phase separation of KAT8–IRF1 diminishes PD-L1 expression and promotes antitumor immunity的研究成果。该研究揭示了KAT8-IRF1凝聚体促进肿瘤细胞PD-L1表达,开发的特异性多肽可阻断凝聚体形成,增强抗肿瘤免疫。

为深入揭示IFNγ诱导PD-L1表达的调控机制,研究人员利用全基因组CRISPR-Cas9文库进行筛选,发现乙酰转移酶KAT8可调控PD-L1的表达,这一机制在多种肿瘤细胞系中得到验证。KAT8是细胞内组蛋白H4K16ac主要乙酰转移酶,除此之外,KAT8也被报道乙酰化非组蛋白底物,调控细胞自噬、压力应激等过程。接下来,研究人员试图探明KAT8通过何种机制调控PD-L1转录。利用TurboID邻近标记联合质谱分析,研究人员鉴定到转录因子IRF1与KAT8存在相互作用,IRF1是IFNγ通路下游分子之一,已被报道可转录上调PD-L1【3】。
接下来,研究人员探究了KAT8与IRF1如何调控PD-L1。在检测二者定位时,发现共表达mEGFP-KAT8与IRF1-mCherry在细胞核内可形成液滴状凝聚体,该凝聚体具有融合及荧光漂白恢复能力,体外纯化的蛋白也具有相同性质,提示KAT8-IRF1通过液-液相分离形成蛋白凝聚体。进一步,研究人员测定了IFNγ刺激下细胞核内源KAT8与IRF1的蛋白浓度,并在体外实验中观察到生理浓度下的凝聚体形成,同时,研究人员利用SIM超分辨成像,观察到细胞核内存在KAT8-IRF1共定位斑点,提示KAT8-IRF1在生理浓度水平可形成蛋白凝聚体。
接下来,研究人员解析了KAT8-IRF1凝聚体产生的结构基础。首先,IRF1 N端DNA结合结构域与KAT8发生特异性互作,然后发生IRF1 C端的内在无序结构域(Intrinsically disordered region, IDR)与KAT8 N端IDR互作,共同介导凝聚体形成。KAT8-IRF1凝聚体可募集RNAP II-S5P、CDK7、CDK9、BRD4等转录机器组分,并增强转录激活能力。利用dCas9-SunTag-sgARRAY进行基因组定位【12】,研究人员观察到内源KAT8-IRF1凝聚体可定位于PD-L1启动子(图1所示)。
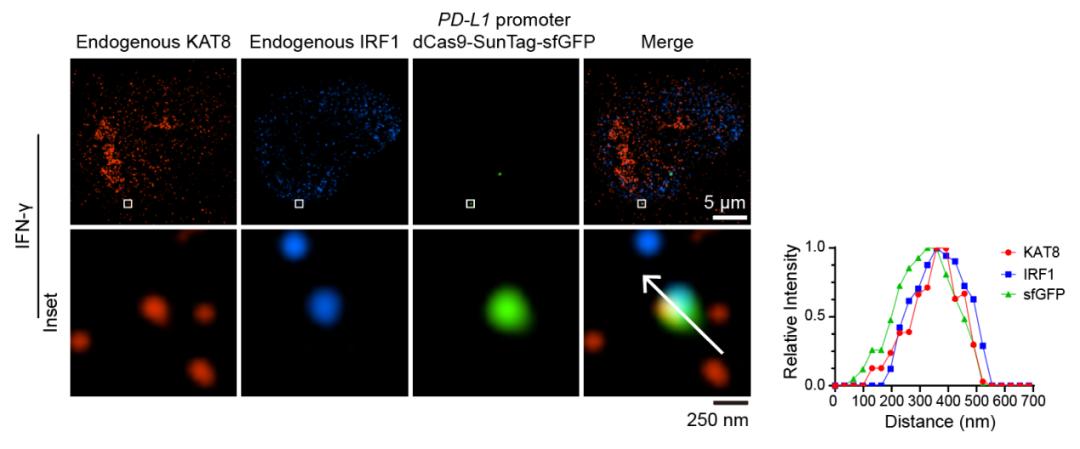
图1. 内源KAT8与IRF1在PD-L1启动子区域形成凝聚体
KAT8已报道可催化非组蛋白底物,研究人员发现KAT8可乙酰化IRF1 K78位点,凝聚体形成可增强催化速率约40倍,IRF1 K78ac可增强与PD-L1启动子结合能力。
根据KAT8-IRF1凝聚体形成的结构基础,研究人员基于IRF1 N端与KAT8的特异性相互作用进行深入分析,发现IRF1的21-42位氨基酸是介导特异性互作的主要区域。进而研究人员合成了该区域的竞争性多肽,并观察到该多肽可特异性阻断二者相互作用并破坏凝聚体形成,抑制IRF1乙酰化及PD-L1转录,增强T细胞的抗肿瘤免疫杀伤。
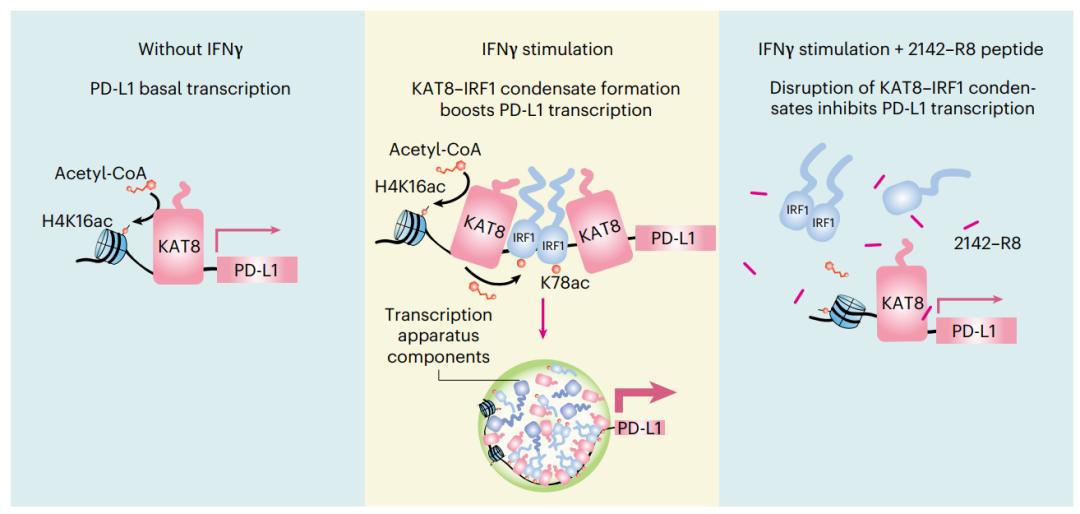
图2:KAT8-IRF1 相分离促进肿瘤细胞 PD-L1表达,阻断该相分离抑制PD-L1, 促进抗肿瘤免疫
综上,该研究揭示了在IFNγ刺激下,肿瘤细胞中KAT8-IRF1通过形成具有促进转录功能的凝聚体,增强PD-L1表达的分子机制;发现了凝聚体形成可增强KAT8对IRF1乙酰化催化速率;开发了抑制凝聚体形成的阻断多肽,并证明其抗肿瘤活性(图2所示)。该研究提示肿瘤相关生物大分子凝聚体可能是一类肿瘤治疗新靶点,值得深入探索。
中山大学肿瘤防治中心武远众副研究员、周立文博士为该论文共同第一作者;中山大学肿瘤防治中心康铁邦教授为通讯作者。
康铁邦教授以通讯作者在Nat Cancer, Nat Cell Biol, Cell Res, J Clin Invest, Nat Commun等国际主流杂志上发表论著50多篇。武远众副研究员为课题组co-PI,以通讯/第一作者发表Nat Cancer, Nucleic Acids Res, Cell Res, Cell Discov, Nat Commun, JBC, Cell Mol Life Sci, STTT等杂志。该课题组长期招聘博士后,欢迎有志者加盟!
原文链接:
https://doi.org/10.1038/s43018-023-00522-1
参考文献
1. Ribas, A. & Wolchok, J.D. Cancer immunotherapy using checkpoint blockade. Science 359, 1350-1355 (2018).
2. Sanmamed, M.F. & Chen, L. A Paradigm Shift in Cancer Immunotherapy: From Enhancement to Normalization. Cell 175, 313-326 (2018).
3. Garcia-Diaz, A. et al. Interferon Receptor Signaling Pathways Regulating PD-L1 and PD-L2 Expression. Cell reports 19, 1189-1201 (2017).
4. Boussiotis, V.A. Molecular and Biochemical Aspects of the PD-1 Checkpoint Pathway. N Engl J Med 375, 1767-1778 (2016).
5. Jiang, Y., Li, Y. & Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis 6, e1792 (2015).
6. Gato-Canas, M. et al. PDL1 Signals through Conserved Sequence Motifs to Overcome Interferon-Mediated Cytotoxicity. Cell Rep 20, 1818-1829 (2017).
7. Tu, X. et al. PD-L1 (B7-H1) Competes with the RNA Exosome to Regulate the DNA Damage Response and Can Be Targeted to Sensitize to Radiation or Chemotherapy. Mol Cell 74, 1215-1226 e1214 (2019).
8. Gao, Y. et al. Acetylation-dependent regulation of PD-L1 nuclear translocation dictates the efficacy of anti-PD-1 immunotherapy. Nat Cell Biol 22, 1064-1075 (2020).
9. Hou, J. et al. PD-L1-mediated gasdermin C expression switches apoptosis to pyroptosis in cancer cells and facilitates tumour necrosis. Nat Cell Biol 22, 1264-1275 (2020).
10. Brangwynne, C.P. et al. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science 324, 1729-1732 (2009).
11. Li, P. et al. Phase transitions in the assembly of multivalent signalling proteins. Nature 483, 336-340 (2012).
12. Shao, S. et al. Multiplexed sgRNA Expression Allows Versatile Single Nonrepetitive DNA Labeling and Endogenous Gene Regulation. ACS Synth Biol 7, 176-186 (2018).
(可上下滑动阅览)
原标题:《【学术前沿】康铁邦/武远众团队揭示阻断KAT8-IRF1凝聚体形成可抑制PD-L1表达并增强抗肿瘤免疫》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




