- +1
这款乳腺癌新药,或使受益人群从20%提高至50%
·Trastuzumab Deruxtecan在2022年5月被中国药监局纳入优先审批行列,距今不到一年就获批。甚至在药监局审批前,2022年2月就落户海南博鳌乐城国际医疗旅游先行区。这次中国获批的还是HER2阳性乳腺癌,但HER2低表达乳腺癌的上市申请也已被药监局受理。我们可以看到近年来很多对患者帮助极大的创新药的轨迹:国内外上市的时间差不断缩短。此外,国内也有大量的抗体偶联药属于研发状态,在技术层面的创新也在与国外逐渐同步。
Trastuzumab Deruxtecan(德曲妥珠)。
2月24日,中国国家药品监督管理局(NMPA)批准了阿斯利康和第一三共联合开发的抗体偶联药物Trastuzumab Deruxtecan(德曲妥珠)在过往治疗耐药的HER2阳性乳腺癌患者中使用。
每年获批上市的新药有很多,但Trastuzumab Deruxtecan绝非一个平平无奇的新药。在2022年6月5日,汇聚全球肿瘤领域精英的美国临床肿瘤学会年会上,它的一个乳腺癌三期临床试验报告获得全场起立鼓掌的特殊待遇。这可以说是极为罕见的殊荣。
Trastuzumab Deruxtecan凭什么获得了这种区别对待?这是因为从医学角度,它重新定义了乳腺癌治疗的格局;从药物研发角度,它代表了抗体偶联这一整个药物技术平台的突破。

2月24日,国家药品监督局管理局发布的药品批准证明文件送达信息截图。
在乳腺癌分类与治疗基石上的超越
乳腺癌是女性最常见的恶性肿瘤。据世界卫生组织统计,2020年全球就有230万女性确诊乳腺癌,死亡人数达68.5万。乳腺癌在中国的发生率、死亡率也一直处于上升状态。在可预见的将来,乳腺癌都会是中国以及全世界极大的健康负担。
不过乳腺癌预后也有了长足进展。美国2010年后的数据显示,相对健康人,乳腺癌患者5年的存活率是90%[3]。能有这么高的存活率,主要贡献因素有两个,一是有效的筛查让更多患者在早期就被确诊,二是针对不同类型乳腺癌有了更多有效的治疗手段。就后者而言,乳腺癌如今分类与治疗上起决定因素的是肿瘤细胞HER2与激素受体(HR)的表达状况。
如果乳腺癌患者肿瘤有HR表达,往往意味着肿瘤细胞的增殖依赖激素,激素阻断可作为治疗手段。而当乳腺癌肿瘤细胞表达HER2时,则可以利用靶向HER2的抗体药来杀死肿瘤细胞。第一个HER2抗体药,也是HER2阳性乳腺癌治疗的基石,就是曲妥珠单抗(Trastuzumab)。
曲妥珠单抗在1992年进入人体试验,到1996年时临床试验已扩展到900人,但由于该药声名在外,迫于社会压力,药企与FDA不得不允许每季度抽签1000名患者在临床试验外获得该药物的使用。自1998年被FDA批准后,它对乳腺癌的治疗、预后都产生了巨大的影响。如果不考虑治疗手段,HER2阳性的乳腺癌相较HER2阴性乳腺癌恶性程度更高,预后也更差。可是曲妥珠单抗上市后,大幅改善了HER2阳性乳腺癌的预后,如今HER2阳性乳腺癌反而成了预后最好的类型。曲妥珠单抗仅原研药如今已惠及的病人超过230万,可以说在乳腺癌甚至整个肿瘤治疗领域都是具有革命意义的创新。
但只有HER2阳性的病人才能从曲妥珠单抗等HER2靶向药中获益,而这只是乳腺癌患者中的一小部分——HER2阳性的乳腺癌患者不到所有病人的20%:
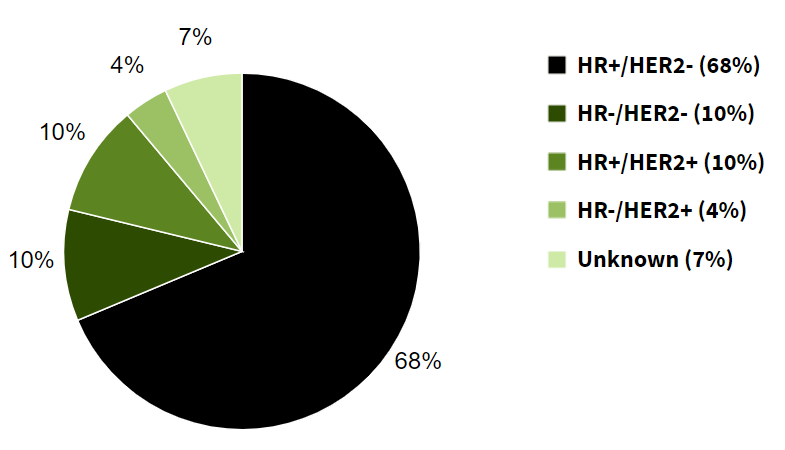
附图1.乳腺癌患者各分型占比(美国2015-2019数据)
绝大多数患者并没有机会从HER2靶向药中获益。特别是三阴性乳腺癌(HR-/HER2-),很多人可能也听说过这类乳腺癌是最麻烦的。确实三阴性乳腺癌适用的治疗药物很少,一旦到了远端转移阶段,5年相对存活率只有12%,远远低于HR+/HER2+的46%与HR-/HER2+的38.8%。
但与一般人的印象不同,HER2阴性不是说癌细胞没有表达HER2,只是说HER2表达的量没有到一个很高的程度。例如目前使用HER2表达鉴定标准,结合了蛋白质表达与基因水平表达。其中蛋白质表达采用IHC技术,只有在0-3分的打分系统里达到3分,或者是2分同时基因表达阳性,才是HER2阳性,否则一律阴性——包括了很多有HER2表达,只是不那么高的情况。
可能有人会好奇,为何如此苛刻,标准放松点,让更多病人用上HER2靶向药不好吗?确实不好。因为试过了,没用。这种没用还不仅是乳腺癌里的问题。听到HER2,大家第一反应都是乳腺癌,其实HER2在别的肿瘤里也是有表达的,为什么没怎么听说呢?因为之前也试过,除了极少数情况外还是没用,这很可能是由于相较乳腺癌,其它肿瘤的HER2表达即使有也低很多。
明明有HER2表达,而且HER2靶向药在HER2阳性患者里还有非常好的疗效,这让科学家与药企们对只能把HER2靶向药用于HER2阳性患者非常不甘心。曲妥珠单抗面世后,很多制药公司都在尝试做一个更好的HER2靶向药。
有的在做一个更好的HER2单抗药。曲妥珠单抗是20世纪90年代的产品,那时候制作抗体药的技术远不如当下先进。曲妥珠单抗对HER2肿瘤的抗癌作用依赖抗体与HER2结合,刺激免疫细胞杀伤被抗体标识出来的癌细胞也是潜在作用机理之一。因此就有药企尝试抗体改造,做一个与HER2结合能力更强,刺激免疫细胞杀伤能力也更强的单抗。
抗体偶联药——换一种思路
另一种思路是抗体偶联药,在HER2抗体上加一个细胞毒性药物(如化疗药物),让细胞毒性药物助力单抗,成为对HER2表达肿瘤杀伤力更强的药物,能克服“HER2表达量不够高”这一拦路虎。
不过以往这些尝试只在解决曲妥珠单抗的耐药性上取得了有限的成功。比如在曲妥珠基础上开发的抗体偶联药物Trastuzumab Emtansine,HER2阳性的患者对曲妥珠耐药后,这个药还能起效。这类进展对患者来说仍然有积极意义,可是没有让更多因HER2表达不够高而没法用HER2靶向药的患者受益。
直到Trastuzumab Deruxtecan这个抗体偶联药横空出世。从名字可知,作为抗体偶联药物,Trastuzumab Deruxtecan靶向HER2的抗体部分还是1998年就上市的曲妥珠单抗,在此之上又加上了细胞毒性药物Deruxtecan。
2019年末,FDA先批准了Trastuzumab Deruxtecan在接受过往HER2靶向治疗后耐药的HER2阳性乳腺癌患者中的使用。在相关的临床试验中,受试者至少接受过两种以及更多HER2靶向治疗后发生耐药。可就在这样的人群里,Trastuzumab Deruxtecan仍然有很好的疗效,总体应答率达到了60.3%。之后在更早期的HER2阳性病人中,Trastuzumab Deruxtecan也展示了比Trastuzumab emtansine更好的疗效,成了曲妥珠耐药后的新标准疗法。
在一系列的惊人成功后,越来越多的人开始相信Trastuzumab Deruxtecan不仅是一个加强版曲妥珠单抗,曾经限制HER2靶向药的种种难题——包括HER2的表达量,或许可以被Trastuzumab Deruxtecan突破。
而在2022年6月5日,一项名为DESTINY-Breast04的临床试验结果在美国临床肿瘤学会年会上公布,在该试验中,HER2阳性这一HER2靶向药的限制因素终于被Trastuzumab Deruxtecan彻底击穿。
DESTINY-Breast04试验中的受试者都是HER2低表达的转移期乳腺癌患者。试验中,采用现今的标准疗法化疗的患者们,肿瘤无进展生存时间是5个月,而Trastuzumab Deruxtecan组直接延长了快一倍,接近10个月。化疗组的总体生存时间是16.8个月,Trastuzumab Deruxtecan组接近两年。
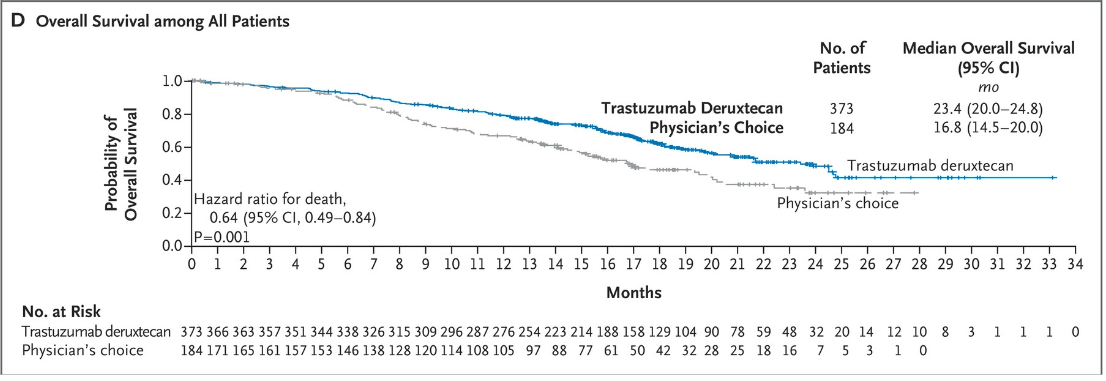
附图2. Trastuzumab Deruxtecan显著延迟了HER2地表达患者的生存时间
这些结果意味着采用Trastuzumab Deruxtecan治疗,患者疾病恶化的风险下降了近一半,生存时间也大幅延长。
这些HER2低表达患者到底是多低的HER2表达呢?从HER2表达的传统鉴定中,DESTINY-Breast04试验中的受试者要么是HER2蛋白表达只有1,或者蛋白表达有2分但基因表达阴性。这些受试者在当下的乳腺癌分类中要么属于HR阳性HER2阴性,要么属于三阴性。90%的受试者接受过至少两线治疗,可以说这是一个经历过多种治疗后耐药,已经没有什么选择的患者群体。该结果可以说是出人意料的好。伴随这一突破性的进展,乳腺癌患者中HER2低表达人群不必再归于HER2阴性,她们是一个新的独立分类,Trastuzumab Deruxtecan将成为她们的新标准疗法。
HER2低表达的乳腺癌患者有多少呢?80%的乳腺癌患者是HER2阴性,但里面超过60%是有HER2表达。也就是说Trastuzumab Deruxtecan让HER2靶向药适用人群从原来的不到20%的HER2阳性人群,一下子增加到了一半以上的乳腺癌患者。
伴随着Trastuzumab Deruxtecan,我们正在见证乳腺癌,这一女性中发病率最高的癌症,从分类与治疗都将发生翻天覆地的变化。也正是因为这样重大的意义,当研究人员公布DESTINY-Breast04试验结果时,即便是见惯了新药试验结果公布的美国临床肿瘤学会年会参与者们也忍不住起立鼓掌致意。
抗体偶联药物终获突破
2022年8月5日,FDA批准了Trastuzumab Deruxtecan在HER2低表达乳腺癌患者中的使用,正式开启了乳腺癌的分类与治疗的变革。可是这一重大革新的背后绝非一帆风顺,Trastuzumab Deruxtecan的技术平台——抗体偶联药物,曾经被寄予厚望,又屡次给出让人失望的结果。可以说,直到Trastuzumab Deruxtecan的出现,抗体偶联药物才获得了真正的“正名”。这也是为什么我们说Trastuzumab Deruxtecan在药物研发方面,代表了一个技术平台的突破。
抗体偶联药物的概念可以追溯到诺贝尔奖得主Paul Ehrlich在1907提出的“神奇子弹”理论——如果可以将一个毒性物质非常专一地递送到病灶处,那么将可以清除病灶而不影响身体其它部分。在抗体偶联药这个技术平台里,我们正是希望利用抗体的特异性,例如只与肿瘤细胞结合的抗体,将毒性药物仅仅送到肿瘤里。
当2001年全球第一个抗体偶联药——用于复发型急性髓细胞白血病的Gemtuzumab Ozogamicin被FDA以加速审批上市批准上市后,制药界对抗体偶联药充满了希望,认为Ehrlich的“神奇子弹”即将通过抗体偶联药在癌症治疗里广泛使用。可接下来迎接抗体偶联药的不是对癌症治疗的变革,而是无数次失望。
研究人员很快就发现抗体偶联药一点都不像Ehrlich提出的只杀病灶不损伤健康组织的“神奇子弹”。很多抗体偶联药的不良反应非常大,甚至都难以在有效剂量与毒性剂量间找到一个治疗窗口。Gemtuzumab Ozogamicin这个抗体偶联药的老大,因为毒性太大又没有在后续试验验证有效性,还在2010年黯然退市,直到2017年换了一个病人群体重新做试验,再降低了剂量才得以回归使用。
为什么会出现如此大的落差?这或许是由于抗体偶联药的复杂性被大大低估了。抗体偶联药的三个组成:抗体、载药(如化疗药物)以及连接二者的链接,制药业曾经认为只要把这三个凑到一起,一个毒药就能被专一地送到肿瘤里,万事大吉。可现实是很少有只在肿瘤里表达的抗原,因此一个靶向肿瘤的“特异性”抗体多少也会跑到健康组织。链接与载药也不是原先预想的简单的化学小分子,而是需要仔细考量其稳定性与作用机理。比如链接的稳定性问题,是必须在细胞内释放载药好,还是不必严格在细胞内只要在肿瘤组织内释放就行,这里面就大有学问。
在抗体偶联药因早期的失望陷入低谷,不少药企纷纷削减投入之际,这一技术平台却开始了卧薪尝胆之旅。拣选抗体与载药,研发不同链接,最终有了以Trastuzumab Deruxtecan为代表的全新一代抗体偶联药。
可以与早期的HER2抗体偶联药Trastuzumab Emtansine对比,后者平均每个抗体分子上只有3.5个细胞毒性药物Emtansine,而Trastuzumab Deruxtecan上每个抗体分子连着8个Deruxtecan。连接Trastuzumab与Deruxtecan的链接是可剪切的,意味着不用进入肿瘤细胞,链接就可以被打破,释放出来的载药Deruxtecan杀伤肿瘤细胞的同时还可能起了刺激周围细胞的作用。Deruxtecan又属于未在乳腺癌中使用过的化疗药物类型,可能带来了与以往乳腺癌治疗不同的新机理。
正是依赖抗体偶联药整个技术平台过去多年来各种细微创新的积累,才有可能在今天出现Trastuzumab Deruxtecan这样一个能以一己之力改变最常见、社会影响与负担最重的癌症之一的治疗方案。
这些累积下来的创新也不会止于HER2低表达乳腺癌这一新划分出来的肿瘤类型。在DESTINY-Breast04试验中,HER2表达最低的蛋白评分为1的患者与评分为2的患者疗效并无区别。这很可能意味着DESTINY-Breast04试验还未触及对Trastuzumab Deruxtecan有反应的HER2表达底线。随着更多更精细的HER2表达检测方法投入运用,或许有更多患者能受益于Trastuzumab Deruxtecan。
2022年12月,FDA根据Trastuzumab Deruxtecan在非小细胞肺癌中的临床试验结果,又有条件批准了它在HER2变异的非小细胞肺癌患者中的使用。从HER2靶向药的角度看,Trastuzumab Deruxtecan正在实现只要有HER2表达,不论高低,不论癌症,都有希望治疗的靶点潜力彻底挖掘。而这又是在实现制药界长期以来对抗体偶联药的期望:1+1>2,通过抗体偶联的平台,获得单独的抗体药或偶联的细胞毒性药,都无法做到的治疗效果。
Trastuzumab Deruxtecan的成功,也催生了抗体偶联药物的大热。诸多新一代抗体偶联药物进入验证,乃至进入市场。在一些偶联药物里,连接的不再只是化学毒性物质,例如免疫刺激药物、放疗药物都有尝试。当然我们很难预测这些药物是否会成功,可能不少抗体偶联药会以失败告终。但随着技术的积累,我们或许会看到越来越多的患者获益于这些潜在的创新药。而假如若干年后,我们回顾抗体偶联药的发展史,Trastuzumab Deruxtecan很可能就是这一技术平台的转折点。
多方位创新让有效药更快与患者见面
除了技术层面的创新,同样值得注意的是Trastuzumab Deruxtecan在HER2低表达人群的获批从药企递交申请到FDA批准只用了不到两周的时间,距离相关试验结果公布也不过两个月。这比FDA原定批准时间早了近4个月的提速,背后是药物监管方面的创新。
FDA对Trastuzumab Deruxtecan的审核采用了实时肿瘤药物审核(Real-Time Oncology Review ,RTOR)与Orbis计划。RTOR意味着研发方可以将有效性与安全性数据更早递交到FDA,让药品审核更早开始。Oribis计划则是让国家上多个药品监管部门合作,协同对药品的审核过程,在很多药物的临床试验进入国际化的当下,加速数据的审核与一个药品在全球的上市。
各方面的创新意味着我们看到越来越多的创新药以越来越快的速度上市。曲妥珠单抗最早的临床试验是在1992年,即使采用了加速审批,也是在1998年才被FDA批准。而Trastuzumab Deruxtecan第一个临床试验是在2015年,2019年就获得第一个适应症批准,如今更是以惊人的速度扩展适用人群。
这些创新在中国发生。曲妥珠单抗原研药2002年批准在中国上市,2017年才进入医保目录。而Trastuzumab Deruxtecan在2022年5月就被中国药监局纳入优先审批行列,距今不到一年就获批。甚至在药监局审批前,2022年2月就落户海南博鳌乐城国际医疗旅游先行区。这次中国获批的还是HER2阳性乳腺癌,但HER2低表达乳腺癌的上市申请也已被药监局受理。从Trastuzumab Deruxtecan上,我们可以看到近年来很多对患者帮助极大的创新药的轨迹:国内外上市的时间差不断缩短。此外,国内也有大量的抗体偶联药属于研发状态,在技术层面的创新也在与国外逐渐同步。
乳腺癌仍然是全球最常见、致死人数最多的癌症之一,而癌症又是全球最致命的疾病类型之一,每6例死亡中就有1例是癌症导致。但我们仍希望如同Trastuzumab Deruxtecan正在书写的乳腺癌治疗革新,各个层面的创新综合在一起,可以让癌症对我们的威胁,对社会的负担不断下降。
(作者周叶斌,系美国阿拉巴马大学伯明翰分校遗传性博士,长期从事免疫学研究,目前在药企从事新药研发。)
参考资料:
1.https://www.who.int/news-room/fact-sheets/detail/breast-cancer
2.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8330522/
3.https://www.cancer.org/cancer/breast-cancer/understanding-a-breast-cancer-diagnosis/breast-cancer-survival-rates.html
4.https://www.mdpi.com/2072-6694/12/8/2081
5.https://www.herceptin.com/hcp/indications.html
6.https://seer.cancer.gov/statfacts/html/breast-subtypes.html
7.https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-option-patients-her2-positive-breast-cancer-who-have-progressed-available
8.https://www.nejm.org/doi/full/10.1056/NEJMoa2203690?query=featured_home
9.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-fam-trastuzumab-deruxtecan-nxki-her2-low-breast-cancer
10.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-gemtuzumab-ozogamicin-cd33-positive-aml
11.https://www.nature.com/articles/s41591-022-01935-8
12.https://www.himd.com/article/r_191_94.html
13.https://www.pharmcube.com/index/news/article/9531
14.https://www.who.int/news-room/fact-sheets/detail/cancer





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




