- +1
追问|他治癌症时顺便治了艾滋病,异体造血干细胞移植靠谱吗?
•中国医学科学院血液病医院(血液学研究所)院长程涛教授向澎湃科技表示,这几例病例更像是在治疗癌症的过程中,顺便治疗了艾滋病,但他们共同验证了关闭HIV入侵细胞的“入口”——CCR5受体,人体可能就不会再感染HIV的思路,沿着这一思路,可能发展出潜在的HIV感染疗法。
•“这几个病人是不得已才选择别人的造血干细胞来进行移植,假设未来病人可以使用自己的造血干细胞,通过基因编辑下调CCR5后再回输,理论上讲,也可能会产生HIV抗性。”
艾滋病(AIDS),全称是获得性免疫缺陷综合征,由感染HIV病毒引起。HIV是一种可以攻击人体免疫系统的病毒,它进入人体潜伏数年后,会导致HIV感染者发展成艾滋病病人,使其丧失免疫功能,抵抗力极度下降,出现多种感染,甚至死亡。自首例艾滋病病例被记录以来,40年的时间里,人类为实现艾滋病的治愈做了许多尝试,但几乎所有策略都失败了。
当地时间2月20日,德国杜塞尔多夫大学(Heinrich-Heine-Universität Düsseldorf)医院比约恩·埃里克·奥勒·简森(Björn-Erik Ole Jensen)团队在《自然-医学》(Nature Medicine)发表了一篇通讯文章(Brief Communication),报道了一名获得异体造血干细胞移植(HSCT)以治疗白血病的患者,在移植后9年、暂停抗逆转录病毒治疗的4年里,表现出对1型人类后天免疫缺乏病毒(HIV-1)的持续抑制。简森团队表示,HSCT仍是一种高风险疗法,目前仅适用于一些同时患有HIV-1和血液癌症的患者,但这些结果或能为未来实现长期缓解HIV-1的策略提供信息。

论文截图。
异体造血干细胞移植(HSCT)包括骨髓移植、外周血干细胞移植和脐带血干细胞移植等,它是一种治疗特定癌症如白血病等的疗法,通过移植捐赠者未成熟的血细胞,使接收者的骨髓重新增殖。CCR5Δ32/Δ32 异体造血干细胞移植指从携带CCR5Δ32/Δ32的捐赠者那里移植细胞,CCR5Δ32/Δ32是指CCR5等位基因编码区域第185位氨基酸密码子以后发生了32个碱基缺失,阻止CCR5的表达,而CCR5是HIV-1入侵人体的辅助受体(co-rececptor),HIV-1通过与CCR5受体结合而进入细胞。
理论上讲,对于感染HIV病毒和白血病的患者,可以首先通过化疗杀死癌细胞,再进行CCR5Δ32/Δ32异体造血干细胞移植,通过这一方式,有可能治愈白血病,同时让患者体内的HIV病毒无法感染,从而逐渐清除HIV病毒,实现HIV感染的长期缓解,乃至治愈。
在此次报道的“杜塞尔多夫病人”之前,全球已有4例被公开报道的、通过异体造血干细胞移植方式实现HIV感染长期缓解的患者。
异体造血干细胞移植会成为治愈艾滋病的希望吗?2月18日,中国医学科学院血液病医院(血液学研究所)院长程涛教授向澎湃科技表示,这几例病例更像是在治疗癌症的过程中,顺便治疗了艾滋病,但他们共同验证了一个思路:关闭HIV入侵细胞的“入口”——CCR5受体,人体可能就不会再感染HIV,沿着这一思路,可能发展出潜在的HIV感染疗法。
对“杜塞尔多夫病人”的详细纵向分析
简森团队提对一名移植CCR5Δ32/Δ32异体造血干细胞之后,白血病和可检测的HIV-1均出现缓解的病人的血液和组织样本进行了详细的纵向病毒学和深入的免疫学分析。该患者为53岁的男性,2008年1月,他被诊断为HIV-1感染,2010年10月,他开始使用多种抗病毒药物联合治疗的(ART)方案,治疗后血浆中HIV-1病毒载量持续受到抑制。2011年1月,这名患者又被诊断为急性骨髓性白血病(AML),2013年2月,他接受了一位女性捐赠者的CCR5Δ32/Δ32干细胞移植,其后进行了化疗和供者淋巴细胞输注。移植后,抗逆转录病毒疗法仍在继续,但患者血细胞中已无法检测到前病毒HIV-1。
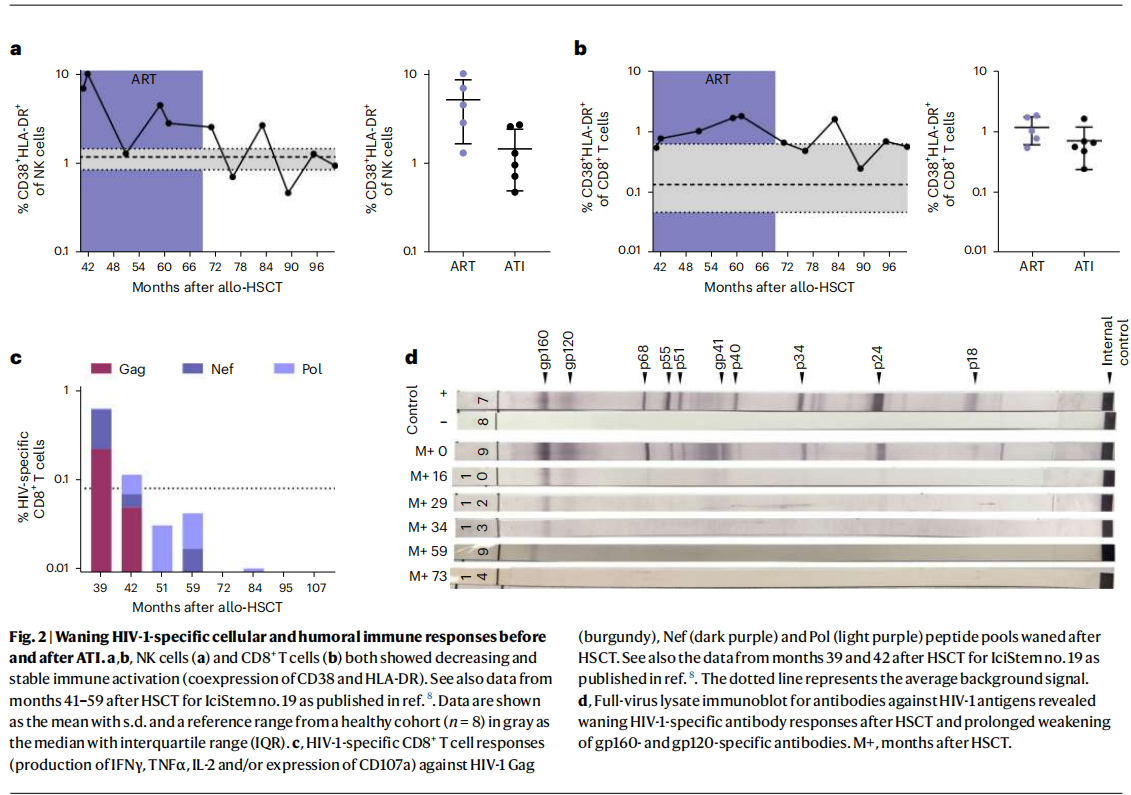
ATI前后患者的HIV-1特异性细胞和体液免疫反应。图片来源:文章截图
要证明该患者的HIV-1是否得到了治愈,停止抗逆转录治疗(ATI)被认为是唯一的方法。患者干细胞移植近6年(69个月)之后,经患者知情同意,他的抗逆转录治疗在2018年11月暂停。经过4年的跟踪监测,简森团队微弱地检测到HIV-1 DNA的痕迹,但没有观察到HIV-1 RNA反弹,或对HIV-1蛋白的免疫反应激增,这可能意味着在患者停止抗逆转录病毒治疗4年后,出现了持续存在但无法检测到的病毒潜伏库。
简森团队在文中表示,“对HSCT后HIV-1治愈的单个病例的详细观察特征提供了重要的见解,但这本质上是一则轶事,缺乏对照前瞻性研究的力量。因此,迄今为止发表的病例的某些方面与HIV-1治愈的相关性不确定。例如,潜在的恶性血液病、预处理方案或移植物抗宿主病(GVHD)的程度以及供体-受体性别不匹配或ATI的时间。”
简森团队报道的这名“杜塞尔多夫病人”并非干细胞移植“治愈”HIV的个案。此前,已有4例HIV被“治愈”的报道,分别是: “柏林病人”蒂莫西·雷·布朗(Timothy Ray Brown),他是世界上首个被彻底治愈的艾滋病患者,不幸的是,他于2020年因癌症复发而逝世;2020年被报道的“伦敦病人”亚当·卡斯蒂列霍(Adam Castillejo),他同时患有艾滋病和霍奇金淋巴瘤;2022年2月被报告的“纽约病人”,她是一位64岁的女性,也被认为是世界上首例通过脐带血干细胞移植而治愈的女性艾滋病患者;以及2022年7月由美国希望之城(City of Hope)的研究团队报告的一名66岁的美国男性,被称为“希望之城病人”。其中,“柏林病人”和“伦敦病人”的情况已在医学文献中详述,“纽约病人”和“希望之城病人”则是在医学会议上报告的,尚未经医学期刊发表。
实际上,此次报道的“杜塞尔多夫病人”,曾在2019年时被报道认为大有“治愈”的希望,只是此后关于他的进一步消息很少见。
抑制CCR5可能是治愈HIV的一种思路
可以发现,前述几例HIV病毒得到长期缓解的病例,都是通过CCR5Δ32/Δ32 异体造血干细胞移植,抑制CCR5受体的方法来实现的。这让人们不禁期待:异体造血干细胞移植是否有望成为治愈艾滋病的疗法?
实际上,“纽约病人”出现后,人们就曾对异体造血干细胞移植寄予厚望。但当时就有多位专家认为,这一疗法难以大规模普及。据美国全国广播公司(NBC)2022年2月16日报道,美国约翰霍普金斯大学(Johns Hopkins University)医学院的儿科传染病专家黛博拉·佩尔绍德(Deborah Persaud)博士表示,“我们对可能治愈艾滋病毒的新病例感到非常兴奋,但干细胞治疗方法仍然只适用于数百万HIV感染者中的少数人,不是一个通用的疗法。”
从原理上讲,携带CCR5Δ32/Δ32的人数极少。前述NBC报道称,有统计表明,CCR5Δ32在欧洲人中的频率约为10%,非洲人中为零,亚洲仅少量分布,中国鲜有发现。
另一方面,异体造血干细胞移植并不是一种低风险的疗法。“因为植入的是别人的细胞,移植前需要进行强烈的化/放疗预处理及强烈的免疫抑制治疗,可能会造成重要脏器功能损伤及发生严重感染而危及生命,此外,异基因造血干细胞移植还会发生免疫反应,比如严重急性移植物抗宿主病(GVHD)及广泛型慢性GVHD,但对HIV感染者来说,也容易继发各种病原微生物感染,严重者也会危及患者生命。”程涛教授对澎湃科技说。
亦有专家强调,如果是针对没有潜在致命癌症或其他高危因素的HIV感染者,试图通过干细胞移植来治愈艾滋病得不偿失。
不过,CCR5受体或许是一条突破的路径。程涛表示,“这几个病例可以验证这一思路:抑制HIV进入细胞的辅助受体CCR5,人体就不再感染HIV了。”沿着这一思路,有可能发展出新的艾滋病疗法。
例如结合基因编辑技术。2019年9月,北京大学-清华大学生命科学联合中心邓宏魁研究组、已故的解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组曾合作在《新英格兰医学杂志》(NEJM)发表论文,报道了使用CRISPR/Cas9技术编辑造血干细胞中的CCR5后进行移植的方法,用于一名同时患有艾滋病和急性淋巴细胞白血病的27岁男性,尽管研究中的编辑效率不高,但这项研究初步证实了基因编辑的成体造血干细胞移植的安全性和可行性。邓宏魁教授团队也是20世纪90年代发现CCR5在HIV中重要性的团队之一。
“这几个病人是不得已才选择别人的造血干细胞来进行移植,假设未来病人可以使用自己的造血干细胞,通过基因编辑下调CCR5后再回输,理论上讲,也可能会产生HIV抗性。”程涛说。
参考资料:https://doi.org/10.1038/s41591-023-02213-x





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




