- +1
【科学普及】植物不同组织之间的对话
原创 胡一龙 余斌等 细胞世界

作者:胡一龙 余斌 侯兴亮

导语:在漫长的进化过程中,随着对陆地环境的逐步适应,高等植物形成了独特而复杂的形态结构和生理特性,一般具有根、茎、叶的分化。根是植物分布于地下的营养器官,负责吸收土壤中的水分、无机盐和小分子有机质等,能够感知土壤中的水分及营养条件,同时也将植物固着在生长基质中,使之无法移动。叶通过光合作用合成有机物,伴有蒸腾作用,为根系的吸收功能提供动力。叶也是植物体感知环境的重要器官,能够识别光照、温度、湿度、生物及非生物胁迫等外界条件,启动相应的适应性机制,以协调植物的生长发育。茎是连接根和叶的支持器官,含有植物体内最重要的长距离输导组织,负责根与叶之间水分、养分及信号物质的传递。除了长距离的信号交流,局部组织或细胞之间也存在信号分子的交换。那么植物不同组织之间是如何交流的呢?他们交流的语言是什么?科学家们窃听到了哪些?“没有眼睛,却洞悉万象;没有大脑,但运筹帷幄”遍布天涯海角,撑起地球蓬勃生机的植物,沉静的外表下有怎样不为人知的智慧与抗争。本文将从不同组织间的信息交流这一角度来试图一览植物的生存智慧。
从种子萌发开始,植物的生命周期经历了根、茎、叶、花、种子、果实等组织器官的分化与发育。植物以固着方式生长,在整个生命周期中会遇到各种有利和有害的环境变化。植物可通过不同的部位感知各种环境变化信号,并传递到特定的组织,以协调、平衡和优化生长发育与逆境抗性。传统的研究大多数是针对单个植物组织去研究植物发育生物学问题,或者以植物整体的角度去研究其对环境的响应。近年来,科学家逐渐开始从对单一器官或组织的审视过渡到不同组织器官之间信息交流的研究,并取得了一些突破性的发现。本文介绍了一些植物在生长发育及环境适应过程中各组织之间的信号交流模式的经典例子。

1.成花素的长距离运输
关于不同组织之间信息交流的分子基础,最经典的研究之一就是成花素的发现。早在19世纪,人们就观察到植物能够通过叶片感知光信号诱导开花:将紫花牵牛和旱金莲的叶片暴露于光下,茎顶端遮光,植物可以正常开花;反之植物则不能开花。这表明在光照刺激下叶片中产生了某种成花诱导因子,作用于茎顶端并促进开花。20世纪初,研究者通过嫁接将五株苍耳串连在一起,全部培养在不诱导开花的条件下,只对其中一棵植株的一片叶子进行适宜的光照诱导,便可使所有植株开花。甚至不同种的植物之间的嫁接都会产生这种同步开花的现象。这些发现使科学家坚信植物能够感知环境变化产生一种能够移动的信号分子促进植物开花,并在在1937年首次把它命名为成花素(florigen)。随后的几十年,人们满怀热情地花费大量精力试图找到这个物质,但最后都以失败告终。随着遗传学和分子生物学的手段被引入,在1983年人们发现一个名为FLOWERING LOCUS T(FT)蛋白的功能缺失会引起植物晚花,但当时并不知道它就是成花素。之后经过二十余年的深入研究,科学家终于揭开了成花素的神秘面纱:植物叶片感知环境及内在变化,产生FT蛋白作为长距离信号从叶片维管组织经韧皮部移动到茎顶端分生组织,并促进花芽的分化与发育[1,2],从而诱导开花。
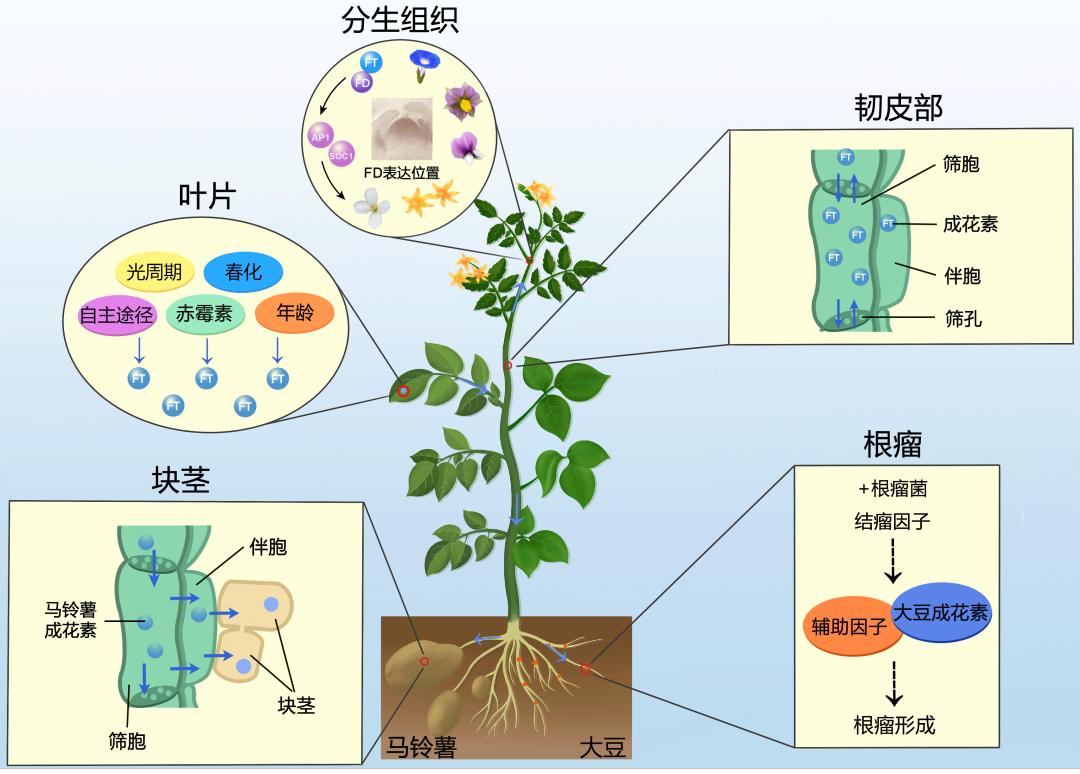
图1. 成花素FT的长距离运输
近年来,科学家们陆续发现成花素FT的作用不止于调控开花,也能从叶片移动到其它组织,调控多个植物发育过程。在马铃薯中,FT同源蛋白可以感知环境变化从地上运输到地下部,诱导块茎的膨大[3]。而大豆中的FT受光诱导后从地上移动到地下,诱导根瘤形成[4,5]。这些发现深刻体现了FT作为一个长距离移动信号在植物营养和生殖发育中的重要地位。
2.环境适应中的信号交流
植物以固着的方式生长,无法自主移动趋利避害,需要应对多种不利环境,包括生物胁迫(食草动物啃食、病原体侵染等)和非生物胁迫(干旱、高温、高光、高盐、重金属毒害等)。在长期的适应过程中,植物形成了独特而复杂的逆境响应机制。目前,人们对植物在各种胁迫环境下的响应模式和调控机制已有相对清晰的认识,但从植株整体出发,植物各组织之间如何交换信息、协调响应尚不清楚。一些较为分散的研究表明,小肽、植物激素、特殊化合物、金属离子等多种物质可作为植物不同组织之间的信息交流介质。下面以干旱环境下小肽CLE25的长距离运输为例对植物在逆境响应过程中的协调反应进行阐述。
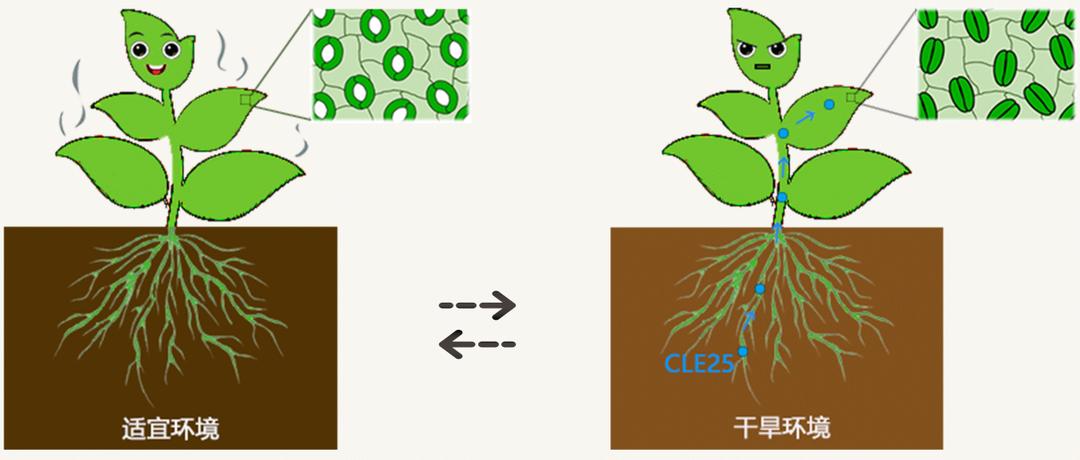
图2. 地下的多肽CLE25告诉地上缺水
在正常生长状态下,植物地上部的绿色组织通过光合作用固定二氧化碳形成有机物,以供机体生长发育。遍布植物表皮的气孔,是植物重要的气体交换通道,在叶、茎中负责二氧化碳的吸入。同时,大量水分通过气孔蒸腾而出,这为根系吸收水分和养分提供了原始动力。但在干旱环境下,这种蒸腾作用会使植物迅速脱水死亡。植物激素脱落酸(ABA)是重要的逆境响应激素,在干旱等胁迫环境下含量上升,进而诱导叶片气孔关闭,以减少水分丧失。作为吸收水分的重要器官,植物根系是最先感应到缺水信号的,那么它将如何把这个生死攸关的情报传递给地上部并启动其防御机制呢?
除了传统意义上的植物激素外,有一类植物生长调节因子被称为多肽激素。多肽是由10–100个氨基酸分子脱水缩合而成的化合物,也是蛋白质水解的中间产物。迄今为止,已有1200多种多肽激素被鉴定,它们广泛参与植物生长发育的各个过程和多种生物及非生物胁迫响应。并且,这类小分子物质很容易在体内进行长距离运输,是植物各组织之间的“理想信使”。植物的根系能否利用某种多肽作为信号物质向地上部传递消息?经过一系列筛选及验证,研究者发现根系中的多肽CLE25在干旱胁迫下被诱导表达,之后经由维管束组织长距离移动至叶片。在叶片中,CLE25诱导ABA合成,进而启动叶片的脱水响应模式,关闭气孔,防止水分流失。
依赖这种小分子物质和植株本身的输导组织,植物无需耗费过多营养,即可将局部环境信号扩散至各个组织,引发全株的协调响应。
3.生殖发育中的信号交流
植物受精过程中的信息交流也受到很大的关注,科学家们窃听到了很多关于“植物怀孕”期间的秘密,花粉管与雌体组织的关键信号交流模式被解析。被子植物的有性生殖包括以下几个关键过程:(1)花粉与柱头的相互识别和萌发;(2)花粉管的极性生长;(3)花粉管爆裂并释放精细胞;(4)雌雄配子融合。在雄性及雌性生殖组织相互识别和交流过程中,多肽及仅由2–10个氨基酸构成的小肽扮演着重要的信使角色。
当花粉落在柱头上后,花粉可释放一个小肽PCP-Bs,与柱头上的受体结合,诱发一系列下游响应,进而促进花粉水合[17](图3a)。之后,花粉管萌发并在花粉管通道中向下延伸。与此同时,胚珠释放出多种作用于吸引花粉管的小肽信号(PT attractants from SCs)。花粉管在其指引下转变延伸方向,穿出花柱道朝向胚珠生长(图3b)。当花粉管抵近胚囊时,胚珠分泌的小肽RALF34与花粉管上的受体复合物结合,促使花粉管爆炸,释放精细胞[19](图3c)。受精后,胚珠释放的花粉管吸引多肽LURE1被来自卵细胞的内肽酶特异性降解,以阻止其他花粉管的靠近,避免多精受精[20](图3d)。这些花粉与柱头相互识别、花粉管与胚囊的小肽-受体激酶信号交流模式以及精卵细胞互作的分泌蛋白酶-小肽信号交流模式使植物能精准高效地完成受精这一关键的生殖阶段。
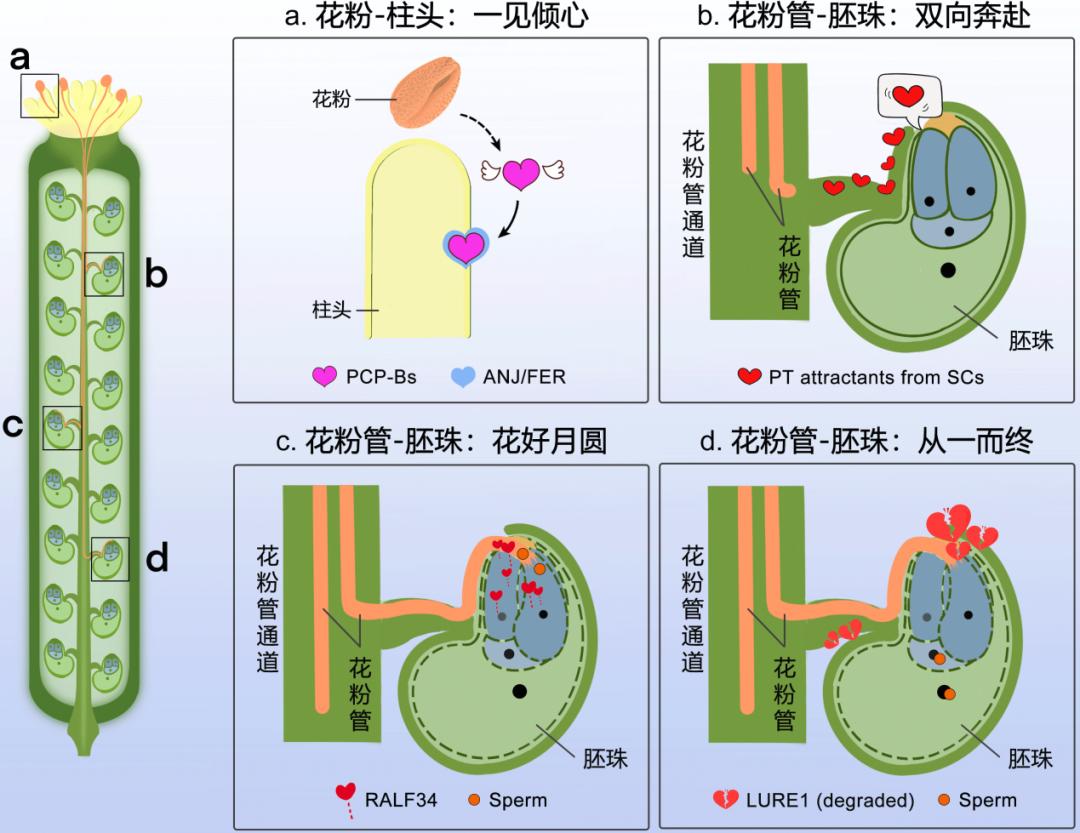
图3. 受精过程中的信息交流
受精后,源自种子的生长素信号诱导赤霉素的生物合成,从而刺激果实生长[21]。在成熟期,种子本身也可能向果实母体组织提供信号,表明胚胎发育完全,启动种子释放等程序[22]。在种子及果实发育过程中,必然涉及到种子和果实、胚乳与胚胎、母体组织与后代组织之间源库能量转移的信息交流。然而目前为止,对于这些重要过程信息交流的关键信号分子尚缺少突破性的发现。
展望

因此,植物不同组织之间信息交流是普遍存在的,这些信号分子可能是小肽、植物激素、特殊化合物、金属离子等各种物质,如何精准筛选鉴定这些信号分子是回答植物如何协调生长发育这一重要科学问题的难点和挑战,未来研究应该建立一套科学的研究体系针对此类科学问题进行系统的研究。
对植物不同组织之间信息交流的分子基础进行解析,将开辟植物学研究的新方向,实现从关注植物整体或某植物组织器官生长发育的单一模式过渡到注重不同组织器官协调生长发育的系统研究模式,促进人们对于植物生命奥秘的理解。此外,阐明植物不同组织之间信息交流的分子基础将有助于精准与智慧农业的发展,包括但不仅限于打破生殖隔离创造新物种,优化植株不同组织的资源分配的分子设计育种,改良作物环境适应性,基于信号分子开发新型、高效、绿色的植物生长调节剂等。

参考文献:
[1] Corbesier L, Vincent C, Jang S, et al. FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis[J]. Science, 2007, 316(5827): 1030-1033.
[2] Tamaki S, Matsuo S, Wong H L, et al. Hd3a protein is a mobile flowering signal in rice[J]. Science, 2007, 316(5827): 1033-1036.
[3] Navarro C, Abelenda J A, Cruz-Oró E, et al. Control of flowering and storage organ formation in potato by FLOWERING LOCUS T[J]. Nature, 2011, 478(7367): 119-122.
[4] Wang T, Guo J, Peng Y, et al. Light-induced mobile factors from shoots regulate rhizobium-triggered soybean root nodulation[J]. Science, 2021, 374(6563): 65-71.
[5] Li X, Zhou H, Cheng L, et al. Shoot-to-root translocated GmNN1/FT2a triggers nodulation and regulates soybean nitrogen nutrition[J]. PLoS Biology, 2022, 20:e3001739.
[6] Tabata R, Sumida K, Yoshii T, et al. Perception of root-derived peptides by shoot LRR-RKs mediates systemic N-demand signaling[J]. Science, 2014, 346: 343-346.
[7] Ohkubo Y, Tanaka M, Tabata R, et al. Shoot-to-root mobile polypeptides involved in systemic regulation of nitrogen acquisition[J]. Nature Plants, 2017, 3: 17029.
[8] Ota R, Ohkubo Y, Yamashita Y, et al. Shoot-to-root mobile CEPD-like 2 integrates shoot nitrogen status to systemically regulate nitrate uptake in Arabidopsis[J]. Nature Communications, 2020, 11: 641.
[9] Tsikou D, Yan Z, Holt D B, et al. Systemic control of legume susceptibility to rhizobial infection by a mobile microRNA[J]. Science, 2018, 362(6411): 233-236.
[10] Okamoto, S, Shinohara, H, Mori, T, et al. Root-derived CLE glycopeptides control nodulation by direct binding to HAR1 receptor kinase[J]. Nature Communications, 2013, 4: 2191.
[11] Takei K, Sakakibara H, Taniguchi M, et al. Nitrogen-dependent accumulation of cytokinins in root and the translocation to leaf: Implication of cytokinin species that induces gene expression of maize response regulator[J]. Plant & Cell Physiology, 2001, 42: 85-93.
[12] Chen X, Yao Q, Gao X, et al. Shoot-to-Root mobile transcription factor HY5 coordinates plant carbon and nitrogen acquisition[J]. Current Biology, 2016, 26: 640-646.
[13] Brodribb T J and McAdam S A. Passive origins of stomatal control in vascular plants[J]. Science, 2011, 331: 582-585.
[14] Takahashi F, Suzuki T, Osakabe Y, et al. A small peptide modulates stomatal control via abscisic acid in long-distance signalling[J]. Nature, 2018, 556(7700): 235-238.
[15] Devireddy A R and Zandalinas S I. Coordinating the overall stomatal response of plants: Rapid leaf-to-leaf communication during light stress[J]. Science Signaling, 2018, 11.
[16] Toyota M, Spencer D, Sawai-Toyota S, et al. Glutamate triggers long-distance, calcium-based plant defense signaling[J]. Science, 2018, 361(6407): 1112-1115.
[17] Liu C, Shen L, Xiao Y, et al. Pollen PCP-B peptides unlock a stigma peptide–receptor kinase gating mechanism for pollination[J]. Science, 2021, 372(6538): 171-175.
[18] Zhong S, Li L, Wang Z, et al. RALF peptide signaling controls the polytubey block in Arabidopsis[J]. Science, 2022, 375(6578): 290-296.
[19] Ge Z, Bergonci T, Zhao Y, et al. Arabidopsis pollen tube integrity and sperm release are regulated by RALF-mediated signaling[J]. Science, 2017, 358(6370): 1596-1600.
[20] Yu X, Zhang X, Zhao P, et al. Fertilized egg cells secrete endopeptidases to avoid polytubey[J]. Nature, 2021, 592(7854): 433-437.
[21] Dorcey E, Urbez C, Blázquez MA, et al. Fertilization-dependent auxin response in ovules triggers fruit development through the modulation of gibberellin metabolism in Arabidopsis[J]. Plant Journal, 2009, 58: 318–332.
[22] Giovannoni J, Nguyen C, Ampofo B, et al. The epigenome and transcriptional dynamics of fruit ripening[J]. Annual Review of Plant Biology, 2017, 68: 61–84.
原标题:《【科学普及】植物不同组织之间的对话》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




