- +1
【科学普及】线粒体“细胞动力源"的新功能 (Beyond ATP, new roles of mi…
线粒体是一种特殊的双膜细胞内隔室或细胞器,通常被称为“细胞的动力源”,因为它能产生大量用于促进细胞生化反应的ATP。线粒体还以生成合成大分子(如糖类、蛋白质、脂类和核酸)的代谢物而闻名。在20世纪90年代中期,新的证据表明,线粒体除了在生物能量学和生物合成中的典型作用外,还可以作为信号细胞器出现,这使我们对线粒体在控制细胞功能中的作用的看法发生了巨大转变。在接下来的25年里,来自多个小组的工作已经证明了线粒体信号如何决定不同的生理和病理生理结果。在这篇文章中,我们将简要讨论线粒体与细胞质和其他细胞器通讯以调节细胞命运和功能并发挥旁分泌作用的不同机制。我们对线粒体与细胞其余部分之间通讯的分子理解,即线粒体信号,可以揭示新的治疗策略,用以改善健康或减轻病痛。
根据一项主流的内共生理论,14.5亿多年前,两种原核生物——一种古细菌和一种α-蛋白细菌发展出一种互惠或共生的生物关系,以支持彼此的营养需求。最终,古细菌获得了α-蛋白细菌,使其成为原始线粒体。虽然对α-蛋白细菌和古细菌之间共生的潜在机制的解释还不是很清楚,但目前的数据表明,宿主古细菌和内共生体α-蛋白细菌之间的代谢物交换构成了这种共生的基础。随着时间的推移,内共生菌将其大部分DNA传递给宿主核,只保留了部分基因。到目前为止,线粒体在所有真核生物中普遍存在,并不断地与细胞质交换代谢物。
1890年,德国病理学家和组织学家Richard Altman首次认识到这些看起来像线粒体的结构无处不在,并为它们创造了一个名字:生物母细胞(bioblasts)。考虑到它们在精子发生过程中的出现,1898年,Carl Benda为这些结构引入了“线粒体(mitochondria)”这个名字(源自希腊语“Mitos”:线和“Chondros”:颗粒)。线粒体是双膜结合的细胞器,外膜朝向胞浆,内膜具有凸入基质的隆起。大部分电子传递链(ETC)复合体定位于嵴,三羧酸(TCA)循环酶和线粒体基因组定位于基质。
在接下来的80年间,广泛的研究确定了线粒体的两个重要功能,即合成细胞的能量货币ATP,以及产生生物合成中间体(图1)。柠檬酸循环,也被称为TCA循环,发生在真核细胞的线粒体基质中,可以氧化糖酵解产生的丙酮酸、脂肪酸和氨基酸,并产生代谢中间产物和还原等价物(如NADH和FADH2)。这些还原等价物将电子送入ETC,ETC将质子泵过线粒体内膜,产生电化学梯度,这是通过氧化磷酸化产生ATP所必需的,也是蛋白质进出线粒体所必需的。线粒体提供了细胞内大部分的ATP,并帮助细胞维持热力学上驱动许多生化反应所需的高ATP/ADP比率,因此,线粒体被普遍称为“细胞的动力源”。此外,线粒体代谢中间体进入不同的生物合成途径,产生许多重要的大分子,如糖类、脂类、蛋白质和核苷酸。重要的是,线粒体是铁-硫簇和血红素合成所必需的。我们的数据和其他人的数据表明,线粒体的生物合成功能对于支持癌细胞的增殖是必要的。
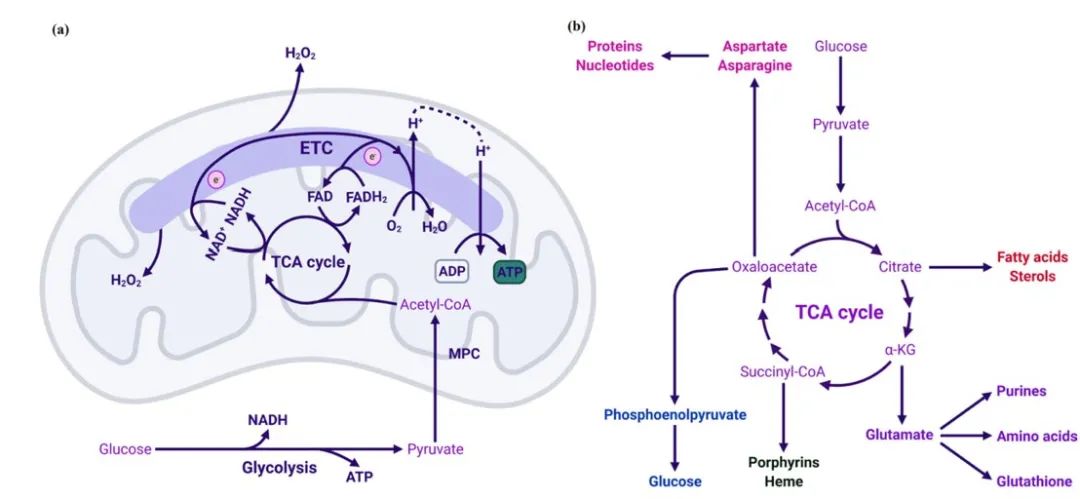
图1 线粒体作为生物能量和生物合成的细胞器。线粒体通过氧化磷酸化产生ATP,利用TCA循环代谢产物支持大分子合成
到了1990年,线粒体的许多功能特性都被发现了,人们普遍认为在线粒体生物化学领域没有多少东西可以研究了。大部分的注意力都集中在新兴的线粒体遗传学领域。Rosario Rizzuto及其同事的一项关键研究表明,线粒体不是简单的自主细胞器,而是能够对胞浆信号做出反应的,他们观察到胞浆钙水平的变化可以引起线粒体钙水平的变化。随后,王晓东在埃默里大学医学院的实验室于1996年报告的一项突破性实验表明,线粒体释放参与氧化磷酸化的ETC的关键组分——细胞色素c,以诱导一种不同形式的程序性细胞死亡,即细胞凋亡。因此,细胞色素c除了在ETC中的作用外,还可以作为信号分子,这一事实引发了科学家们对研究其他决定生理和病理生理结果的线粒体信号机制的新兴趣。在过去的25年里,来自多个小组的研究已经确定了线粒体作为信号细胞器的作用(图2)。线粒体和胞浆之间的通讯可以是双向的:从线粒体到胞浆的信号转导被称为逆行信号,而从胞浆到线粒体的信号转导被称为顺行信号。在接下来的几节中,我们将简要介绍不同的逆行信号机制,线粒体可以通过这些机制与细胞进行通信,从而调节生理和病理生理结果。
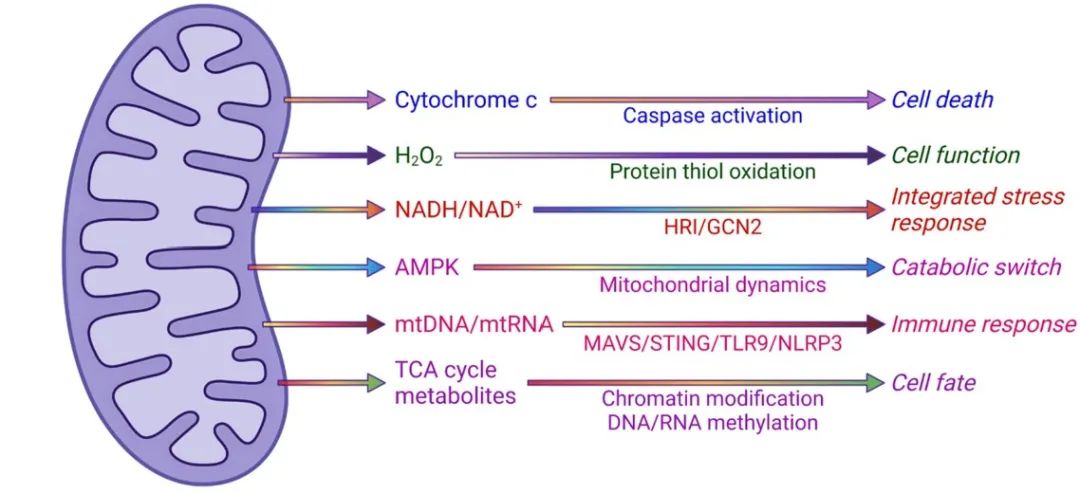
图2 线粒体作为信号细胞器。线粒体活性氧(ROS)、代谢产物、核酸、蛋白质和多肽、NADH/NAD+比值和形态动力学可以作为信号调节细胞的各种过程
线粒体活性氧(ROS)介导的信号转导
ETC产生的超氧化物是细胞呼吸的副产物。在其产生后,超氧化物歧化酶(SOD)立即将超氧化物还原为更稳定、更具膜通透性的H2O2,后者从线粒体泄漏到细胞质中。H2O2可以通过氧化特定的含硫氨基酸,即半胱氨酸和蛋氨酸,作为一种信号分子,这些氨基酸对蛋白质的功能、稳定性和亚细胞定位至关重要。受到王晓东细胞色素c相关发现的启发,我们在1998年证明了线粒体ROS的释放是低氧诱导基因转录所必需的。随后,我们正在进行的工作以及其他研究表明,线粒体产生的H2O2可以控制多种生理过程和疾病,包括免疫、运动、发育、产热、氧气传感、癌症、缺血再灌流、神经退行性变和纤维化。H2O2可能会引发有益的生理反应,而它产生有毒的羟基自由基和脂质过氧化氢的能力则会引发疾病。蛋白质中与生理或疾病相关的H2O2的特定半胱氨酸或蛋氨酸靶标尚未完全破译。
线粒体代谢物作为信号分子
几种线粒体代谢物可以通过调节不同的胞浆酶和核酶的活性来充当信号分子。例如,控制基因表达的核酸(即DNA和RNA)甲基化以及组蛋白甲基化和乙酰化可以受到线粒体代谢产物的调节。线粒体一碳代谢有助于S-腺苷甲硫氨酸(SAM)的产生,S-腺苷甲硫氨酸是组蛋白、DNA和RNA甲基转移酶的底物。TCA循环代谢产物柠檬酸可以输出到细胞质中,并转化为乙酰辅酶A,即组蛋白乙酰化的底物。α-酮戊二酸(α-KG)是另一种三氯乙酸循环代谢物,是调节不同细胞功能的一系列双加氧酶的底物。依赖α-KG的双加氧酶的一些例子包括分别从核酸和组蛋白中去除甲基的核酸去甲基酶和含有Jumonji-C结构域的组蛋白去甲基酶,以及调节低氧反应的脯氨酸羟基酶。相反,琥珀酸、富马酸和2-羟基戊二酸(2-HG)是这些双加氧酶的竞争性抑制剂。因此,细胞可以利用α-KG与这些代谢物的比例在线粒体和胞浆/细胞核之间进行通信。代谢物如何找到它们的特定位置来调节基因表达尚不清楚。
NADH/NAD+可以传递线粒体信号
ETC的线粒体复合体I通过氧化NADH再生NAD+。细胞有不同的机制来感知细胞和线粒体NADH/NAD+比值的变化。例如,细胞有一组依赖NAD+的脱酰基酶家族,称为sirtuins,它们从蛋白质中去除各种酰基(例如,乙酰基、琥珀酰基、丙二酸基、戊二酰基或长链酰基),从而调节它们的活性。哺乳动物有七个sirtuin(SIRT1-SIRT7),它们定位于特定的亚细胞室。SIRT1和SIRT2定位于胞浆或胞核,SIRT6和SIRT7定位于细胞核,SIRT3、SIRT4和SIRT5定位于线粒体基质。增加NADH/NAD+比值可抑制核SIRT1,从而控制小鼠热量限制时的脂肪酸氧化和氨基酸分解代谢。人们对操纵NADH/NAD+比率以改善健康和减轻病痛非常感兴趣。
NADH/NAD+还可以通过调节L-2-HG/α-KG的比例直接决定细胞的命运和功能。缺氧、酸性或线粒体ETC损伤等会减少NAD+再生,增加NADH/NAD+,从而导致L-2-HG水平升高。线粒体和胞质的苹果酸脱氢酶(分别为MDH1和MDH2)和乳酸脱氢酶(LDHA和LDHC)可以利用α-KG作为杂合底物,NADH作为辅酶合成L-2-HG。L-2-HG在结构上类似于α-KG,可以竞争性地抑制依赖α-KG的双加氧酶,包括PHD2(脯氨酸羟基酶结构域-2)、核酸去甲基酶和含有Jumonji-C结构域的组蛋白去甲基酶。PHD2是低氧诱导因子(HIF)依赖的低氧反应的关键调节因子,核酸和组蛋白去甲基酶调节基因表达。我们已经证明,线粒体NADH/NAD+的增加触发L-2-HG的积累,导致调节性T细胞(Tregs)的损伤,同时由于DNA高甲基化而伴随着广泛的自身免疫。
线粒体NADH/NAD+比值还可通过依赖于GCN2的eIF2α(真核细胞翻译起始因子2亚单位α)的磷酸化来激活哺乳动物的综合应激反应。这会抑制总体蛋白质的翻译,但会增强选择性基因的翻译,作为对抗新陈代谢应激的一种适应机制。这些包括转录因子(激活转录因子4(ATF4)和ATF5),它们可以增加新陈代谢相关基因的表达。另一种机制涉及OMA1-DELE1-HRI途径来触发ISR。OMA1是一种定位于线粒体内膜的蛋白,在线粒体应激(如ATP合成酶抑制或严重去极化等)作用下,OMA1裂解同样定位于线粒体内膜的DELE1 (DAP3结合的细胞死亡增强子1)。然后,裂解的DELE1离开线粒体并在胞浆中积累,在那里它与HRI(血红素调节的抑制物)物理上相互作用,并激活其eIF2α激酶活性,以促进ATF4在eIF2α磷酸化下游的翻译。ISR激活与原发线粒体疾病有关。然而,目前还不完全清楚这是一种有益的反应还是不良的反应。
线粒体DNA和RNA可以激活导致免疫反应的信号级联
线粒体DNA(mtDNA)和核糖核酸(mtRNA)可通过不同的信号级联途径渗入细胞质,诱导免疫应答。线粒体DNA能够通过尚未完全定义的机制以损伤相关分子模式(DAMP)的形式渗入细胞质,激活cGAS-STING(干扰素基因的环状GMP-AMP合成酶刺激物)途径,诱导干扰素-β、促炎细胞因子(例如白介素6(IL-6)和肿瘤坏死因子(TNF))等I型干扰素基因转录。例如,由于干扰素β的增加,单纯疱疹病毒感染可以诱导mtDNA的释放,从而增强抗病毒免疫反应。由于线粒体是内共生细菌的后代,具有环状基因组,线粒体DNA被双向转录,从而产生高度不稳定的长线粒体dsRNAs(mtdsRNAs),由重(H)链和轻(L)链编码的RNA组成。通常,RNA降解体会迅速降解L-链编码的RNA。然而,RNA降解体形成中的任何缺陷都会导致mtdsRNAs在胞内过度积累,这类似于病毒复制的dsRNA标记,从而触发I型干扰素反应。值得注意的是,线粒体抗病毒信号蛋白(MAVS)主要定位于线粒体外膜,是dsRNA诱导的干扰素依赖的免疫反应的信号中枢。尚未解答的关键问题包括:(1)mtDNA或mtRNA是如何释放到胞浆中以找到它们各自的免疫受体的?(2)为什么MAV需要线粒体外膜定位以实现最佳功能?
线粒体动力学调节细胞命运和功能
线粒体是高度动态的细胞器,不断经历相反的融合(两个线粒体结合成一个)和分裂(一个线粒体分裂成两个)的过程,通常被称为“线粒体动力学”。在哺乳动物细胞中,有三个大的GTP酶,即丝裂蛋白1(MFN1)、丝裂蛋白2(MFN2)和视神经萎缩1(OPA1),协调线粒体的融合。MFN1和MFN2定位于线粒体外膜,OPA1定位于线粒体内膜。相反,胞浆蛋白动力相关蛋白1(DRP1)被激活后移位到线粒体外膜,触发哺乳动物线粒体的分裂。线粒体动力学还包括嵴重塑、生物发生和有丝分裂,并与细胞凋亡以及干细胞、神经细胞和T细胞的功能有关。线粒体动力学改变了线粒体的大小、形状、分布和由嵴与基质占据的相对线粒体体积,从而可以调节能量产生、高分子合成、钙信号和氧化还原信号以及代谢产物信号,以响应细胞应激或营养供应(图3)。例如,当细胞缺乏营养时,它们会激活AMPK(AMP依赖的蛋白激酶),这是一种关键的细胞能量传感器,因为与ATP相比,AMP的水平上升,以促进分裂,并通过有丝分裂导致有缺陷的线粒体的破坏。
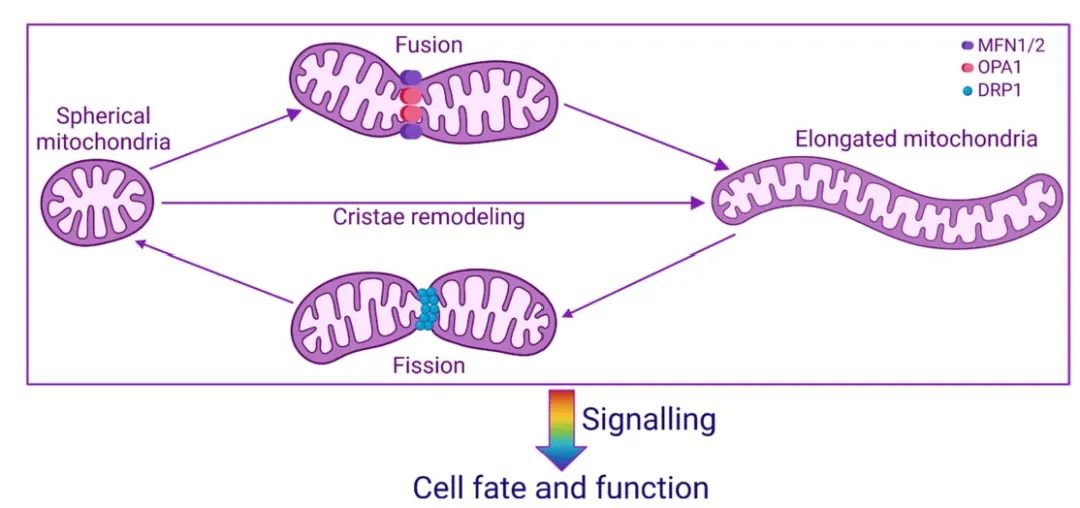
图3 线粒体动力学决定了细胞的命运和功能。线粒体在形态上是非常动态的。它们可以通过嵴重塑以及融合和分裂过程改变它们的形状,将信号传递到细胞的其他部分,以决定细胞的命运和功能
线粒体与其他细胞器的相互作用调节细胞的命运和功能
线粒体物理性地接触几个细胞器,如内质网(ER)、溶酶体、高尔基体、过氧化物酶体和脂滴(图4)。线粒体-内质网接触调节钙信号、氧化还原信号、线粒体动力学和质量控制、脂代谢和未折叠蛋白反应。同样,线粒体-溶酶体的接触调节线粒体和溶酶体的动力学和钙信号,而这一点被与帕金森病有关的突变所破坏。虽然有证据表明线粒体与过氧化物酶体、脂滴和高尔基体之间存在物理接触,但这些相互作用所调控的细胞过程尚未完全破译。此外,具体连接这些细胞器的机制还没有完全了解。
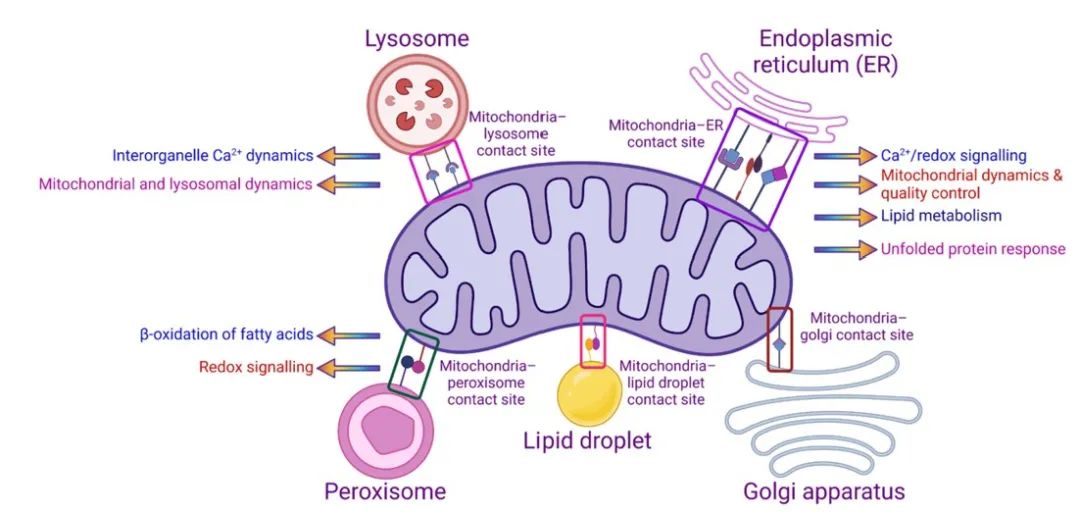
图4 线粒体-细胞器的相互作用调节不同的细胞过程。线粒体可以通过形成物理接触与其他细胞器进行通信,从而调节各种细胞过程
线粒体依赖的旁分泌信号
线粒体应激经常诱导细胞释放可溶性分子,如代谢物(如琥珀酸)、蛋白质(FGF-21、GDF15)或多肽(MOTS-c、Humanin),这些分子经常以旁分泌的方式作用于其他细胞或组织,引发全身反应。这些信号分子也被称为“有丝分裂素”。例如,琥珀酸,一种TCA循环代谢产物,可以作为细胞内的信号分子,也可以作为细胞外的信号分子通过与靶细胞上的G蛋白偶联受体SUCNR1(琥珀酸受体1)结合,并激活G蛋白和下游效应器,来调节免疫反应、脂类分解和组织修复(图5)。同样,GDF15是在线粒体压力下从细胞中释放出来的,与靶细胞上的GFRAL(GDNF(胶质细胞源性神经营养因子)家族α样受体)受体结合,并激活下游效应器来调节体重、食物摄入量、葡萄糖代谢和免疫反应(图5)。
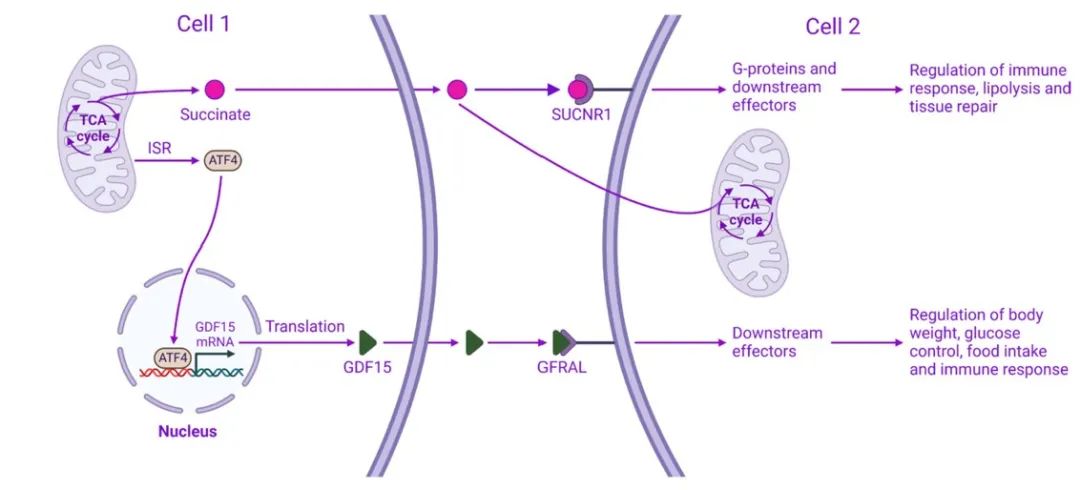
图5 线粒体信号转导可以系统地调节生理和病理过程。线粒体应激可诱导细胞释放被称为有丝分裂素(如琥珀酸和GDF15)的信号分子,这些分子通常以旁分泌方式作用于其他细胞,决定生理和病理结果

总结在过去的一个世纪里,线粒体分别被确定为支持细胞生存和生物质生产的生物能量细胞器和生物合成细胞器。许多教科书展示了碳分子通过中间代谢的命运。自本世纪初以来,线粒体作为控制生理和疾病的信号细胞器的作用引起了人们的极大兴趣。虽然线粒体作为信号细胞器的概念框架已经建立,但对其详细机制的解释仍需进一步探索。随着线粒体作为信号细胞器范例的分子细节被阐明,人们希望出现新的靶点来治疗与线粒体相关的疾病,如帕金森氏病、原发性线粒体疾病和炎症相关疾病。
该文由浙江大学遗传学博士研究生李思琪翻译,浙江大学遗传学研究所管敏鑫教授审核。
原文链接:https://portlandpress.com/biochemist/article/44/4/2/231672/Beyond-ATP-new-roles-of-mitochondria。
管敏鑫教授介绍

管敏鑫,博士,浙江大学“求是讲席”教授,遗传学研究所所长。1983年毕业于杭州大学生物系,1993年获澳大利亚国立大学博士学位;1993-1999年任加州理工学院博士后;1999-2011年在辛辛那提大学儿童医学中心任助理教授、副教授、教授;2011年全职回国加盟浙江大学,曾任生命科学学院院长,医药学部副主任。长期从事线粒体遗传学和母系遗传性疾病的基础研究和临床转化。作为首席研究员(PI),曾经获得5项美国国立卫生研究院(NIH)基金资助。2011年全职回国后,主持国家重点基础研究发展计划(973计划),“十二五”国家科技支撑计划,国家自然科学基金重点项目等多项课题。围绕母系遗传性和药物性耳聋、Leber遗传性视神经病变和母系遗传性心血管疾病的遗传规律、致病机制和精准诊治,开拓创新,取得了一系列具有国际领先水平的原创性研究成果并形成重要的理论体系,多项成果得到转化和广泛应用。
原标题:《【科学普及】线粒体“细胞动力源"的新功能 (Beyond ATP, new roles of mitochondria)》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




