- +1
《细胞》:新冠病毒感染重大发现
原创 奇点糕 奇点网 收录于合集 #新冠 140个
*仅供医学专业人士阅读参考


我关注新冠病毒的研究进展有三年多了,万万没想到的是,现在居然还有新冠感染机制的研究让我大受震撼。
近日,由斯坦福大学Peter K. Jackson和加州大学旧金山分校Raul Andino领衔的研究团队,在顶级期刊《细胞》杂志发表了一篇重要研究成果[1]。
他们发现,新冠病毒进入呼吸道之后,立即与上皮细胞纤毛上的ACE2结合,顺着纤毛穿过正常情况下它们难以逾越的纤毛周围层(PCL),实现对纤毛上皮细胞的感染。更厉害的是,在细胞内完成复制之后,新冠病毒会让纤毛上皮细胞上原本短小的微绒毛变粗变长,穿过PCL层,成功完成“排毒”,以感染更多的细胞。
Jackson团队的这项研究不仅揭开了新冠病毒感染呼吸道细胞的谜底,还破解了呼吸道病毒绕过先天性免疫屏障,来回穿越、扩大感染的原因。
对我而言,新冠病毒的这招来回穿越的伎俩,让我大受震撼。不知道你有没有觉得新冠很厉害,反正我看完之后心跳加快、手心冒汗。

▲ 论文首页截图
虽然新冠病毒感染是一种全身性的系统疾病,但是新冠病毒感染的主要组织和器官还是呼吸道。
在2020年初,科学家就发现了新冠病毒感染全身多种组织细胞的机制。鼻子是新冠病毒感染的主要器官和第一站[2],科学家到现在还没弄明白,新冠病毒究竟是如何穿过黏液层和纤毛周围黏蛋白这个物理屏障,进而感染鼻上皮细胞的。
要知道纤毛周围层(PCL)是一层非常厉害的天然免疫防线,一般情况下,只有小颗粒(25nm)可以穿过PCL,而新冠病毒这种直径达到100nm的病毒是无法穿越PCL的[3]。
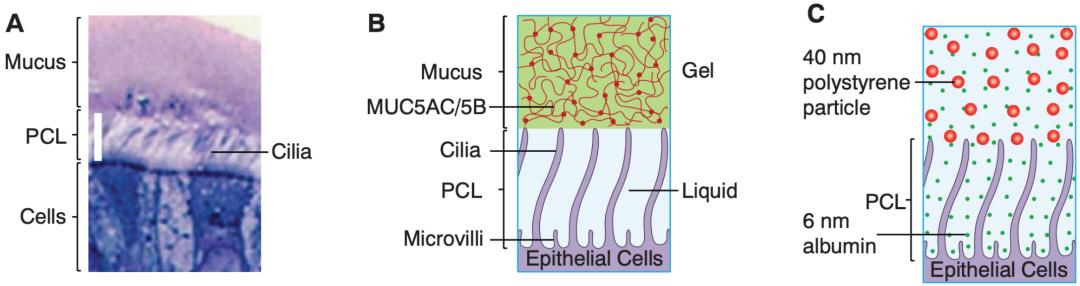
▲ 气道的结构,以及PCL的通透性[3]
那新冠病毒等体型巨大的呼吸道病毒,究竟是如何感染鼻腔纤毛上皮细胞(CEC)的呢?
有两个信息点让Jackson和他的同事们眼前一亮。
首先,新冠病毒感染细胞所必需的ACE2和TMPRSS2,纤毛上面都有[4,5];其次,纤毛细胞的纤毛刚好穿过整个PCL层[3]。那最可能的方式就是,新冠病毒把露在PCL外面的部分纤毛作为突破口,然后顺着纤毛感染了纤毛上皮细胞。
基于人鼻类器官,他们首先证实人鼻纤毛上皮细胞确实是新冠病毒感染鼻腔上皮的主要入口。而且他们还发现新冠病毒感染纤毛上皮细胞还存在一个动力学瓶颈:不管采用多大的感染复数(MOI,病毒粒子和细胞的比例),在接种病毒6和24小时候,都只有3%的鼻纤毛上皮细胞是新冠病毒阳性;到接种的48小时之后,阳性率才增加到80%。
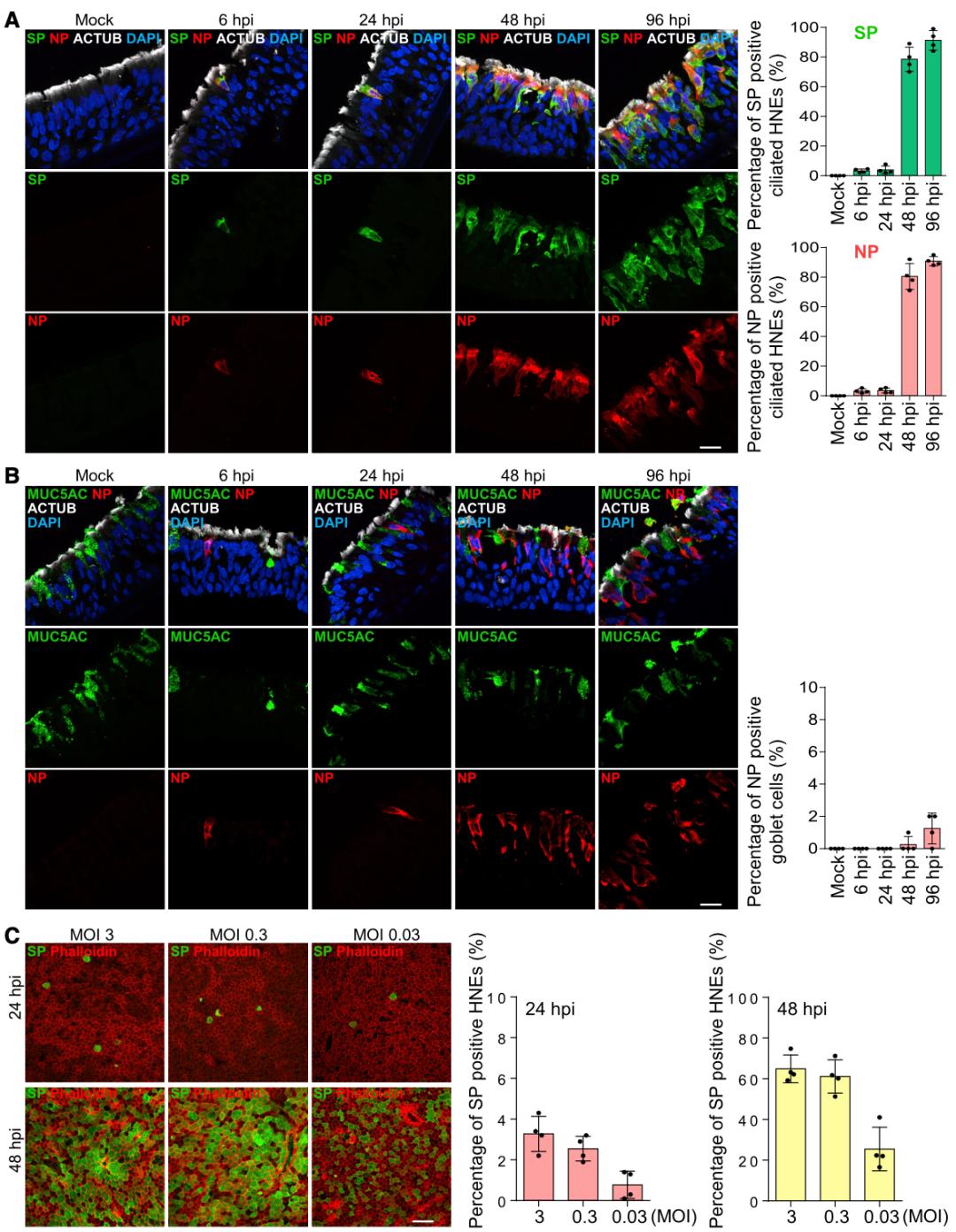
▲ 新冠感染纤毛上皮细胞存在动力学瓶颈
随后,借助于各种先进的显微镜和荧光技术,Jackson团队发现,接种新冠病毒6小时之后,浸泡在PCL中的纤毛上确实黏附着病毒,而加入靶向S蛋白的中和抗体后,会抑制新冠病毒在纤毛上的附着,而且细胞感染率也大幅下降。
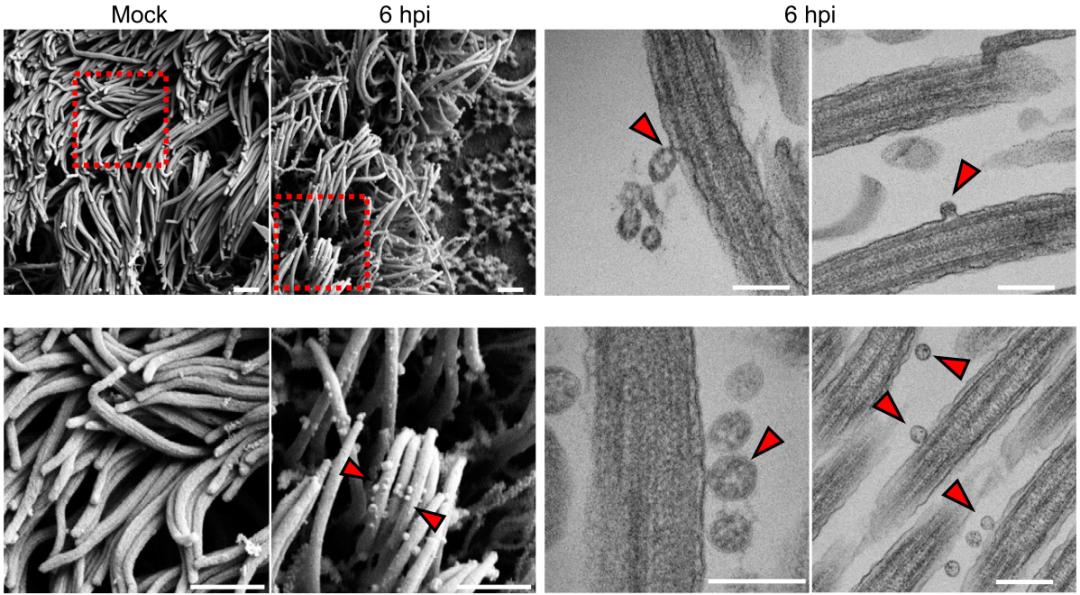
▲ 新冠病毒附着在纤毛上
此外,抑制纤毛的形成也会抑制新冠病毒对人鼻上皮细胞的感染。
以上的结果表明,纤毛确实是新冠病毒感染鼻上皮细胞的关键。
接下来的问题是,新冠病毒是如何顺着纤毛进入纤毛上皮细胞的呢?
基于一系列的分子生物学和药学研究,Jackson团队发现了两种方式。第一种是新冠病毒直接与ACE2和TMPRSS2结合,导致新冠病毒与纤毛融合,病毒释放RNA进入纤毛内部,最后进入纤毛上皮细胞。第二种是,新冠病毒与ACE2结合之后,在纤毛动力蛋白的帮助下,从纤毛的顶端下降到纤毛的底端,再进入纤毛上皮细胞。
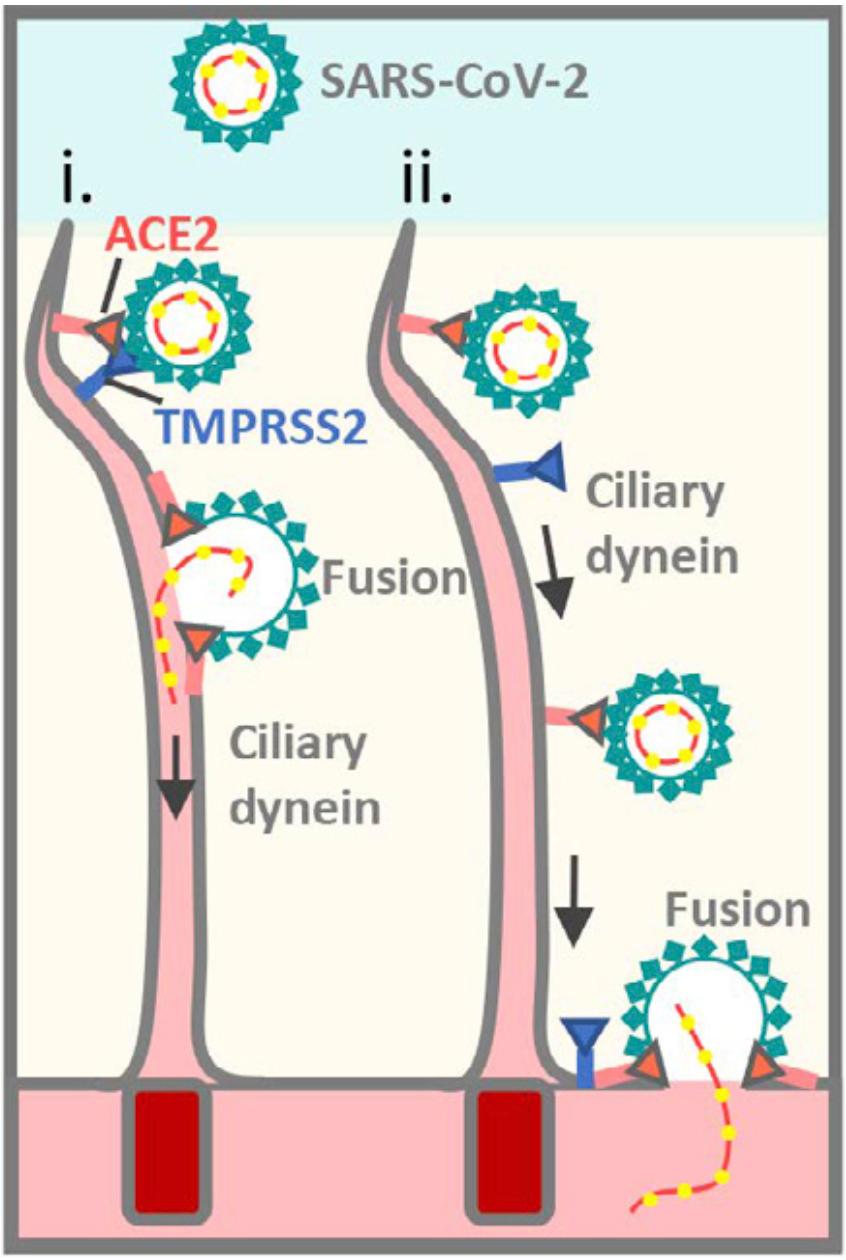
▲ 新冠病毒进入纤毛上皮细胞的两种方式
不知道大家还记不记得前面介绍过的感染延迟现象:48小时候之后病毒才感染更多的细胞。奇怪的是,在Vero细胞(有些灭活疫苗就是用这个细胞系培养新冠病毒的)中,新冠病毒感染却不存在这种延迟现象。这又是什么原因造成的呢?
结合鼻腔上表皮的结构,Jackson团队推测可能是初始被感染细胞排出新病毒的过程限制了病毒的传播。于是,他们开始研究鼻纤毛上皮细胞被感染后是如何排出新病毒的。
结果真有新发现。
原来因为PCL的存在,新冠病毒不仅感染纤毛上皮细胞有困难,在纤毛上皮细胞中复制完成后排出新病毒也很困难。问题都出在过不去上。
那这滞后的一两天,新冠病毒究竟在干什么呢?
原来它们在“修路”!
后续的一系列研究发现,新冠病毒居然可以激活调控细胞骨架重组的p21活化激酶1和4(PAK1和PAK4),让纤毛上皮细胞上原本微小的微绒毛成长成跟纤毛一样又粗又长的巨型微绒毛。借助于这些巨大的微绒毛,新冠病毒成功穿越PCL,完成排毒,感染更多的细胞。
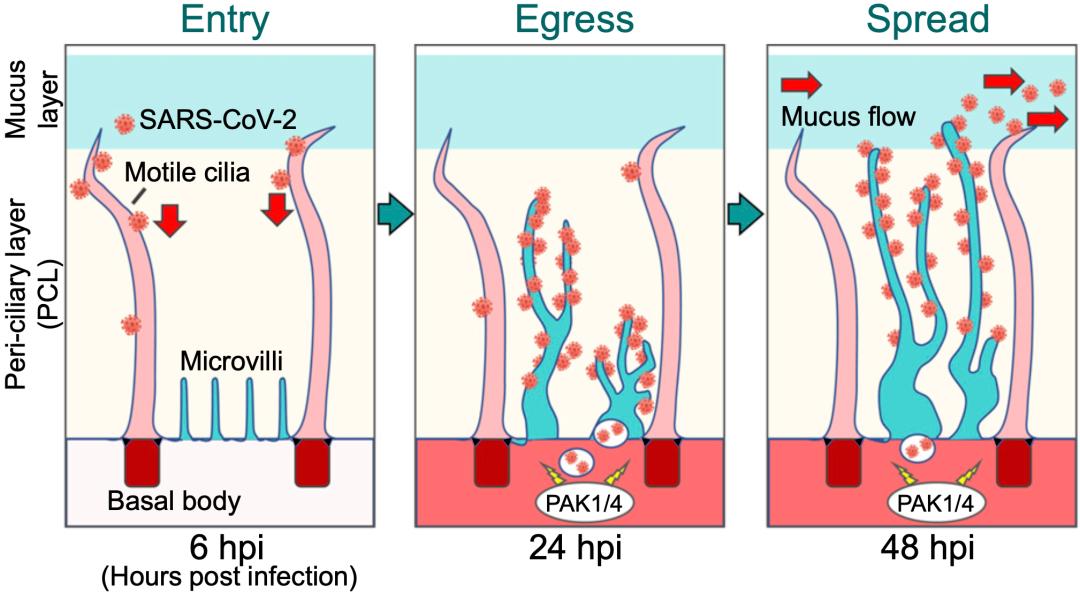
▲ 新冠病毒入侵和排毒的机制示意图
Jackson团队还发现,微绒毛上没有ACE2和TMPRSS2,因此,巨型微绒毛是新冠病毒打造的排毒专用通道。值得一提的是,这个新机制的发现,也让科学家发现了新的抑制新冠病毒感染的方法,即,抑制微绒毛的形成。
在研究的最后,Jackson团队探讨了奥密克戎变异株传染性强的原因,以及是否也存在类似的机制。
研究结果表明,奥密克戎感染上呼吸道用的也是这套机制,不过与其他变异株相比,奥密克戎变异株感染速度更快,在接种6小时后感染的细胞为10%,24小时时为40%,远高于其他毒株的1-3%。电镜观察发现,附着在纤毛上的奥密克戎毒株比其他毒株多很多。这也说明,奥密克戎毒株与ACE2的结合能力确实要强于其他毒株。
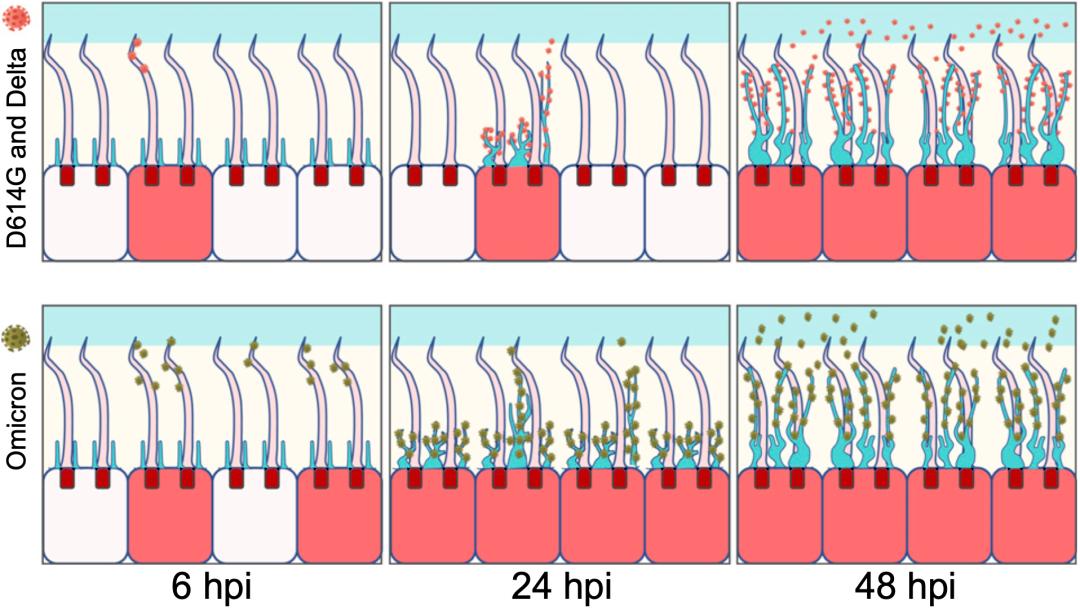
▲ 奥密克戎确实更强
总的来说,Jackson团队这项研究让我们对新冠病毒感染上呼吸道有了更深入的认知,更重要的是,研究还发现了能阻止新冠病毒感染的靶点,这也为鼻腔给药提供了新思路。
未来,或许我们通过鼻腔用药就能在新冠病毒感染人体的第一站阻击新冠病毒的入侵。这中用药方式不仅简单,而且可以避免全身性治疗的不良脱靶效应。
胸外菁英TALK Vol.2,另辟“新”径-Alk阳性可手术患者“新”机遇
参考文献:
[1].Wu CT, Lidsky PV, Xiao Y, et al. SARS-CoV-2 replication in airway epithelia requires motile cilia and microvillar reprogramming. Cell. 2023;186(1):112-130.e20. doi:10.1016/j.cell.2022.11.030
[2].Sungnak W, Huang N, Bécavin C, et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med. 2020;26(5):681-687. doi:10.1038/s41591-020-0868-6
[3].Button B, Cai LH, Ehre C, et al. A periciliary brush promotes the lung health by separating the mucus layer from airway epithelia. Science. 2012;337(6097):937-941. doi:10.1126/science.1223012
[4].Lee IT, Nakayama T, Wu CT, et al. ACE2 localizes to the respiratory cilia and is not increased by ACE inhibitors or ARBs. Nat Commun. 2020;11(1):5453. Published 2020 Oct 28. doi:10.1038/s41467-020-19145-6
[5].Nakayama T, Lee IT, Jiang S, et al. Determinants of SARS-CoV-2 entry and replication in airway mucosal tissue and susceptibility in smokers. Cell Rep Med. 2021;2(10):100421. doi:10.1016/j.xcrm.2021.100421
本文作者丨BioTalker
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




