- +1
Cell:徐华强研究员团队揭示阿片受体家族与内啡肽系统的作用机制
原创 Cell Press CellPress细胞科学

生命科学
Life science
2023年1月12日,中国科学院上海药物研究所徐华强/庄友文团队联合美国北卡罗莱纳大学教堂山分校Bryan L. Roth团队合作在Cell Press细胞出版社旗下期刊Cell上以长文形式在线发表了题为“Structures of the entire human opioid receptor family”的研究论文。该项研究系统分析并明确了各内源性阿片肽对阿片受体的信号活性,并进一步解析了阿片受体家族四个亚型μOR、δOR、κOR、NOPR和各自的选择性阿片肽包括内啡肽、内吗啡肽、强啡肽、皮啡肽和痛敏肽的冷冻电镜三维结构,结合大量细胞水平的功能实验,揭示了多肽类配体和阿片受体的结合模式,阐述了它们的选择性和保守性机制,为“信使-信箱-效能”模式提供了结构和功能支持。徐华强研究员、庄友文副研究员与Bryan L. Roth教授为共同通讯作者,上海药物所博士研究生王悦、庄友文副研究员以及北卡罗莱纳大学Jeffrey F.DiBerto为论文的共同第一作者。该工作获得了国家自然科学基金委、科技部重点研发计划、上海市科技重大专项、中科院特别助理研究项目以及美国国立心理健康研究院、国立卫生研究院等的项目经费资助。
内源阿片系统由四个阿片受体成员以及一系列阿片肽组成,进化上非常保守,广泛分布在中枢神经系统、外周神经系统和免疫系统中,调控镇痛、欣快、奖赏、认知、应激等信号通路,是临床用于治疗疼痛、焦虑等疾病的重要靶标。
阿片受体家族共有四个成员,分别为μOR、δOR、κOR、NOPR,均属于G蛋白偶联受体,主要通过偶联下游Gi蛋白发挥功能。阿片受体不仅会被体内产生的阿片肽激活,也会被外源的阿片类/非阿片类药物激活,包括广为人知的吗啡、芬太尼等药物,在2022年11月10号的Cell期刊上,徐华强研究员/庄友文副研究员团队联合谢欣研究员团队、王明伟教授团队,首次报道了吗啡和芬太尼结合人源μOR-Gi蛋白信号复合体的结构,揭示了两者在结合μ型阿片受体上的差异因素以及μOR介导阻遏蛋白信号的关键结构基础。
靶向μOR的小分子阿片药物广泛用于临床中至重度的急性疼痛,然而它们在强效镇痛的同时也伴随着耐药、呼吸抑制、成瘾等诸多严重的副作用。为了开发更低毒副作用的镇痛类药物,科研人员将目光聚焦到了其它多种不同的策略上,包括靶向不同阿片受体亚型的激动剂、μOR的G蛋白偏好性激动剂和阿片肽类激动剂等。人体中的阿片肽不仅是强效镇痛药吗啡等外源阿片药物的天然模板,而且在机体自身分泌的浓度下不导致成瘾、呼吸抑制等副作用,内源性的阿片肽对四种阿片受体具有很高的亲和力以及激动活性,最重要的是具有高度选择性,这些特性赋予了它们重要的研发价值。
随着X-射线晶体技术和冷冻电镜技术的发展,在近20年间,已经有超过800个GPCR相关的结构被报道(源于GPCRdb),阿片受体作为一类重要的镇痛药物研究靶标,该家族的失活和激活结构也被相继发表。在之前的研究中,很多备受关注的科学问题得以解释,包括阿片受体与小分子拮抗剂/激动剂的结合模式,钠离子口袋介导的激活机制,μOR的偏向性机制等。然而,内源性阿片肽配体如何选择性识别并激活不同亚型阿片受体的分子机制尚不清楚,阻碍了我们对阿片肽的认知与合理的设计改造。
在本项研究中,研究人员首先通过细胞水平的功能实验,较为系统地分析了阿片肽对野生型阿片受体的信号传导特性,由于内啡肽和脑啡肽对μOR、δOR的激活程度相近,为了系统地阐述选择性差异,研究人员最终锁定了内啡肽以及选择性更显著的内吗啡肽、强啡肽、痛敏肽和外源的皮啡肽作为研究对象,分别解析了内啡肽-μOR、内吗啡肽-μOR、强啡肽-κOR、痛敏肽-NOPR,皮啡肽-δOR的高分辨率冷冻电镜三维结构,并用第二信使cAMP的抑制试验、G蛋白和arrestin蛋白的招募实验来分析突变体的特性。
研究发现,所有的阿片肽都是以N端插入的方式进入受体,阿片肽的N端基序YGGF(痛敏肽是FGGF)“信使”结合在阿片受体极为保守的正构结合口袋腔室里,第一个酪氨酸/苯丙氨酸主链上的胺基均与D3.32Q2.60Y7.43基序形成极性网络,该保守腔室对配体的识别和药理活性是必不可少的。结构分析发现,阿片受体的胞外端,主要为ECL2/3以及TM2/6/7的胞外端在序列和带电性上都具有差异性,比如κOR和NOPR的ECL2富含带负电的氨基酸,对应的强啡肽和痛敏肽在ECL2处富含带正电的氨基酸。大规模功能突变实验结果表明,阿片受体ECL2/3和TM2/6/7的胞外端序列不保守性和带电差异性共同决定着阿片受体对阿片肽的选择性结合。
NOPR是阿片受体家族中最后一个被发现的受体,没有被冠以希腊字母名称,本研究解析的痛敏肽结合NOPR的结构,也是首个激活形式NOPR的结构,通过结构比对分析,不出意外地发现它遵循阿片受体通用的激活机制。除此之外,阿片受体对于下游Gi蛋白有着极高的选择性,本研究发现阿片受体的ICL3会形成一个短的α螺旋与Gi形成疏水作用,同时保守的精氨酸与Gi形成静电作用。这也可以部分解释Gi结合的GPCR结构都含有完整的ICL3,而与其他亚型G蛋白(Gs,Gq)结合的GPCR结构中往往缺失了ICL3的电子云密度的原因。
综上所述,研究团队通过解析阿片肽结合的阿片受体结构,系统地阐释了多肽配体的结合模式,揭示了阿片受体中保守的结合口袋以及独特的ECL2/3共同介导阿片肽的作用机制,阐明了阿片受体通用的激活机制以及对下游Gi蛋白的选择性特征。这些工作为理解阿片系统的生物学特性提供了坚实的结构基础,为靶向阿片系统的多肽药物设计提供了模板。
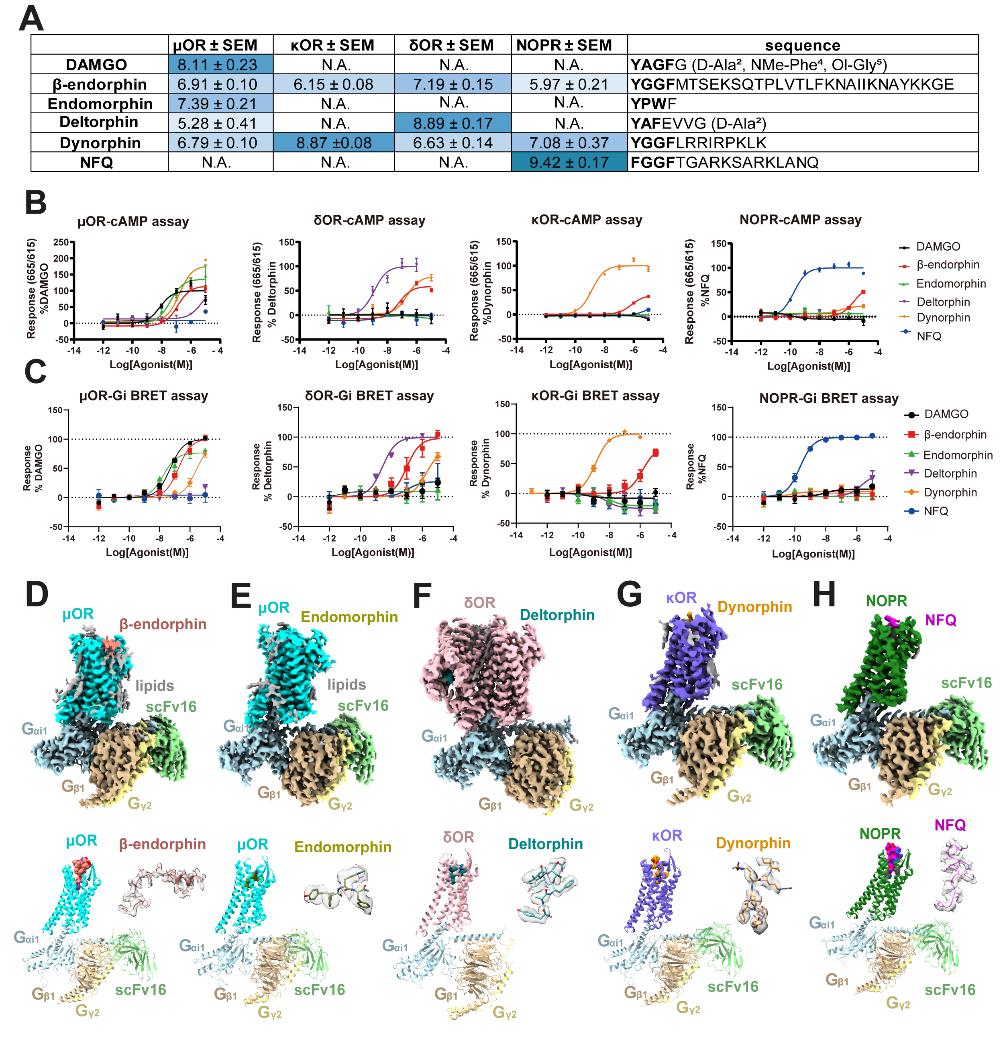
图1. 阿片受体结合阿片肽的功能实验和冷冻电镜结构。A:阿片肽诱导阿片受体激活的亲和力,B:cAMP抑制曲线结果,C:Gi招募实验的曲线结果,D-H:阿片受体结合阿片肽的冷冻电镜结构和原子模型。
作者专访
Cell Press细胞出版社公众号特别邀请徐华强研究员代表研究团队接受了专访,
请他为大家进一步详细解读。
CellPress:
这项研究与两个月前发表的Cell文章有什么关联?
徐华强研究员:
这篇文章其实是我们上一篇Cell文章的姊妹篇,是我们对阿片受体家族的系统性结构药理学探索的进一步延伸。我们最早做阿片受体是因为它是一类非常重要的GPCR药物靶点,而且上海药物所在阿片受体药理研究和新药发现上具有长期的研究历史。阿片类镇痛药,例如吗啡和芬太尼等,目前临床广泛使用的强效镇痛药物,其作用靶标为阿片受体。阿片类药物的滥用也伴随着成瘾和呼吸抑制致死等严重毒副作用,造成目前逐渐扩散的“阿片危机”的发生。我们希望通过剖析阿片受体的活性调控和信号传导的系列分子机制,以求寻找合理设计和开发高效低毒阿片类镇痛药的用途。我们一开始专注于μOR这一阿片受体亚型,因为它是阿片类镇痛药的主要作用靶标。阿片受体研究领域内长期有一个备受争议的“偏好性导致副作用”的理论,我们起初是想解决μOR信号偏好性机理的难题,这个科学问题已经在我们上一篇Cell文章中做了阐述和解答。随着课题的推动,我们把注意力放在了人体内本身就存在的很多内源性的“天然镇痛分子”,即内源性阿片肽。对于内源性阿片肽和阿片受体的结合和活性调控机制研究或许可以给新型高效低毒阿片类镇痛药研究带来新的思路。内源性阿片肽是一些多肽类的神经递质,在氨基酸序列上存在一定的保守性,但是对四种阿片受体具有不同程度的选择性,这非常有意思。我们很好奇它们是如何做到那么相似却又那么不一样,于是诞生了这篇文章,找到了它们既保守又不同的决定因素,所以,两篇文章可以说是相辅相成的关系,而最新这一篇Cell文章更是对阿片受体家族的结构药理学系统性的总结,解决了阿片药理学领域长期存在的配体-受体选择性识别等科学问题。
CellPress:
请问在人体内这么多的阿片肽中,为什么选取研究中的那五个多肽?
徐华强研究员:
正如您所提到的,阿片肽有很多种,而且它们几乎都由前体蛋白通过酶解反应而来。拿内啡肽举例,它的前体蛋白POMC,中文名叫黑素细胞皮质素原,具有241个氨基酸,它可以被剪切为促肾上腺皮质激素(ACTH)和促黑素细胞激素(α-MSH),在HPA轴上发挥着应激反应、糖代谢以及调节色素沉积等生理功能,它也会剪切为多种不同长度类型的内啡肽,如α内啡肽和β内啡肽。此外,人体内还分泌很多其他类型的内源性阿片肽,比如强啡肽、脑啡肽、内吗啡肽、痛敏肽等等,它们又分别有不同长度的亚型存在。虽然有些阿片肽激活不同阿片受体家族的活性无明显差异,但是有一些阿片肽却有着非常显著的选择性,我们基于文献调研,选择了最具选择性的内吗啡肽、脑啡肽、痛敏肽,分别选择性靶向μOR、κOR和NOPR。针对δOR,我们找到了一个很有意思的外源性阿片肽:皮啡肽。皮啡肽是一种在Phyllomedusa属青蛙皮肤的表面存在的阿片肽,对δOR具有高度的选择性激活活性。确定了这些多肽之后,我们进一步结合结构药理和功能分析方法阐释了不同阿片肽对阿片受体的选择性分子机制。
CellPress:
请问团队在未来有什么研究计划?
徐华强研究员:
这两篇文章是我们在阿片受体领域探索的开始。虽然疼痛是身体发出的健康警示信号,提醒我们及时就医,但是长期慢性疼痛很容易摧毁人的身心健康,阿片类药物既像天使又像恶魔,它在强效镇痛方面有着极其显著的效果,但是副作用也非常危险,我们无比希望通过解析和阐述阿片受体活性调控和信号传导的机制,来帮助人们更好的了解它们,同时我们也期盼根据这些发现的机理,以及未来更多的相关研究成果,对现有阿片类药物进行改造,或者从头设计全新的阿片药物分子,将我们的基础研究推向临床。

作者介绍

徐华强
研究员
徐华强研究员(通讯作者)。中国科学院受体结构与功能重点实验室主任,中国科学院上海药物所药物靶标结构与功能中心主任,国家“十二五”重大新药创制课题、科技部973项目负责人。
长期从事激素受体结构研究及相关受体的药物研发。他在核受体与GPCR 的结构解析、信号传导机制、新功能发现以及相关药物研发方面取得系统性创新成果。在Cell、Nature、Science(CNS)等期刊发表论文260多篇,其中CNS 33篇,引用次数超过31000次,连续多年被评为“全球高被引学者”,并获得专利十余项。研究成果曾被Science期刊评为“2009年十大突破之一”、入选“2014年度中国科学十大进展”和入选两院院士评选“2015年中国十大科技进展新闻”。2016年荣获国际蛋白质学会Hans Neurath奖和“药明康德生命化学研究奖”杰出成就奖。2019、2021和2022年荣获中国科学院优秀导师奖。2020年荣获上海市“白玉兰纪念奖”。2021年荣获第十三届“谈家桢生命科学成就奖”。2022年荣获第二十二届“吴阶平-保罗杨森医学药学奖(吴杨奖)”。2022年荣获第九届“侨界贡献奖”一等奖。2022年荣获上海市“白玉兰荣誉奖”。

庄友文
副研究员
庄友文(共同通讯作者,共同第一作者)。中国科学院上海药物研究所副研究员。主要研究方向为G蛋白偶联受体(GPCR)结构药理研究和基于GPCR结构的理性药物设计。主要针对与帕金森氏症(PD)、阿尔兹海默症(AD)、精神分裂症和疼痛等神经精神类疾病密切相关的神经递质GPCR药物靶标,对该类GPCR的药物分子识别模式、信号传导分子机理以及药物-受体靶标构效关系开展研究,并以此为基础开展新药设计。已发表SCI学术研究论文13篇,综述1篇。近三年,围绕着GPCR结构药理研究领域,以通讯或第一作者身份在国际顶尖期刊Cell(4篇)、Cell Res、Nat Chem Biol以及Nat Commun(3篇)等发表9篇研究论文,2021年在Cell发表同期封面故事文章,2022年发表Cell同期亮点文章并被同期评论,获Faculty Opinions推荐,相关研究成果获得同行高度评价。这些研究成果为推动靶向神经精神类疾病等设计更为安全有效的药物奠定了重要的分子基础和理论依据,提供了新思路。获得包括第二届上海市科技青年35人引领计划、中科院院长奖等奖项。

王悦
博士研究生
王悦(第一作者),上海药物所在读博士生,师从徐华强研究员,从事阿片受体和胃饥饿素受体等药物靶点受体的药理结构学研究。以第一作者身份发表两篇Cell,一篇Nat Commun,曾获中科院三好学生称号。
注:参与本项研究的共同通讯作者还有美国北卡罗莱纳大学教堂山分校的Bryan L. Roth教授,该论文的共同第一作者还有Roth实验室的Jeffrey F.DiBerto博士。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Cell上
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Structures of the entire human opioid receptor family
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(22)01545-8
▌DOI:
https://doi.org/10.1016/j.cell.2022.12.026
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




