- +1
中山大学邝栋明团队揭示免疫治疗通过重塑IgG抗体特征来介导肝癌免疫逃逸
原创 Cell Press CellPress细胞科学

生命科学 Life science
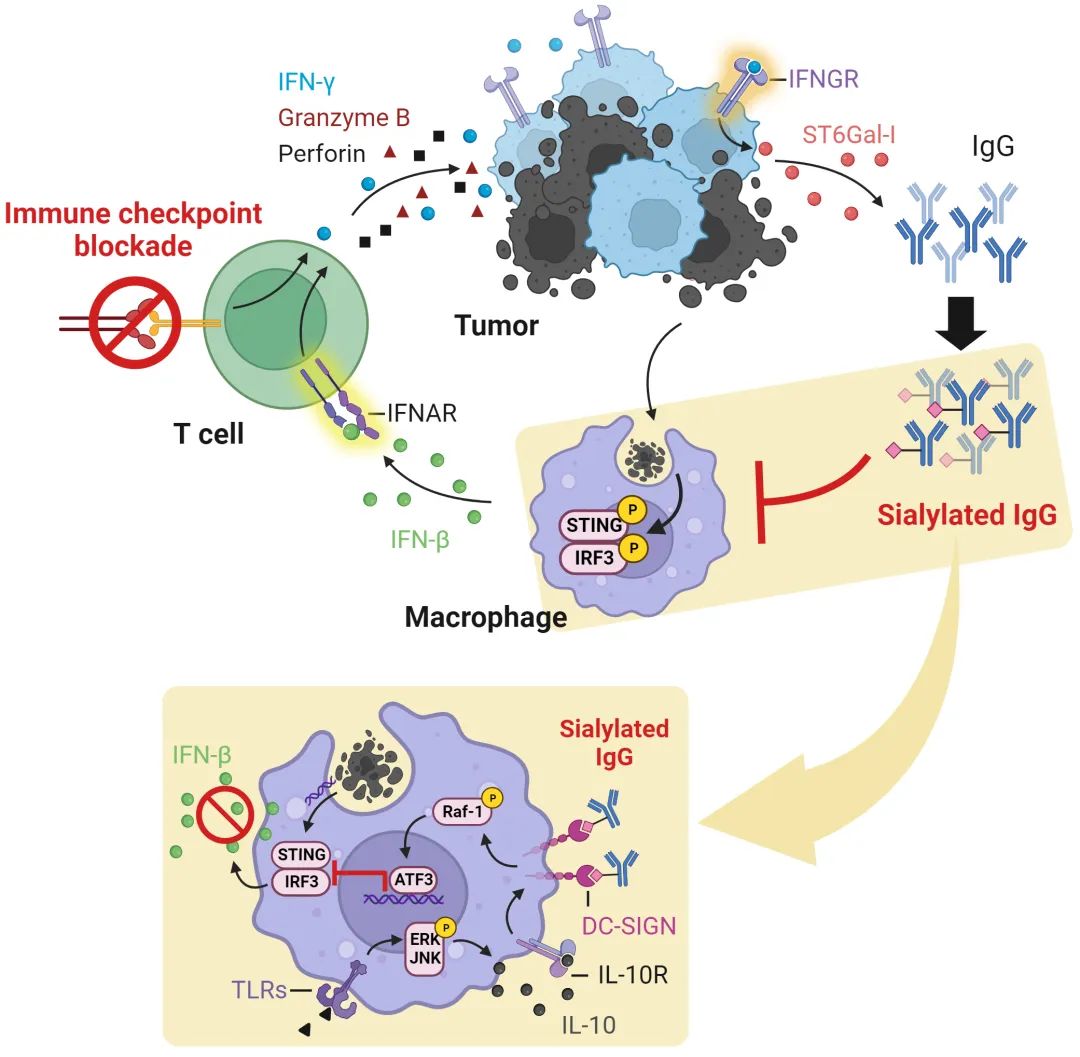
2022年12月22日,中山大学生命科学学院邝栋明教授团队在Cell Press细胞出版社期刊Immunity上在线发表了一篇题为“Immune checkpoint therapy-elicited sialylation of IgG antibodies impairs antitumorigenic type I interferon responses in hepatocellular carcinoma”的研究论文。该研究通过分析经免疫检查点封闭(Immune checkpoint blockade,ICB)治疗的肝癌临床标本和小鼠肝癌标本,首次报道了ICB治疗改变了肿瘤组织中抗体的特征,形成了唾液酸化修饰IgG抗体这一现象,并揭示了唾液酸化IgG抗体阻断巨噬细胞I型干扰素产生的机制,提出了抑制IgG抗体唾液酸化修饰联合ICB的新型肝癌治疗策略。这些新发现率先从IgG抗体糖基化修饰模式调控角度揭示了ICB治疗的新型负反馈机制,是糖基化免疫检查点(glyco-immune checkpoint)研究领域的重要拓展,同时为建立更高效的ICB治疗新策略提供了理论支持和实验依据。
免疫检查点封闭(Immune checkpoint blockade,ICB)通过恢复和加强效应T细胞的抗肿瘤功能发挥抗肿瘤的作用,在多种实体瘤中展现出良好的应用前景。然而,能够从ICB治疗中真实获益的肿瘤患者数量仍十分有限。如,中晚期肝癌患者中经ICB治疗后仅有不到20%具备缓解率。因此,寻找可指征ICB疗效的新型生物标记物以及制定更高效的联合治疗策略显得尤为重要。值得强调的是,效应性CTL细胞(Cytotoxic T Lymphocyte,细胞毒性T淋巴细胞)和浆细胞往往共聚集于肿瘤的炎性区域。目前关于ICB治疗如何增强T细胞功能已有大量报道,但是关于ICB治疗能否以及如何调控抗体的反应特征,我们仍知之甚少。
N-连接的糖基化是涉及许多生物学功能的主要蛋白翻译后修饰方式之一。lgG抗体的N-连接糖基化修饰主要发生在Fc区CH2恒定结构域重链297位的保守天冬酰胺上。在唾液酸转移酶ST6Gal-I或ST6Gal-II的催化下,N-连接的聚糖可以进行末端唾液酸化修饰,这种修饰使Fc区优先结合II型Fc受体DC-SIGN和CD23,而非I型Fc受体FcγRI、FcγRII和FcγRlll。已证实唾液酸化修饰IgG抗体在多种自身免疫疾病的患者外周血中显著减少,回输唾液酸化修饰IgG抗体能够有效缓解相关疾病的进展。目前,关于N-连接的唾液酸化修饰IgG抗体在人体肿瘤中的作用及调控机制仍鲜有报道。
基于以上研究背景,研究人员利用串联质谱技术检测了接受不同治疗方案的肝癌患者手术标本中IgG抗体的糖基化修饰情况,鉴定出唾液酸化修饰IgG抗体在接受αPD-1治疗的患者组织标本中显著富集,发现效应T细胞通过γ干扰素—ST6Gal-I依赖性途径触发lgG抗体的唾液酸化修饰。进一步证实,肝癌中DC-SIGN+巨噬细胞是唾液酸化修饰lgG抗体的主要靶细胞。与唾液酸化修饰的lgG抗体互作后,DC-SIGN刺激下游Raf-1信号并刺激ATF3表达上调,这一效应进而使cGAS—STING通路发生失活,最终消除I型IFN介导的抗肿瘤免疫效应。有意思的是,虽然IgG抗体的唾液酸化修饰程度增强可作为生物学标记物指示ICB治疗的有效性,但阻断IgG抗体的唾液化修饰可显著增强ICB治疗引发的抗肿瘤免疫应答。因此,靶向ICB治疗触发、基于IgG抗体的负反馈机制有效提高癌症免疫治疗的疗效。
中山大学生命科学学院邝栋明教授和魏瑗副教授为该论文共同通讯作者。中山大学肿瘤防治中心吴锐奇博士、劳向明主任医师,以及中山大学生命科学学院陈东萍特聘副研究员为该论文共同第一作者。研究工作得到了中科院大连化学物理研究所秦洪强研究员,中山大学肿瘤防治中心徐立教授、陈敏山教授、郑利民教授,复旦大学附属中山医院高强教授等合作者的大力支持。该研究得到国家自然科学基金委杰出青年基金和重点项目的支持。
作者专访
Cell Press细胞出版社公众号特别邀请邝栋明教授代表研究团队接受了专访,请他为大家进一步详细解读。
CellPress:
抗体唾液酸化修饰的发现对理解B细胞/体液免疫在肿瘤进展中的作用,以及对肿瘤治疗有什么样的启发?
邝栋明教授:
我们的研究发现表明:ICB治疗诱导IgG抗体唾液酸化修饰这一过程在细胞外发生。也就是说,肿瘤中所有IgG抗体,无论是由浆细胞产生的内源性IgG抗体还是靶向治疗使用的外源性IgG抗体,都有可能在患者接受ICB治疗时发生唾液酸化修饰,进而丢失其原有的效应功能并转化成促肿瘤的唾液酸化IgG抗体。因此,我们认为在肝癌进行单独ICB治疗或靶免联合治疗时都需要考虑这个负反馈作用的影响,从而设计更合理的治疗方案。
CellPress:
为什么会关注到抗体特征在免疫检查点封闭治疗中的情况/作用?
邝栋明教授:
我们研究团队过去一直致力于肝癌中B细胞发育以及ICB治疗的相关研究。其中,我们关于肝癌炎症微环境诱导IgG阳性浆细胞的研究前些年就发表在肿瘤学知名期刊Cancer Discov和胃肠学期刊Gastroenterology上。与ICB相关的研究也先后在J Exp Med和J Clin Invest上报道。这个工作是我们在原有研究发现的基础上结合文献资料做出的新思考。我们在阅读文献时,意识到唾液酸化IgG抗体主要发挥诱导免疫耐受的功能,而且在自身免疫疾病患者中显著下调,就开始尝试在肿瘤患者中探讨这一科学问题。
CellPress:
除了ICB治疗,其他免疫治疗是不是也存在这个现象?
邝栋明教授:
在我们的研究中,ICB治疗主要是通过激活T细胞产生γ干扰素来诱导IgG抗体发生细胞外唾液酸化修饰。换句话说,唾液酸化IgG抗体升高这一现象不完全局限于ICB治疗。因为其它肿瘤免疫治疗策略,包括CTLA、Tim-3阻断也可促进效应T细胞产生γ干扰素,以及Car T和Car NK治疗也可有效提高肿瘤中γ干扰素的水平。也就是说,对大多数的免疫治疗来说,都可以考虑存在唾液酸化IgG抗体升高这一负反馈机制。
CellPress:
在其他肿瘤模型中,是否也存在唾液酸化IgG抗体?
邝栋明教授:
是非常可能存在的。在我们的研究模型中,唾液酸化IgG抗体的形成取决于三个条件:(1)IgG抗体的存在(这可以由IgG阳性浆细胞提供或外源性输入,如靶向治疗);(2)γ干扰素诱导肿瘤细胞或上皮细胞表达唾液酸转移酶(这个也可以是内源性或诱导性发生的);(3)激活血小板释放作为糖基供体的唾液酸底物(这种现象在很多肿瘤中都有相关报道)。可见,只要在符合这些条件的肿瘤,都可能出现唾液酸化IgG抗体介导的负反馈机制。
CellPress:
正如今年诺贝尔化学奖所关注到的,糖基化修饰和唾液酸化修饰抗体对肿瘤治疗有重要作用。你们后续还会围绕这个主题开展哪些工作?
邝栋明教授:
我们这篇研究论文大概在十月初就Accepted in principle,当时诺贝尔化学奖还未公布。公布后,我们发现获奖者的观点跟我们的观点非常一致。当时,我们整个团队都很兴奋,主要是因为自己研究工作得到充分的肯定。考虑到肿瘤糖基化修饰和唾液酸化修饰对ICB治疗疗效非常关键,我们后续的工作希望能利用新的技术手段,开发能同时具备免疫检查点阻断和IgG抗体唾液酸化过程阻断的药物,为临床肿瘤治疗提供“王炸”组合。
作者介绍
邝栋明
教授
邝栋明,中山大学生命科学学院教授,全国优博,国家杰出青年基金获得者,广东省珠江学者特聘教授。近年来以肝癌为主要模型,研究间质免疫细胞与癌细胞之间的相互作用和潜在机制,探讨以间质免疫细胞作为肿瘤分子分期和治疗靶标的可行性;作为通讯作者在Immunity、Cancer Discov、Gastroenterology、J Clin Invest、Sci Adv、Hepatology、Nat Commun等期刊发表系列论文。曾获教育部科学研究优秀成果奖一等奖、广东省自然科学技术奖一等奖和获国家自然科学奖二等奖。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Immunity上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Immune checkpoint therapy-elicited sialylation of IgG antibodies impairs antitumorigenic type I interferon responses in hepatocellular carcinoma
▌论文网址:
https://www.cell.com/immunity/fulltext/S1074-7613(22)00604-5
▌DOI:
https://doi.org/10.1016/j.immuni.2022.11.014
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




