- +1
西湖大学蔡尚团队:肿瘤内菌群在癌症转移中的作用
原创 Cell Press CellPress细胞科学

生命科学
Life science
癌症转移是导致癌症患者死亡的主要原因,近年来的研究表明肿瘤内菌群是肿瘤的重要组成部分,可通过多种机制调控癌症转移行为。瘤内菌群重塑了我们对癌症转移的理解,并为未来的癌症研究和临床治疗指出了新的方向。来自西湖大学的蔡尚研究员团队在Cell Press细胞出版社旗下的Trends in Cell Biology 期刊发表综述,全面总结了肿瘤内菌群表征以及它们在癌症转移过程中的独特功能,并探讨了调控肿瘤菌群作为干预措施对临床癌症治疗的潜在影响。
▲长按识别二维码阅读论文
癌症转移的生物学过程仍然充满众多未知
癌症的转移是一个多步骤的复杂生物学过程,包括播散(dissemination)、内渗(intravasation)、外渗(extravasation)、 定植(colonization)等步骤。我们对癌症转移的决定因素的认知经历了由“种子与土壤”学说的被动适应模型,到“上皮间质转化(EMT)”的主动转移模型,再到近些年来对多种肿瘤微环境成分的关注。一般认为,癌症转移的驱动力来源于细胞演化获得的新的能力以及环境细胞的协助。然而细胞的演化所需的时间与肿瘤早期转移的事实并不一致。临床上,我们目前的认知仍未能帮助我们成功阻断转移的发生。癌细胞如何获得转移能力仍然充满未知。近年来,肿瘤驻留菌群的发现、鉴定以及功能性的探索表明,瘤内菌是潜在的癌症转移的重要参与者,可能介入了癌症转移的各个环节(图 1)。
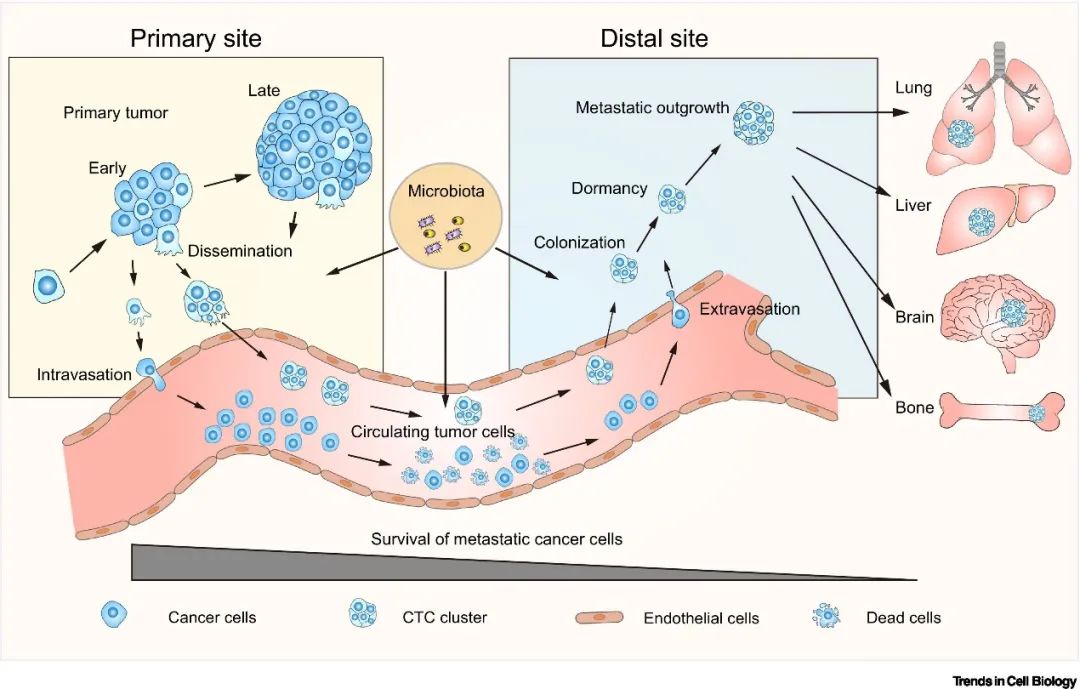
▲图 1 癌症转移的生物学过程及潜在影响因素
瘤内菌群是多种肿瘤的组成部分
与肠道菌群组在癌症进展中的研究相比,我们对瘤内菌群组的理解仍处于起步阶段。由于肿瘤内菌群的丰度低,确切分析肿瘤组织内真实的菌群特征一直都很棘手。直至最近多项研究通过采取严格的环境对照,优化组织菌群DNA提取和建库测序过程以及严格的生信筛选流程全面分析了肿瘤内的菌群特征(1-4)。这些研究共同证实在多种癌症类型中细菌都是肿瘤组织的一个重要组成部分(图 2),并且瘤内菌群有一些共同特点,首先,它们在癌症组织中的丰度比较低,只有约0.1%-10%的癌细胞携带细菌;其次,瘤内菌群群落的多样性通常低于对应的正常组织;最后,瘤内细菌主要寄生于细胞内。这些发现重塑了目前肿瘤微环境的概念框架,为理解癌症微生态系统及其复杂的信号网络提供了一个独特的角度。
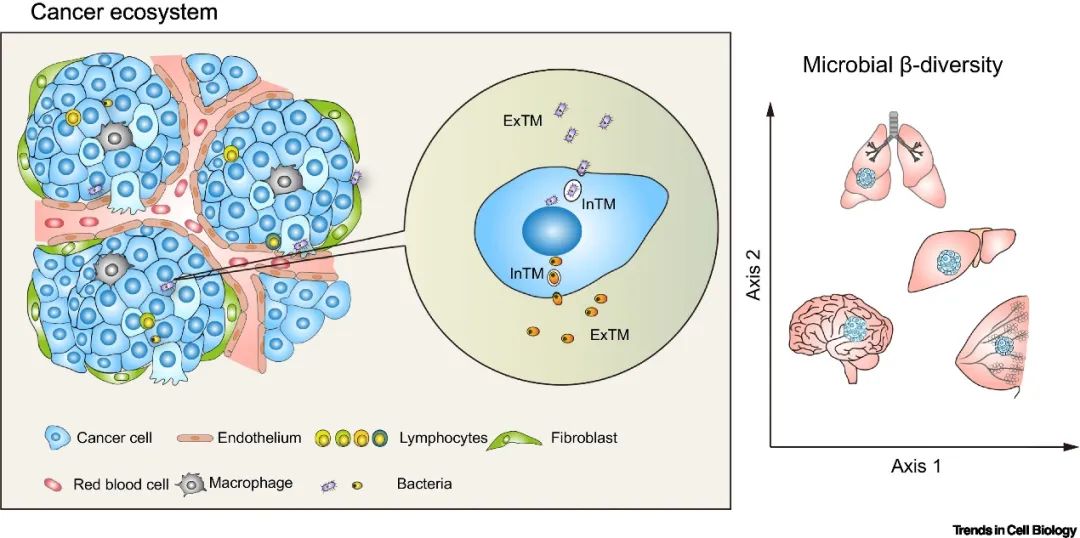
▲图2. 肿瘤内菌群是肿瘤生态系统的重要组成部分。
瘤内菌群在癌症转移中的作用
与广泛的肠道菌群影响肿瘤进展的研究相比,肿瘤菌群在癌症发生发展过程中的功能研究还非常有限,这主要因为肿瘤菌群的检测、鉴定、功能研究缺乏成熟的实验体系。但是,近些年在不同肿瘤系统中的体外体内实验显示,肿瘤菌群具有改造癌细胞内在及外在属性的潜在能力,从而能够影响肿瘤的进展。
1.瘤内菌群调节癌细胞的内在属性促进转移
促进肿瘤的转移癌细胞的内在属性包括:激活干细胞程序/可塑性(增强癌细胞远端成瘤能力)、促进EMT 过程(有利于癌细胞的入侵和传播)、粘附程序(防止 Anoikis 诱发的细胞死亡)和增强机械应力反应(抵抗机械力诱发的损伤)。研究显示,细菌与细胞的体外相互作用可以通过激活β-catenin及notch通路增加癌细胞的干性 (3,4),通过激活NFĸb 通路提高癌细胞EMT转化(4-7),或者调高ICAM1提高癌细胞的粘附能力(8),或者通过调控RhoA-ROCK通路激活增强抗压能力(3),从而提高肿瘤细胞的转移能力。对于乳腺癌细胞内存在的胞内菌,如果使用抗生素清除组织菌群,肿瘤的转移会显著下降(3)。这表明生理状态下的肿瘤菌群对于癌细胞转移起到至关重要的作用。(图3)
2. 瘤内菌群调节肿瘤微环境
除了直接作用于癌细胞,瘤内菌群也可以引发特定的免疫反应调控肿瘤细胞的转移行为。但是瘤内菌群对免疫系统的影响非常复杂,一方面,瘤内细菌可以抑制免疫反应促进癌症转移,另一方面,瘤内细菌可以触发抗癌免疫,因此,瘤内细菌的免疫调节作用可能具有菌种特异性和/或受其细胞内/细胞外生态位的影响。(图3)

▲图3. 瘤内菌群改变癌细胞内在特性并重塑肿瘤微环境
瘤内菌群的临床意义和治疗潜力
90%的癌症患者死于复发或转移。多项研究表明瘤内菌群可用于评估癌症患者的预后生存率(9)、转移或恶性进展风险(10)。然而,目前设想通过调控瘤内菌群治疗癌症仍然非常具有挑战性。例如多项关于抗生素治疗与癌症风险、癌症反应和生存的回顾性研究表明广泛的抗生素治疗导致癌症发病风险增加,对免疫疗法的反应普遍受损。相反,一项关于胰腺癌的研究显示,抗生素治疗与晚期转移性胰腺癌的较好预后相关。
结论
总之,肿瘤内菌群是近年来才被鉴定的肿瘤生态系统中的一个重要组成部分。这些瘤内菌群不仅可以作为肿瘤环境的传感器、 肿瘤病理类型、药物反应和预后的指标,而且还在功能上参与了肿瘤的进展,因此有可能被利用作为药物靶点或与其他一线治疗方案相结合。此外,肿瘤内细菌的细胞外和细胞内定位使其成为药物载体的潜在候选者。
尽管前景广阔,我们对瘤内菌群的认知仍然非常有限,尚缺乏适当的实验工具追踪瘤内细菌的时空动态,也不能准确和有针对性地操纵细菌基因组以探索肿瘤细胞和细菌的互作机制。相信随着对瘤内菌群重要性认识的不断提高,一定会开发出更先进的技术和更好的实验策略克服这些局限性。
本文参考文献(上下划动查看)
1.Nejman, D., et al., The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science, 2020. 368(6494): p. 973-980.
2.Poore, G.D., et al., Microbiome analyses of blood and tissues suggest cancer diagnostic approach. Nature, 2020. 579(7800): p. 567-574.
3.Fu, A., et al., Tumor-resident intracellular microbiota promotes metastatic colonization in breast cancer. Cell, 2022. 185(8): p. 1356-1372 e26.
4.Parida, S., et al., A Procarcinogenic Colon Microbe Promotes Breast Tumorigenesis and Metastatic Progression and Concomitantly Activates Notch and beta-Catenin Axes. Cancer Discov, 2021. 11(5): p. 1138-1157.
5.Zhao, L., et al., LPS-induced epithelial-mesenchymal transition of intrahepatic biliary epithelial cells. J Surg Res, 2011. 171(2): p. 819-25.
6.Kim, Y., et al., Statin pretreatment inhibits the lipopolysaccharide-induced epithelial-mesenchymal transition via the downregulation of toll-like receptor 4 and nuclear factor-kappaB in human biliary epithelial cells. J Gastroenterol Hepatol, 2016. 31(6): p. 1220-8.
7.Slowicka, K., et al., Zeb2 drives invasive and microbiota-dependent colon carcinoma. Nat Cancer, 2020. 1(6): p. 620-634.
8.Zhang, Y., et al., Fusobacterium nucleatum promotes colorectal cancer cells adhesion to endothelial cells and facilitates extravasation and metastasis by inducing ALPK1/NF-kappaB/ICAM1 axis. Gut Microbes, 2022. 14(1): p. 2038852.
9.Riquelme, E., et al., Tumor Microbiome Diversity and Composition Influence Pancreatic Cancer Outcomes. Cell, 2019. 178(4): p. 795-806 e12.
10.Eun, Y.G., et al., Oral microbiome associated with lymph node metastasis in oral squamous cell carcinoma. Sci Rep, 2021. 11(1): p. 23176.

论文作者介绍

蔡尚
博士
蔡尚博士
西湖大学生命科学学院研究员,博士生导师。2003年获北京大学学士学位。2009年获印第安纳大学博士学位。2010-2014年在斯坦福大学干细胞与再生医学研究所从事博士后研究工作,2015年升为助理研究员。2017年底回西湖大学组建干细胞与癌症实验室,围绕干细胞的再生、谱系分化以及疾病状态下的功能异常开展全方位研究。近期发表的研究阐释了肿瘤菌群在乳腺癌转移过程中的重要生理功能。在Cell,Science和Cell Stem Cell等期刊发表多个重要工作。

付爱坤
博士
付爱坤博士
浙江大学动物科学学院百人计划研究员,博士生导师。2017年6月毕业于浙江大学动物科学学院并获得农学博士学位,博士期间主要从事益生菌及肠道菌群调控肠道粘膜免疫方面的研究,研究结果以第一作者发表于Food & Function,其它研究以第一或合作一作发表于Journal of Cellular Biochemistry,Nutrients,mBio。2017年9月加入西湖大学蔡尚课题组,从事肿瘤内菌群的研究工作。2022年4月以第一作者在Cell发表论文Tumor Resident Intracellular Microbiota Promotes Metastatic Colonization in Breast Cancer,首次发现并解释了乳腺肿瘤胞内菌群促进肿瘤转移的功能。
相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Cell Biology,
▌论文标题:
Emerging roles of intratumor microbiota in cancer metastasis
▌论文网址:
https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(22)00258-6
▌DOI:
https://doi.org/10.1016/j.tcb.2022.11.007
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




