- +1
港大用世界首个蝙蝠肠道类器官,证实蝙蝠无症状携带病毒的机制
·周婕团队进一步优化了蝙蝠肠道类器官的培养系统,实现了其在体外的长期稳定的传代、冻存,及复苏的培养。首先,在体外可以源源不断地获得蝙蝠肠道类器官用于实验等各种操作。其次,蝙蝠肠道类器官可以还原蝙蝠肠道的细胞结构及功能,这在蝙蝠病毒的跨物种研究,及蝙蝠免疫系统的研究方面具有重要的意义。

蝙蝠是多种新发传染性病毒的天然宿主。研究表明,中东综合呼吸症冠状病毒(MERS-CoV),SARS冠状病毒 (SRAS-CoV),埃博拉(Ebola)病毒以及目前流行的新冠病毒(SARS-CoV-2)可能都来源于蝙蝠。虽然携带这些严重影响人类及其他动物健康的病毒,蝙蝠本身似乎没有明显的疾病征象,提示蝙蝠的细胞可能存在特殊的抗病毒免疫机制。但是长期以来,科研界缺少一个很好的模型系统来进行详细的研究。
12月19日,香港大学微生物学系周婕教授课题组在《自然》(Nature)杂志子刊《Signal Transduction and Targeted Therapy》(STTT, 影响因子:38.104)在线发表题为“Analogous comparison unravels heightened antiviral defense and boosted viral infection upon immunosuppression in bat organoids”的文章。他们建立并改进了世界上首个稳定持续的蝙蝠肠道类器官培养体系,并将人与蝙蝠的肠道类器官进行了比较,证实了蝙蝠细胞无症状携带病毒的机制可能是抗病毒基因的较高基础表达,特别是更快速、更持久地诱导固有免疫应答,增强了蝙蝠细胞在感染早期抑制病毒扩增的能力。
周婕团队在2020年新冠病毒出现之初即建立了蝙蝠肠道类器官,首次体外证实了SARS-CoV-2 可以感染蝙蝠肠道类器官并在蝙蝠肠道类器官中扩增,相关科研成果发表于《自然-医学》杂志(Nature Medicine)。蝙蝠类器官对于研究大量的蝙蝠病毒,以及蝙蝠病毒的跨物种传播提供了一个全新的、功能强大的工具,受到国际学术界广泛的关注。
但是他们最初建立的蝙蝠类器官最多在体外传代3个月左右,为了建立可以持续稳定传代培养的蝙蝠类器官,在周婕的指导下,课题组博士研究生刘晓娟、万智信,和研究助理教授李存博士对蝙蝠类器官的培养进行了优化,使蝙蝠类器官可以稳定传代培养一年以上。
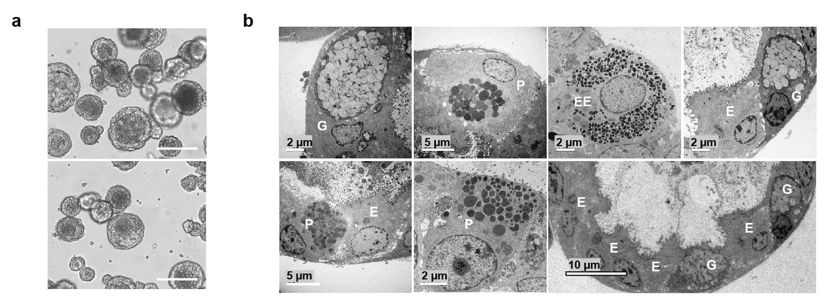
优化后的蝙蝠类器官光镜及电镜图。图片由受访者提供。
他们还发现优化的蝙蝠小肠类器官可以真实地模拟蝙蝠肠道细胞对不同病毒的易感性。蝙蝠类器官可以感染从蝙蝠肠道样品中分离的一株冠状病毒CoV-HKU4, 以及与蝙蝠病毒高度同源的SARS-CoV-2,但是完全不能感染人肠道病毒EV-71。
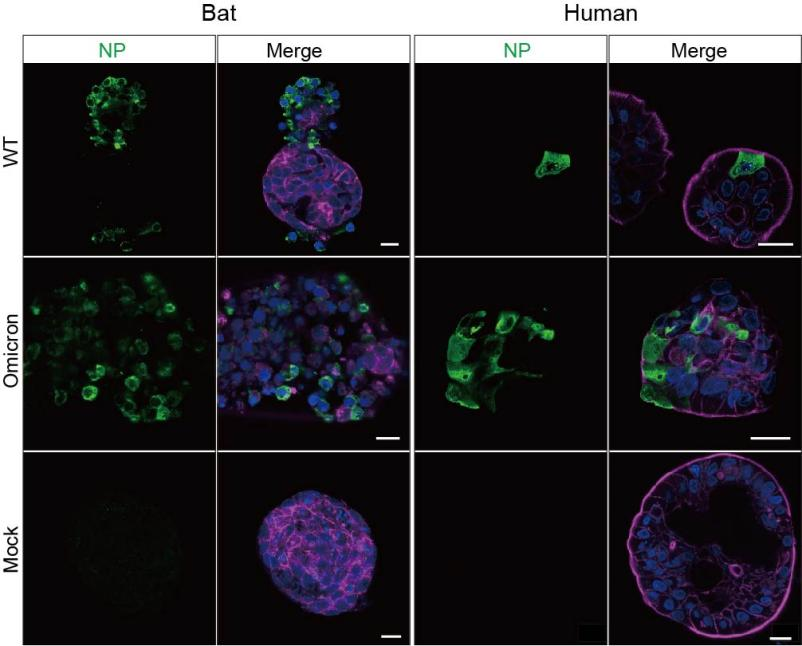
蝙蝠类器官感染新冠病毒。图片由受访者提供。
研究团队对蝙蝠及人的小肠类器官的抗病毒基因的基础表达水平进行了比较,发现抗病毒基因在蝙蝠类器官中的表达显著高于人肠道类器官,并且在用Poly(I:C) 处理模拟病毒感染后,蝙蝠类器官比人的类器官表现出更迅速,更强的,更持久的抗病毒固有免疫反应。蝙蝠类器官通过TLR/RLR信号通路识别RNA病毒,并且在感染早期用免疫抑制剂CYT387处理后,SARS-CoV-2及CoV-HKU4在蝙蝠类器官中的复制显著增强,表明蝙蝠的固有免疫在病毒感染早期可以有效抑制病毒的复制。
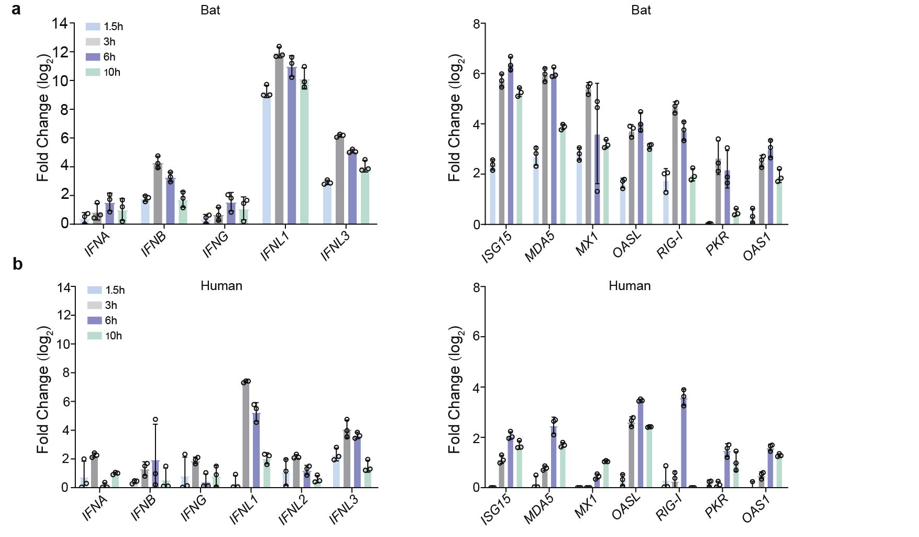
蝙蝠及人肠道类器官Poly(I:C)处理后固有免疫应答比较。图片由受访者提供。
香港大学微生物系周婕教授、袁国勇教授,复旦大学姜世勃教授为论文通讯作者。
周婕现任香港大学新发传染病国家重点实验室及香港大学李嘉诚医学院微生物系助理教授,其研究重点是建立类器官用于研究病毒-宿主相互作用,2021年被Clarivate Analytics Essential Science Indicators 评为世界被引用数排名前1% 的学者之一。
近日,澎湃科技专访周婕教授,解读其研究工作及类器官在临床研究中的应用情况。周婕提到:“实验动物完成的是活体实验,具有免疫系统,这是类器官模型目前不能替代的。但是类器官是具有人类遗传背景的模型,这点是实验动物不能替代的。类器官在药物筛选,疾病模型,肿瘤药物敏感性测试等方面都体现了巨大的优势”。
【对话】
澎湃科技:2020年,你团队培育了全球首个蝙蝠类器官。相比当时,这次的蝙蝠类器官有什么改进?具体来说,它有哪些应用可能?
周婕(香港大学李嘉诚医学院微生物系助理教授):2020年,我们建立了世界上首例可以模拟蝙蝠肠道生理结构及功能的蝙蝠肠类器官,并首次实验证实了新冠病毒可以感染并在蝙蝠肠类器官中进行复制。这次我们发表在《Signal Transduction and Targeted Therapy》(影响因子:38.104)的文章,进一步优化了蝙蝠肠类器官的培养系统,实现了其在体外的长期稳定的传代、冻存,及复苏的培养,这具有非常重要的意义。首先,在体外可以源源不断地获得蝙蝠肠类器官用于实验等各种实验操作。其次,蝙蝠肠类器官可以还原蝙蝠肠道的细胞结构及功能,这在蝙蝠病毒的跨物种研究,及蝙蝠免疫系统的研究方面具有重要的意义。
澎湃科技:你团队的研究证实了蝙蝠类器官比人类肠道类器官表达更高的抗病毒基因,并更快、更持久地诱导固有免疫应答。这有什么现实意义?
周婕:蝙蝠肠类器官比对应人类的肠道类器官在感染病毒后,具有更快,更持久的固有免疫的应答,正是这一强大的免疫应答使蝙蝠可以无症状携带多种病毒。所以我们将人与蝙蝠的固有免疫系统做比较,以期发现病毒复制的关键基因,用于病毒感染的药物研究及治疗。
澎湃科技:你的团队还建立了呼吸道类器官,这对于研发抗呼吸道传染病疫苗(比如COVID-19)有何作用?有什么最新成果?
周婕:我们团队用了6年的时间建立了世界上第一个人呼吸道上皮的类器官培养体系,这一创新性的培养系统可以将整个呼吸道上皮在体外高效重建并稳定扩增,我们建立了上呼吸道鼻黏膜类器官,下呼吸道气道类器官及肺泡类器官,用于新冠病毒不同变种的感染及感染机制的研究。相关的科研成果发表在PNAS (影响因子:11.205)《Cell Discovery》(影响因子:38.079)及《mBio》(影响因子:7.786)期刊上。这是目前最先进最系统的呼吸道类器官培养系统,是研究呼吸道生理和疾病的最好的体外模型系统,同时,我们建立的类器官模型可以广泛应用基础医学,转化医学和临床医学领域多个学科的研究,是研发抗呼吸道传染病疫苗(如新冠、流感疫苗)和呼吸道疾病药物最好的临床前模型系统。
在新冠疫情肆虐全球的当下,我们的呼吸道类器官受到世界的关注,目前我们正在使用呼吸道类器官开发新冠病毒高通量小分子药物筛选及抗体中和评价的平台。相信在不久的将来,我们会将这一类器官药物筛选平台应用于新冠抗体的开发及小分子药物筛选的应用中。我们也期待与各大药企和生物公司合作,共同实现呼吸道类器官的更广阔的应用。
澎湃科技:你曾经说,全球对动物实验管理越来越严,所以类器官在临床研究中越来越重要。相比实验用的动物,类器官有何优势和局限?
周婕:实验动物跟人还是有很大差距的,这些差距包括遗传背景,基因的表达,组织细胞的组成和功能特点,等等;所以使用实验动物研究人的病毒,在很多情况下需要做转基因动物高表达此类病毒的受体才能感染实验动物。实验动物在研究中存在很多弊端,人源类器官就可以解决很多以往不能解决的问题。
澎湃科技:类器官可能代替实验动物吗?
周婕:实验动物完成的是活体实验,具有免疫系统,这是类器官模型目前不能替代的。但是类器官是具有人类遗传背景的模型,这点是实验动物不能替代的。类器官在药物筛选,疾病模型,肿瘤药物敏感性测试等方面都体现了巨大的优势。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




